胃癌新辅助化疗疗效及影响因素分析
刘 怡,张珂诚,郗洪庆,崔建新,高云鹤,梁文全,王鑫鑫,陈 凛
解放军总医院 普通外科,北京 100853
胃癌在最常见恶性肿瘤发病率中排名第5,是第3位肿瘤致死因素[1]。胃癌的发病率在东亚地区最高,尤其是中国、韩国和日本,是美国的7倍[2]。手术是胃癌唯一的潜在治愈手段。近年来我们已推广实施标准化胃癌根治手术,但患者5年生存率仍维持在20% ~ 30%[3]。主要原因是大部分患者发现肿瘤时已是进展期胃癌,手术无法解决可能存在的微转移[4]。多项研究证实新辅助化疗能够有效提高患者生存时间[5-6],从而得到了广泛认可,被美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)所采纳和推荐。新辅助化疗疗效的评价,主要是根据实体肿瘤疗效评估标准(response evaluation criteria in solid tumors,RECIST1.1)来进行[7]。在美国癌症联合委员 会 (American Joint Committee on Cancer,AJCC)第8版胃癌TNM分期中,第一次发布了临床分期和化疗后病理分期标准[8]。这给从降期的角度评价新辅助化疗的疗效提供了依据。本次研究依据第8版TNM分期,回顾性对新辅助化疗疗效进行评判,同时对新辅助化疗疗效影响因素进行分析,绘制列线图,为临床实践提供参考。
资料和方法
1 资料来源 纳入2011年1月- 2017年3月于本院普通外科接受新辅助化疗的胃癌患者。纳入标准:1)病理确诊为胃癌,并且通过CT、EUS检查评估为Ⅱ~Ⅲ期;2)接受了新辅助化疗,并且在本院进行了手术治疗;3)未曾因为其他肿瘤性疾病接受过放化疗;4)有完整的检验、影像学及病理学资料。排除标准:既往因其他肿瘤性疾病接受过放化疗。共纳入176例患者,其中167例接受SOX方案(替吉奥+奥沙利铂)2 ~ 4个周期后进行手术;9例接受XELOX方案(卡培他滨+奥沙利铂)2 ~ 4周期后进行手术。男女比例为3.5∶1,平均年龄为57(21 ~ 75)岁。
2 方法 按照第8版胃癌TNM分期对患者进行化疗前临床分期和术后病理分期。化疗前临床分期主要依据CT及超声内镜(EUS),一些患者还行腹腔镜探查+脱落细胞学检验以排除肿瘤转移。术后分期依据病理诊断。我们将术后病理为ypT0N0M0定义化疗完全反应(CR);与术前分期相比,术后病理达到降期定义为部分反应(PR);保持原来分期定义为稳定(SD);而分期增加定义为进展(PD)。将研究对象按照化疗有效性分为CR和非CR组,CR+PR组和SD+PD组。分别通过单因素回归分析和多因素回归分析,对能够促进CR或CR+PR的临床因素进行筛选。根据结果建立列线图模型。
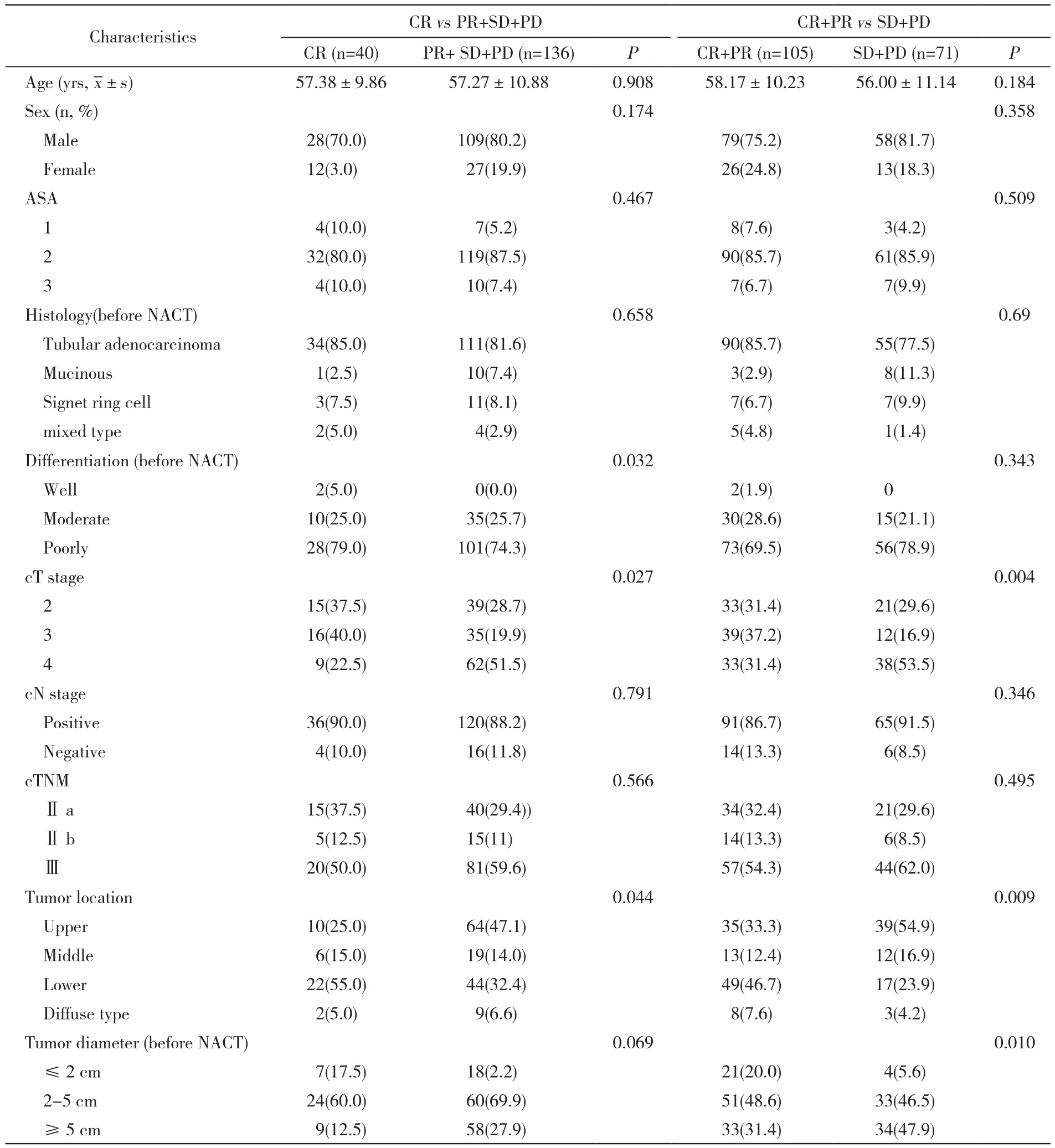
表1 不同疗效胃癌组的临床特征比较Tab. 1 Comparison of clinical characteristics between different groups (n, %)
3 统计学方法 统计学分析采用IBM® SPSS®Statistics 22.0完成。对计量资料选用t检验或方差分析进行比较,计数资料则选用χ2检验或Fisher精确检验进行比较。将单因素Logistic回归分析中P<0.2的因素纳入到多因素Logistic回归中分析影响因素。列线图模型的绘制是经由R语言软件及相关软件包完成。P<0.05为差异有统计学意义。
结 果
1 新辅助化疗疗效 入组患者化疗前临床分期:Ⅱa期55例、Ⅱb期20例、Ⅲ期101例。术后病理提示,完全反应40例(年龄57.4岁,男女比例为28∶12,临床分期Ⅱa=15、Ⅱb=5、Ⅲ=20)、部分反应65例(年龄58.6岁,男女比例为51∶14,临床分期Ⅱa=19、Ⅱb=9、Ⅲ=37)、稳定61例(年龄55.7岁,男女比例为50∶11,临床分期Ⅱa=12、Ⅱb=5、Ⅲ=44)、进展10例(年龄57.3岁,男女比例为8∶2,临床分期Ⅱa=9、Ⅱb=1)。化疗总反应率为59.7%,疾病控制率为94.3%。
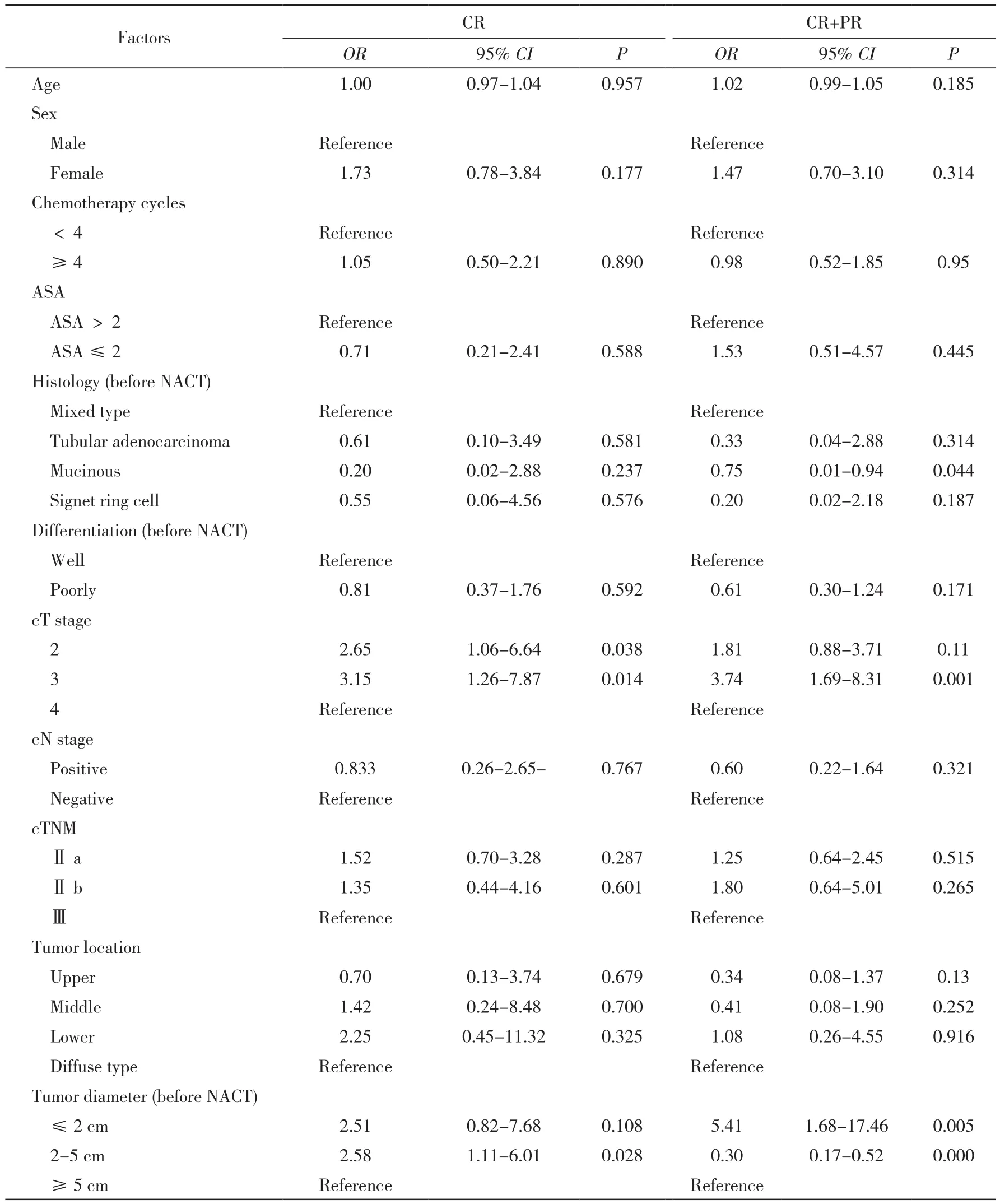
表2 新辅助化疗疗效影响因素单因素回归分析Tab. 2 Univariate logistic analysis of independent predictors of CR and CR+PR
2 新辅助化疗有效性危险因素分析 CR组与非CR组化疗前分化程度、cT分期、肿瘤部位均有统计学差异(P<0.05)。CR+PR组与SD+PD组cT分期、肿瘤部位及化疗前肿瘤直径差异有统计学意义(P<0.05,见表1)。经过单因素Logistic回归分析,与完全反应(CR)相关的因素(P<0.2)有性别、cT分期和肿瘤直径;与化疗有效(CR+PR)相关的因素有年龄、化疗前病理类型、化疗前分化程度、cT分期、肿瘤部位和肿瘤直径(表2)。将这些因素纳入到多因素Logistic回归中分析,最终与化疗有效相关的因素为年龄(P=0.027)、cT分期 (cT3 vs cT4,OR:2.90,95% CI:1.04 ~ 8.01,P=0.041)、肿瘤直径 (≤ 2 cm vs≥5 cm,OR:7.15,95% CI:1.72 ~ 29.65,P=0.007)。见表 3。
3 列线图符合度良好通过多因素回归分析 建立预测新辅助化疗有效的列线图(图1),Bootstrap方法内部验证显示模型符合度良好。列线图的使用,是根据各因素对应分值的总和,在总分栏中标出,对应风险栏,数值越大,说明这一患者接受新辅助化疗越有意义。
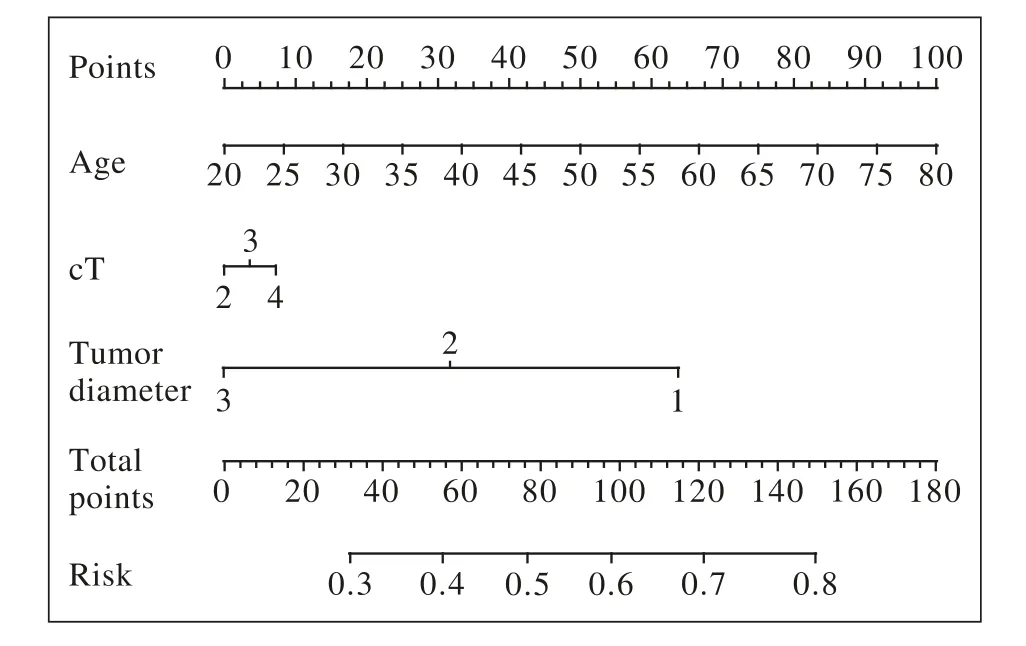
图1 新辅助化疗有效性预测列线图Fig. 1 Nomogram for prediction of response to neoadjuvant chemotherapy
讨 论
胃癌新辅助化疗逐渐被认可,其疗效影响因素的研究也很多。在胃癌的相关研究中,化疗前分化程度与病理完全缓解率的关系被多项研究证明,化疗前分化程度越高,越有可能获得完全缓解[9-10]。但本研究中,并未能证明肿瘤特征与病理完全缓解的关系,这有多方面原因:1)本研究中病理完全缓解组的样本量较少。分散到每个因素各个亚组后,很多亚组只有个位数的样本,这可能对研究结果产生较大影响。2)对有些因素的统计方式可能与既往研究不同,造成一定差异。如肿瘤大小在既往研究中被证明是病理完全缓解的预测因素[11],但在本研究中由于回顾性资料中难以对化疗前肿瘤体积进行准确计算,所以用肿瘤直径代替肿瘤大小。3)纳入的研究因素可能不够全面。本研究中并未将患者的肿瘤标记物、白细胞水平等血液检查指标纳入在内,而有研究表明CEA水平也是病理完全缓解的预测因素[12]。本研究显示年龄、cT分期和肿瘤直径与化疗有效性有关,与之前的相关研究的结论一致[13-14]。临床T分期越低、肿瘤直径越小、年龄越大的患者,越可能从新辅助化疗中获益。
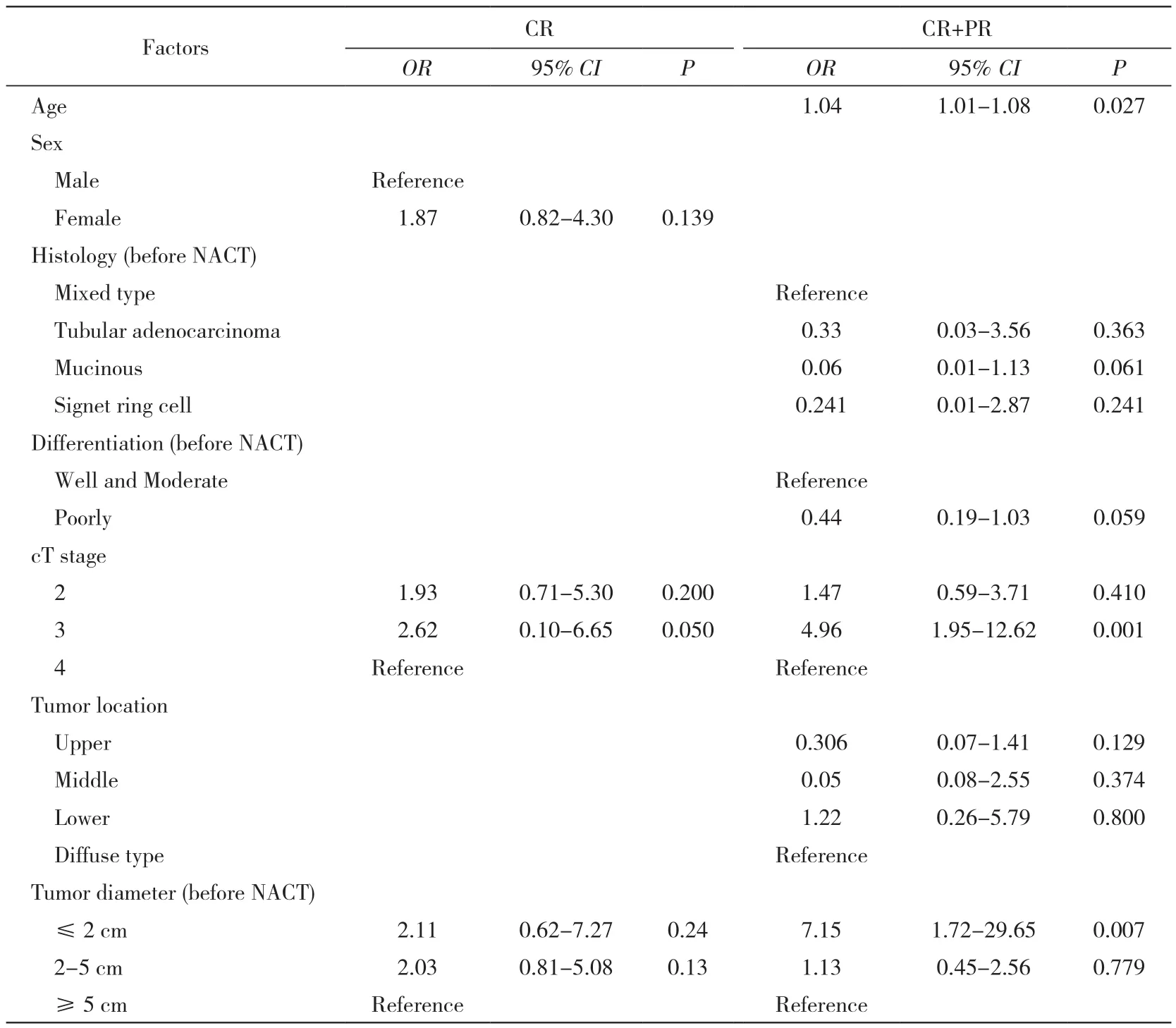
表3 新辅助化疗疗效影响因素多因素回归分析Tab. 3 Multivariate logistic analysis of independent predictors of CR and CR+PR
本研究,首次用AJCC第8版TNM分期来对新辅助化疗患者的临床分期及病理分期进行评判,通过病理完全缓解和分期变化对化疗的疗效进行分类。化疗的总反应率为58.7%,疾病控制率为94.3%,此结果和之前报道一致[15-16]。同时也证明了新的临床分期和病理分期应用于新辅助化疗疗效评估的可行性和有效性。
列线图对于肿瘤个体化治疗的判断和预后的预测有着重要意义。在乳腺癌中,相关文献证明了通过列线图模型预测新辅助化疗疗效是可行的[17]。在胃癌中,有研究通过列线图对新辅助化疗后患者预后进行预测[18],而通过列线图对胃癌新辅助化疗疗效预测未见报道。本研究中针对新辅助化疗疗效预测的列线图综合了年龄、cT分期和化疗前肿瘤直径3个临床特征。在临床中,根据评分可以为患者制订个体化的新辅助化疗周期和术后化疗方案。当然,由于样本量和单中心研究等因素,我们无法对列线图进行外部验证,其预测效果还有待在更多人群中的进一步研究。
1 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
2 RaFiei E, Mohammadian-Hafshejani A, Towhidi F, et al. Lack of Any Relationship of Stomach Cancer Incidence and Mortality with Development in Asia[J]. Asian Pac J Cancer Prev, 2016, 17(8):3777-3783.
3 Patel SH, Kooby DA. Gastric adenocarcinoma surgery and adjuvant therapy[J]. Surg Clin North Am, 2011, 91(5): 1039-1077.
4 Yokoyama H, Nakanishi H, Kodera Y, et al. Biological significance of isolated tumor cells and micrometastasis in lymph nodes evaluated using a green fluorescent protein-tagged human gastric cancer cell line[J]. Clin Cancer Res, 2006, 12(2): 361-368.
5 Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial[J]. J Clin Oncol, 2011, 29(13): 1715-1721.
6 Xiong BH, Cheng Y, Ma L, et al. An updated meta-analysis of randomized controlled trial assessing the effect of neoadjuvant chemotherapy in advanced gastric cancer[J]. Cancer Invest, 2014,32(6): 272-284.
7 Watanabe H, Okada M, Kaji Y, et al. New response evaluation criteria in solid tumours-revised RECIST guideline (version 1.1)[J].Gan To Kagaku Ryoho, 2009, 36(13): 2495-2501.
8 郗洪庆, 张珂诚, 卫勃, 等. 胃癌TNM分期第八版更新在临床诊断治疗中的意义和思考[J]. 中华胃肠外科杂志, 2017, 20(2):166-170.
9 Wu ZF, Cao QH, Wu XY, et al. Regional Arterial Infusion Chemotherapy improves the Pathological Response rate for advanced gastric cancer with Short-term Neoadjuvant Chemotherapy[J]. Sci Rep, 2015, 5 : 17516.
10 Sun LB, Zhao GJ, Ding DY, et al. Comparison between better and poorly differentiated locally advanced gastric cancer in preoperative chemotherapy : a retrospective, comparative study at a single tertiary care institute[J]. World J Surg Oncol, 2014, 12 : 280.
11 Garland ML, Vather R, Bunkley N, et al. Clinical tumour size and nodal status predict pathologic complete response following neoadjuvant chemoradiotherapy for rectal cancer[J]. Int J Colorectal Dis, 2014, 29(3): 301-307.
12 Wallin U, Rothenberger D, Lowry A, et al. CEA - a predictor for pathologic complete response after neoadjuvant therapy for rectal cancer[J]. Dis Colon Rectum, 2013, 56(7): 859-868.
13 韦华军, 钟亮, 曾湖, 等. 新辅助化疗治疗进展期胃癌的临床疗效及影响因素[J]. 中国肿瘤临床与康复, 2014, (7): 834-836.
14 杨娟, 燕速. 影响进展期胃癌新辅助化疗患者临床疗效的危险因素[J]. 实用癌症杂志, 2017, 32(5): 770-772.
15 Feng D, Leong M, Li T, et al. Surgical outcomes in patients with locally advanced gastric cancer treated with S-1 and oxaliplatin as neoadjuvant chemotherapy[J]. World J Surg Oncol, 2015, 13 :11.
16 李涛, 陈凛. SOX方案新辅助化疗应用于进展期胃癌的有效性和安全性研究[J]. 中华胃肠外科杂志, 2011, 14(2): 104-106.
17 Chao YK, Chang HK, Tseng CK, et al. Development of a nomogram for the prediction of pathological complete response after neoadjuvant chemoradiotherapy in patients with esophageal squamous cell carcinoma[J]. Dis Esophagus, 2017, 30(2): 1-8.
18 Schuhmacher C, Novotny AR, Busch R, et al. Nomogram Based Prediction of Prognosis After Surgery of Gastric Cancer: Impact of Neoadjuvant Chemotherapy[J]. Polish Journal of Surgery, 2006,78(4): 378.

