裂殖壶菌油脂水酶法提取工艺优化及其脂肪酸组成分析
徐 华 张 茹 刘连亮 张进杰 杨文鸽 楼乔明
(宁波大学海洋学院,宁波 315211)
裂殖壶菌(Schizochytriumsp.),又名裂壶藻,其属于真菌门(Eumycota)、网粘菌纲(Labyrinthulomycetes)、破囊壶菌目(Thraustochytriales)、破囊壶菌科(Thraustochytriaceae)的一类类藻的海洋微生物[1]。裂殖壶菌的菌体脂质含量丰富,且以甘油三酯为主,DHA占总脂肪酸含量的30%~40%,被认为是一种理想的DHA新生资源。目前,从裂殖壶菌中提取制备高纯度DHA已日益成为国内外海洋生物技术的研究热点[2-3]。
水酶法是近年来广泛研究的一种油脂提取新技术,是将生物酶制剂应用于油脂分离的方法,通过酶制剂对油料底物的降解作用,提高油脂出油率;该方法具有选择性降解、副产物少、出油率高、油质好等优点[4-5]。因此,本实验采用水酶法对裂殖壶菌油脂的提取工艺进行研究和优化,以期为裂殖壶菌油脂提取及后续工业化应用提供参考。
1 材料与方法
1.1 材料与试剂
裂殖壶菌(Schizochytriumlimacinum)干粉:厦门汇盛生物有限公司,经Folch法测定,其油脂质量分数为44.63%。菠萝蛋白酶(50万U/g)、木瓜蛋白酶(80万U/g)、酸性蛋白酶(80万U/g)、碱性蛋白酶(20万U/g)、中性蛋白酶(20万U/g)、纤维素酶(5万U/g):均为食品级试剂酶,江苏锐阳生物科技有限公司;37种脂肪酸甲酯混合标准品:美国Sigma公司;甲醇、氯仿、正己烷:均为分析纯,天津市科密欧化学试剂公司。
1.2 仪器和设备
6890N型气相色谱仪、5973型质谱仪:美国Agilent公司;Laborota 4000 efficient旋转蒸发器:德国海道尔夫公司;THZ-82型水浴恒温振荡器:常州国华电器有限公司。
1.3 实验方法
1.3.1 水酶法提取的工艺流程
裂殖壶菌干粉→加水→微波预处理→酶解→正己烷萃取→减压浓缩→油脂
提取工艺要点:取2 g裂殖壶菌干粉,按一定液料比加入蒸馏水,并微波5 min(微波频率2 450 MHz,输出功率450 W);待样品冷却至室温,加入一定量的酶制剂,放于水浴恒温振荡器中60 r/min进行酶解。酶解结束后,按裂殖壶菌干粉质量,以2 mL/g的用量加入正己烷,振荡萃取2 min,于5 000 r/min离心5 min,收集上层正己烷相,重复萃取2次,合并正己烷相;经40 ℃减压浓缩后,于105 ℃干燥至恒重,称取油脂质量,并计算裂殖壶菌油脂提取率。油脂提取率的计算公式为:

1.3.2 酶的选取和复合酶配比的确定
取2 g裂殖壶菌干粉,按2 mL/g的液料比加入蒸馏水,微波处理后,按1 000 U/g的添加量分别加入纤维素酶、菠萝蛋白酶、木瓜蛋白酶、酸性蛋白酶、碱性蛋白酶和中性蛋白酶,并以不加酶制剂为对照,于50 ℃恒温水浴酶解3 h,酶解结束后用正己烷萃取油脂,计算裂殖壶菌的油脂提取率;并以纤维素酶和中性蛋白酶组成复合酶,测定两者间的配比对裂殖壶菌油脂提取率的影响。
1.3.3 单因素和正交优化实验
在复合酶配比为2:8(纤维素酶:中性蛋白酶,U:U)的基础上,以液料比、加酶量、酶解温度和酶解时间为因素,以油脂提取率为指标进行单因素实验;并综合单因素实验结果,采用极差法对上述4个因素进行正交优化实验,正交因素水平表见表1。
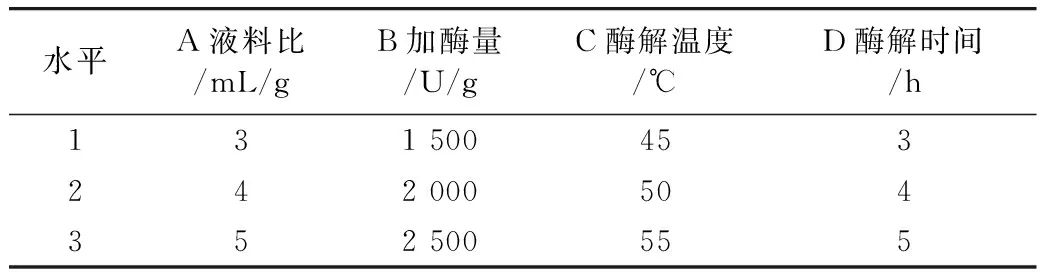
表1 正交设计因素水平表
1.3.4 脂肪酸分析
甲酯化衍生取10 mg所提的裂殖壶菌油脂,加入1 mL的2 mol/L HCl-甲醇溶液,于60 ℃水浴中甲酯化15 min,冷却后加入1 mL正己烷振荡,静置分层后,取上清液用无水硫酸钠干燥,供GC-MS分析。
色谱条件HP-INNOWax石英毛细管柱(30 m×0.32 mm×0.25 μm),高纯氦气为载气,采用恒压模式,压力为54 kPa,分流比为25:1。进样口温度为230 ℃,检测器温度为250 ℃,柱温以3 ℃/min由120 ℃升到210 ℃,并在210 ℃下保持10 min,整个分析过程为40 min。
质谱条件GC-MS接口温度280 ℃,EI离子源,电离能量70 eV,离子源温度230 ℃,扫描周期2.84次/s,质量扫描范围m/z50~500 u。
1.4 数据分析
每次实验平行测定3次,利用SPSS 18.0软件对数据进行统计分析,数据以平均值±标准差表示;采用单因素方差分析法(ANOVE,Tukey检验)进行显著性检验,并通过Duncan’s法进行单因素多重比较分析,P<0.05为差异显著。
2 结果与分析
2.1 酶制剂的选择与配比优化
在液料比2 mL/g条件下,按1 000 U/g的加酶量分别添加纤维素酶(Cel)、菠萝蛋白酶(Bro)、木瓜蛋白酶(Pap)、酸性蛋白酶(Aci)、碱性蛋白酶(Alc)和中性蛋白酶(Neu),并以不加酶制剂为对照(Con),置于50 ℃恒温水浴振荡酶解3 h,不同酶制剂对油脂提取的影响如图1所示。
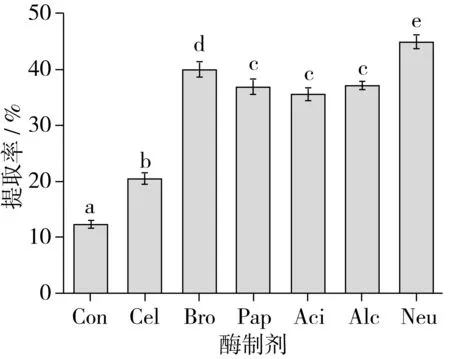
图1 酶制剂对油脂提取率的影响
由图1可知,添加纤维素酶或蛋白酶能显著增加裂殖壶菌的油脂提取率(P<0.05),且不同酶制剂对油脂提取率具有显著差异(P<0.05),其中中性蛋白酶的油脂提取率最高(44.96%),菠萝蛋白酶(40.04%)、碱性蛋白酶(37.13%)、木瓜蛋白酶(36.84%)和酸性蛋白酶(35.61%)的提取率依次降低,而纤维素酶的油脂提取率最低,仅为20.61%。这是因为纤维素酶和不同蛋白酶的酶解底物、作用位点和催化活力不同[6]。裂殖壶菌的细胞壁结构,以及细胞中存在的脂蛋白复合体,对油脂分子具有包埋作用,不利于油脂的提取。单独水提热处理很难破坏细胞壁和脂蛋白复合体对油脂分子的包埋作用,而纤维素酶和蛋白酶能分别有效降解裂殖壶菌的细胞壁结构和脂蛋白复合体,使包埋的油脂释放出来,提高油脂提取率[5]。实验结果表明添加纤维素酶和不同蛋白酶能分别有效降解破坏裂殖壶菌细胞壁结构和脂蛋白复合体,释放油脂,从而显著提高裂殖壶菌的油脂提取率。
酶制剂具有较强的底物专一性,这意味着采用单一酶制剂在酶解提取油脂的工艺应用中具有一定的局限性;根据酶解底物基本性质,选择合适的几种酶制剂复合使用,能兼具多种生物酶的不同活性,并对酶解过程产生协同促进作用,更有利于细胞中油脂的析出和聚集,进而提高油脂提取率[7]。因此根据单一酶制剂的实验结果,并结合裂殖壶菌细胞壁构成和胞内脂蛋白复合物的底物性质,采用纤维素酶和中性蛋白酶进行复合配比实验,复合酶不同配比对油脂提取率的影响如图2所示。

图2 复合酶配比对油脂提取率的影响
由图2可知,在复合酶的总酶活为1 000 U/g的前提下,纤维素酶和中性蛋白酶的不同配比,对裂殖壶菌油脂的提取率产生显著影响(P<0.05)。首先,随着中性蛋白酶含量的增加,裂殖壶菌的油脂提取率显著增加(P<0.05);当纤维素酶和中性蛋白酶的酶活力比值为2:8时,油脂提取率达到最大值(50.16%),远高于单独使用纤维素酶(20.61%)和中性蛋白酶(44.96%)。之后,随着中性蛋白酶含量的继续增加,油脂提取率略有降低。因此选取复合酶配比为2:8(纤维素酶:中性蛋白酶,U:U)进行后续的单因素实验。
2.2 单因素实验
在复合酶配比2:8(纤维素酶:中性蛋白酶,U:U)的条件下,以液料比、加酶量、酶解温度和酶解时间为实验因素,测定上述4种因素的不同水平对裂殖壶菌油脂提取率的影响,实验结果见图3。

图3 不同因素对油脂提取率的影响
在复合酶配比2:8(纤维素酶:中性蛋白酶,U:U)、加酶量1 000 U/g、酶解温度50 ℃和酶解时间3 h条件下,当液料比为2 mL/g时,裂殖壶菌油脂提取率为50.16%,同时随着液料比的增大,裂殖壶菌油脂提取率显著增加(P<0.05);当液料比达到4 mL/g时,油脂提取率达到最大值(62.43%);继续增加液料比,裂殖壶菌油脂提取率显著降低(P<0.05)。这是由于当液料比较低时,物料较为黏稠,不利于酶与底物的充分接触,酶解反应不能有效进行,且较低的液料比不利于油脂分子的游离,致使油脂提取率较低;随着液料比的适当增加,增加酶与底物的有效接触,并降低溶剂中油脂浓度,增加物料与溶剂间的浓度差,降低酶解体系的乳化效应,增加物料中油脂向溶剂扩散的速度和游离速度,从而显著增加油脂提取率[8-9]。当液料比大于4 mL/g,继续增加液料比,使酶解体系中的酶和底物浓度双双降低,影响酶解作用的发挥;且较高的液料比易增加后续工艺的难度和强度。因此裂殖壶菌油脂提取的最佳液料比为4 mL/g。
在复合酶配比2:8(纤维素酶:中性蛋白酶,U:U)、液料比2 mL/g、酶解温度50 ℃和酶解时间3 h条件下,随着加酶量的增加,裂殖壶菌油脂提取率显著增加(P<0.05),当加酶量为2 500 U/g,油脂提取率达到最大值(65.39%);继续增加复合酶用量,油脂提取率不再增加,并有一定的降低趋势,但下降幅度不显著(P>0.05)。这是因为适当增加酶用量,能有效提高酶浓度,增加酶与底物的接触几率,促进酶解反应的进行,进而增加油脂提取率。但当加酶量超过一定范围时,易使酶解体系发生深度水解,水解产物增强蛋白质的乳化性,使油脂分子再度被蛋白质包裹,产生乳化现象,增加油脂分离难度;同时加酶量过多使得酶分子间产生竞争作用,降低酶的作用效率,致使油脂提取率降低[10]。因此裂殖壶菌油脂提取的最佳加酶量为2 500 U/g。
在复合酶配比2:8(纤维素酶:中性蛋白酶,U:U)、液料比2 mL/g、加酶量1 000 U/g和酶解时间3 h条件下,在一定酶解温度范围内,随着酶解温度的上升,裂殖壶菌油脂提取率先增加,并在55 ℃时,油脂提取率达到最大值(50.83%);继续提高酶解温度,油脂提取率显著降低(P<0.05)。适当提高酶解温度有利于提高纤维素酶和中性蛋白酶的酶解活性,纤维素酶的最适温度为50 ℃,中性蛋白酶的最适温度为55 ℃,故在55 ℃温度条件下,由纤维素酶和中性蛋白酶组成的复合酶的酶解活性最强;而继续增加酶解温度则会破坏纤维素酶和中性蛋白酶的活性中心,进而降低裂殖壶菌的油脂提取率,且酶解温度的增加还易造成油脂氧化,降低油脂品质[11]。因此综合考虑油脂提取率和后续油脂品质,裂殖壶菌油脂提取的最佳酶解温度为55 ℃。
在复合酶配比2:8(纤维素酶:中性蛋白酶,U:U)、液料比2 mL/g、加酶量1 000 U/g和酶解温度50 ℃条件下,当酶解时间为1 h时,裂殖壶菌油脂提取率仅为32.54%;随着酶解时间的增加,油脂提取率显著增加(P<0.05);当酶解时间为4 h时,油脂提取率达到最大值(54.23%)。之后,随着酶解时间的增加,油脂提取率趋于平缓,继续增加酶解时间对裂殖壶菌油脂提取率没有显著影响(P>0.05);同时,进一步延长酶解时间,易使酶解体系中乳状液趋于稳定,造成破乳困难,降低油脂提取率[12];且裂殖壶菌富含DHA,酶解时间过长,易使油脂发生氧化,降低油脂品质。因此裂殖壶菌油脂提取的最佳酶解温度为4 h。
2.3 正交优化实验
根据单因素实验,以纤维素酶和中性蛋白酶为复合酶(2:8,U:U),选取液料比、加酶量、酶解温度和酶解时间为实验因素,以油脂提取率为指标,采用正交方法考察各因素对裂殖壶菌油脂提取率的影响,实验设计和结果列于表2,其方差分析结果列于表3。

表2 正交优化设计与结果

表3 正交实验方差分析
注:F0.05(2,2)=19.00;*表示P<0.05,差异显著。
由表2可知,水酶法提取裂殖壶菌油脂的过程中,实验中各因素对油脂提取率的影响依次为:加酶量>液料比>酶解时间>酶解温度,即加酶量对裂殖壶菌油脂提取的影响最大,液料比和酶解时间次之,酶解温度最小;并对上述4个因素进行方差分析可知,加酶量和液料比对裂殖壶菌油脂提取率有显著影响(P<0.05),而酶解时间和酶解温度对油脂提取率的影响不显著(P>0.05),优化后的油脂提取条件为A2B3C3D2,即液料比4 mL/g,加酶量2 500 U/g,酶解温度55 ℃,酶解时间4 h;并在此优化条件下进行验证实验,裂殖壶菌油脂提取率达到82.47%。
2.4 裂殖壶菌脂肪酸组成分析
裂殖壶菌油脂经酸酯化衍生处理,采用GC-MS技术对其脂肪酸组成进行分析,其总离子流色谱图见图4;通过标准品对照和数据库检索等方法对其脂肪酸进行定性,并按峰面积归一法进行定量,分析鉴定结果列于表4。
从表4可知,从裂殖壶菌油脂中共鉴定出18种脂肪酸,以C14:0(4.00%)、C16:0(54.37%)、C22:5n-6(3.94%)和C22:6n-3(DHA,32.65%)为主;其中饱和脂肪酸6种,占总脂肪酸含量的59.68%;不饱和脂肪酸12种,占总脂肪酸含量的40.32%。C22:6n-3是一种重要的n-3型多不饱和脂肪酸,能有效促进婴幼儿神经系统发育,提高智力;调节血脂,预防心脑血管疾病;提高免疫力,增强抗炎、抗癌能力[13-15]。裂殖壶菌油脂富含C22:6n-3,表明其具有很高的营养价值,可作为C22:6n-3的重要生物来源;同时其脂肪酸组成简单,与C22:6n-3结构类似但功能上有拮抗作用的C20:5n-3(EPA)含量极低,仅为0.52%,这便于C22:6n-3的分离纯化和高纯度C22:6n-3的制备;同时这一脂肪酸组成特征也将拓展裂殖壶菌油脂在食品和医药等领域的应用范围,尤其在婴幼儿食品方面。

注:图中序号与表4中序号一致。图4 裂殖壶菌脂肪酸甲酯的总离子流色谱图 表4 裂殖壶菌油脂的脂肪酸组成(n=3)
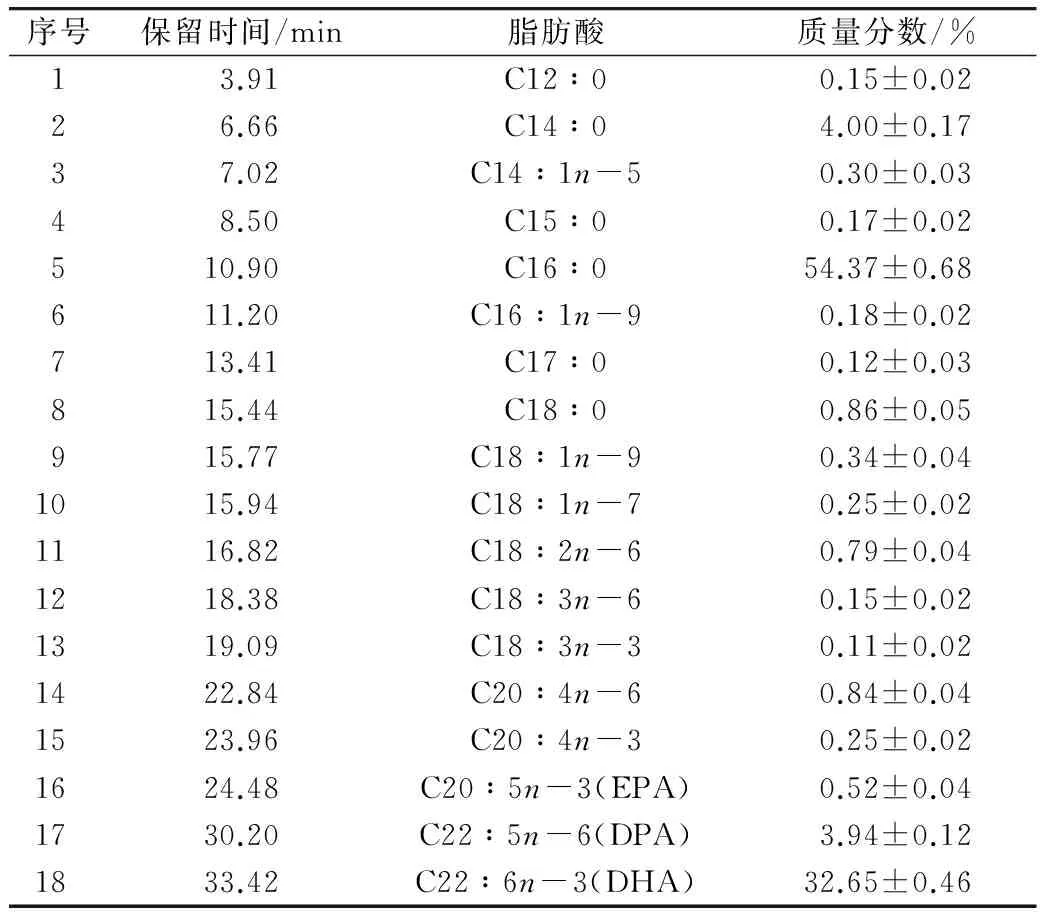
序号保留时间/min脂肪酸质量分数/%13.91C1200.15±0.0226.66C1404.00±0.1737.02C141n-50.30±0.0348.50C1500.17±0.02510.90C16054.37±0.68611.20C161n-90.18±0.02713.41C1700.12±0.03815.44C1800.86±0.05915.77C181n-90.34±0.041015.94C181n-70.25±0.021116.82C182n-60.79±0.041218.38C183n-60.15±0.021319.09C183n-30.11±0.021422.84C204n-60.84±0.041523.96C204n-30.25±0.021624.48C205n-3(EPA)0.52±0.041730.20C225n-6(DPA)3.94±0.121833.42C226n-3(DHA)32.65±0.46
3 结论
3.1 以纤维素酶和中性蛋白酶组成水解复合酶,两者配比为2:8(纤维素酶:中性蛋白酶,U:U),并经单因素和正交优化实验得到水酶法提取裂殖壶菌油脂的最佳工艺条件:液料比4 mL/g,加酶量2 500 U/g,酶解温度55 ℃,酶解时间4 h;在此优化条件下,裂殖壶菌油脂提取率为82.47%。
3.2 裂殖壶菌油脂脂肪酸组成简单,以C14:0、C16:0、C22:5n-6和C22:6n-3为主,其中C22:6n-3质量分数高达32.65%,表明裂殖壶菌油脂具有很高的营养价值和脂质开发潜力,可以作为制备天然高纯度C22:6n-3的重要生物来源。
[1]李清,臧晓南,张学成,等.裂殖壶菌OUC88及10个派生菌株18S rDNA基因克隆和分析[J].海洋科学,2014,38(1):71-78 LI Q,ZANG X N,ZHANG X C,et al.Cloning and analysis of 18S rDNA gene fromSchizochytriumlimacinumOUC88 and 10 derived strains[J].Marine Sciences,2014,38(1):71-78
[2]YAGUCHI T,TANAKA S,YOKOCHI T,et al.Production of high yields of docodahexaenoic acid bySchizochytriumsp.strain SR21[J].Journal of the American Oil Chemists Society,1997,74(11):1431-1434
[3]阮成旭,梁双振,燕妍,等.裂殖壶菌藻粕酶解产物的提取及抑菌作用研究[J].中国食品学报,2015,15(12):128-133 RUAN C X,LIANG S Z,YAN Y,et al.Extraction of schizochytrium meal crude hydrolysates and its antibacterial activity[J].Journal of Chinese Institute of Food Science and Technology,2015,15(12):128-133
[4]王丽波,徐雅琴,杨昱,等.南瓜籽油的水酶法提取工艺及产品的理化性质[J].农业工程学报,2011,27(10):383-387 WANG L B,XU Y Q,YANG Y,et al.Aqueous enzymatic extraction of pumpkin seed oil and its physical-chemical properties[J].Transactions of the Chinese Society of Agricultural Engineering,2011,27(10):383-387
[5]贺赐安,余旭亚,赵鹏,等.微藻油脂提取方法研究进展[J].中国油脂,2012,37(8):16-20 HE C A,YU X Y,ZHAO P,et al.Review on oil extraction methods from microalgae[J].China Oils and Fats,2012,37(8):16-20
[6]ZHANG S B,LU Q Y,YANG H,et al.Aqueous enzymatic extraction of oil and protein hydrolysates from roasted peanut seeds[J].Journal of Oil and Fat Industries,2011,88(5):727-732
[7]周玥,郭华,向娇.复合酶对水酶法提取油茶籽油的影响[J].食品科技,2016,41(2):211-215 ZHOU Y,GUO H,XIANG J.Effects of composite enzyme on extracting oil-camellia seed oil by aqueous enzymatic method[J].Food Science and Technology,2016,41(2):211-215
[8]陈潇逸,王超,张帆,等.微波预处理水酶法提取杨梅核仁油的研究[J].中国粮油学报,2013,28(11):37-40 CHEN X Y,WANG C,ZHANG F,et al.Research on microwave pretreatment followed by aqueous enzymatic extraction of nucleolus oil fromMyricarubra[J].Journal of the Chinese Cereals and Oils Association,2013,28(11):37-40
[9]徐彤砚,张茹,杨欣星,等.水酶法提取北太平洋鱿鱼肝脏油脂及其脂肪酸组成分析[J].食品工业科技,2016,37(9):213-217 XU T Y,ZHANG R,YANG X X,et al.Aqueous enzymatic extraction of liver oil fromOmmastrephesbartramiand its fatty acid composition analysis[J].Science and Technology of Food Industry,2016,37(9):213-217
[10]彭瑶瑶,王千千,王爱梅,等.水酶法提取牡丹籽油的研究[J].中国油脂,2014,39(6):12-17 PENG Y Y,WANG Q Q,WANG A M,et al.Aqueous enzymatic extraction ofPaeoniasuffruticosaseed oil[J].China Oils and Fats,2014,39(6):12-17
[11]王强,王存,王睿,等.微波辅助水酶法提取番茄籽油工艺优化及理化特性研究[J].中国粮油学报,2015,30(10):43-48 WANG Q,WANG C,WANG R,et al.Microwave-assisted aqueous enzymatic extraction of oil from tomato seed and evaluation of its physicochemical properties[J].Journal of the Chinese Cereals and Oils Association,2015,30(10):43-48
[12]祖亭月,何美莹,张连富.水酶法提取橡胶籽油的工艺研究[J].中国粮油学报,2013,28(2):37-42 ZU T Y,HE M Y,ZHANG L F.Study on aqueous enzymatic extraction of oil from rubber seeds[J].Journal of the Chinese Cereals and Oils Association,2013,28(2):37-42
[13]LAURITZEN L,HANSEN H S,JORGENSEN M H,et al.The essentiality of long chain n-3 fatty acids in relation to development and function of the brain and retina[J].Progress in Lipid Research,2001,40(1-2):1-94
[14]NORDOY A,MARCHIOLI R,ARNESEN H,et al.n-3 polyunsaturated fatty acids and cardiovascular diseases[J].Lipids,2001,36(1):127-129
[15]DAS U N,FAMS M D.Long-chain polyunsaturated fatty acids in the growth and development of the brain and memory[J].Nutrition,2003,19:62-65.

