不同分级慢性阻塞性肺疾病患者合并骨质疏松症的相关因素分析
居 旭, 梁永杰, 汪进益
(1. 同济大学附属东方医院呼吸科,上海 200120; 2. 上海市静安区闸北中心医院呼吸内科,上海 200070; 3. 同济大学附属东方医院心胸外科,上海 200120)
骨质疏松症(osteoporosis, OP)是目前公认的慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的主要合并症之一,以骨量下降,骨微结构退化为特征,以致骨脆性增加,骨折发生风险性增高[1]。骨质疏松性骨折是OP最严重的并发症,可直接造成严重的不良后果。椎体压缩性骨折在临床中最为常见,椎体骨折会加重已受损的肺功能。肋骨骨折往往因为疼痛造成咳痰能力的下降,影响呼吸,并增加肺炎的发生率。髋部骨折影响患者活动能力,导致并发症发生,增加住院率和死亡率[2]。此外,骨质疏松性骨折增加了发生深静脉栓塞的风险。现有许多研究报道关于COPD患者发生骨质疏松情况及危险因素分析,但不同分级的COPD患者骨量减少和骨质疏松的发生情况报道不多。慢性阻塞性肺疾病评估测试(CAT)作为慢性阻塞性肺疾病全球倡议(GOLD)指南推荐的COPD患者症状评估方法,可体现患者生活质量。本研究通过分析COPD患者CAT与骨密度相关性及气流受限程度综合评估COPD患者发生骨量较少和骨质疏松的风险。
1 资料与方法
1.1 一般资料
选取上海市静安区闸北中心医院呼吸内科明确诊断为COPD的63例临床稳定期患者为实验组,均为男性,另选年龄相匹配的健康男性63例为对照组。排除以下疾病: 可引起钙和维生素D吸收减少和调节障碍的肾脏和消化道疾病;对骨代谢有影响的内分泌系统疾病,如甲状腺及甲状旁腺疾病,肾上腺以及性腺疾病等;免疫性疾病如类风湿性关节炎等;以及多发性骨髓瘤等恶性疾病。
1.2 方法
详细询问并记录研究者的年龄、吸烟量(以吸烟指数表示,吸烟指数=每日吸烟支数×吸烟年数,单位年支,吸烟指数≤200为轻度吸烟,200~400为中度吸烟,≥400为重度吸烟),测定身高、体质量,计算BMI。所有实验组人群完成CAT评分问卷。采用Prodigy型双能X线骨密度仪器(DXA)测定COPD患者和对照组的骨密度值,临床推荐测量部位为腰部L1~L4、髋部和股骨颈。考虑异位钙化和骨质增生对股骨颈影响最小,且随年龄的增加骨量丢失较规律,股骨颈骨折带来的后果也最为严重[3],故选择左侧股骨颈为测量部位,以T值为标准,诊断标准为WHO推荐的[4]: T≥-1标准差(SD)为骨量正常,-2.5SD 采用SPSS 19.0软件包对所有数据进行分析,计量资料不符合正态分布采用中位数(四分位数间距)表示,不符合正态分布的两组计量资料采用非参数Mann-WhitneyU检验;不符合正态分布的多组计量资料采用非参数检验中的Kruskal-WallisH检验。计数资料以百分率表示,两组比较采用χ2检验,采用Logistic回归分析分析各相关因素。P<0.05为差异有统计学意义。 COPD组患者平均年龄为(70.90±10.63)岁,BMI为(22.32±3.64)kg/m2,吸烟指数均值为(854.4±538.18)年支。在63例COPD患者中,9例否认吸烟史,54例有吸烟史,其中轻度吸烟者3例,中度吸烟者2例,重度吸烟者49例。FEV1%pred均值为38.81±14.59,DLCO%pred均值为39.62±21.27。CAT为(17.56±6.70)分,PaO2为(10.87±3.19)kPa。对照组平均年龄为(70.30±10.28)岁。 正态性检验可知实验组和对照组骨密度数据分布不符合正态分布,因此COPD组与对照组的骨密度比较采用Mann-WhitneyU检验。COPD组和对照组骨密度中位数差异有统计学意义(P=0.001),COPD组骨密度值较对照组显著降低,见表1。 表1 COPD组和对照组骨密度比较Tab.1 Comparison of bone mineral density in COPD group and control group 采用Kruskal-WallisH检验法分析不同COPD分级患者与对照组骨密度中位数差异,结果显示: COPD 2级、3级、4级与对照组间骨密度中位数差异有统计学意义(P=0.000);采用Mann-WhitneyU检验分别对COPD 2级、3级、4级与对照组骨密 度中位数进行比较,结果显示: 3级和对照组、4级与对照组骨密度中位数差异均有统计学意义(P=0.017、P=0.000),2级与对照组骨密度中位数差异无统计学意义(P=1.000),见表2。 表2 COPD组不同分级与对照组骨密度情况比较Tab.2 Comparison of bone mineral density between different grades of COPD patients and control group COPD2级患者与对照组骨量减少及骨质疏松的发生率无明显差异(P>0.05),COPD 3级、4级的患者骨量减少及骨质疏松的发生率均高于对照组,差异有统计学意义(P<0.05)。 采用Logistic回归分析法,分析年龄、吸烟量、PaO2、FEV1%pred、DLCO%、BMI、CAT是否为COPD患者合并骨量减少和骨质疏松症的危险因素。结果显示: BMI和FEV1%pred是COPD患者发生骨质疏松的保护因素,CAT是其危险因素。BMI越低,骨质疏松的发生率越高(OR值0.656,P=0.001);FEV1%pred越低,骨质疏松的发生率越高(OR值0.885,P=0.001);CAT评分越高,骨质疏松的发生率越高(OR值1.209,P=0.001)。年龄、吸烟量、PaO2、DLCO%pred与COPD患者发生骨量减少和骨质疏松无相关性(P>0.05)。 表3 COPD组和对照组人群骨量减少和骨质疏松的发生率情况Tab.3 The incidence of osteopenia and osteoporosis in COPD and control groups [n(%)] 本研究的主要发现如下: (1) COPD患者依据GOLD指南进行分级,3级患者较健康人骨量减少、骨质疏松的发生率增高,4级患者较健康人骨量明显减少、骨质疏松发生率显著增高;(2) COPD患者的骨密度是与肺功能阻塞严重程度、CAT评分及BMI密切相关。 COPD组和对照组在骨密度中位数的差异有统计学意义(P<0.01),说明COPD患者较健康人骨密度显著降低。不同分级的COPD患者骨密度较健康人比较,中位值差异有统计学意义(P<0.01),其中2级COPD患者较健康人骨密度无明显差异,3级、4级的COPD患者骨密度较健康人降低。3级COPD患者总体骨量下降的发生率(骨量减少41.9%+骨质疏松25.8%)为67.7%,明显高于2级患者的25%;4级患者的总体骨量下降的发生率(骨量减少70%+骨质疏松25%)为95%,明显高于3级患者。2级COPD患者与对照组骨量减少、骨质疏松发生率差异均无统计学意义(P均>0.05);3级COPD患者与对照组骨量减少、骨质疏松发生率差异均存在统计学意义(P<0.05,P<0.01);4级COPD患者与对照组骨量减少、骨质疏松发生率差异均存在显著统计学意义(P均<0.01)。这就表明3级、4级COPD患者是发生骨量减少和骨质疏松的高危人群。应给予充分重视,积极干预治疗。 Logistic回归分析结果显示: 低FEV1%pred是COPD患者发生骨质疏松的危险因素(OR值0.885,P<0.01),这表明COPD患者的骨密度与气流受限程度有关。气流受限越严重,COPD患者骨密度值越低,骨量减少和骨质疏松的发生率越高。分析其原因可能是因为COPD患者运动后呼吸困难加重,导致日常活动减少,此外,食欲减退和营养不良导致钙和维生素D缺乏,造成肌肉萎缩和身体功能障碍。另一方面,炎性反应在COPD患者发生OP中起主要作用,炎性因子通过激活核因子-κB配体受体激活剂(RANKL)导致其介导的骨吸收增加,使骨密度下降[6-7]。 最新的GOLD指南指出,COPD的严重程度评估不仅仅是气流受限的程度,还包括症状,特别是在现在治疗计划中强调的患者生活质量。CAT评估问卷和呼吸困难指数评分(mMRC)是GOLD指南中推荐的作为COPD症状评估的方法。CAT评分问卷主要考量的是COPD患者咳嗽、咳痰、胸闷、呼吸困难、日常生活是否受影响、外出自信、睡眠和精力这8个方面,共计40分。mMRC主要是对呼吸困难的评价。因此,CAT评估问卷较mMRC评分更为全面,更能反映患者生活质量情况,且简单易行。根据Logistic回归分析结果,高CAT评分与男性COPD患者发生骨密度降低存在相关性。有研究[8]表明,在CAT评估问卷中,胸闷、呼吸困难以及外出自信程度与低骨密度相关[8]。CAT反映患者症状及生活质量,分值越高,症状越重,生活质量越差,日常活动受限,外出减少,日光浴时间减少,维生素D的摄入减少,造成骨密度下降。此外,由于活动减少,肌肉无力,造成患者身体摇晃和跌倒,也增加了骨折的风险[9]。 低BMI被认为是低骨密度和未来发生脆性骨折风险的一个关键危险因素,而高BMI对骨质疏松有保护作用[10]。在本研究中,根据Logistic结果显示: BMI是COPD患者发生骨质疏松的保护因素,低BMI的COPD患者更易发生骨质疏松。分析可能的原因: COPD患者BMI通常较健康人群降低,主要是由于COPD患者细胞因子(如TNF-α)水平的增加导致的全身炎症反应和氧化应激增加,造成COPD患者消耗增加,表现为恶液质,并影响骨生成和刺激骨吸收造成骨代谢异常[11]。 有报道认为: 在缺氧的条件下,可以改变骨微环境,可能会进一步损害成骨细胞的分化和增强破骨细胞的形成,从而抑制骨形成,促进骨吸收和加速骨丢失[12]。而在本研究中,DLCO%pred、PaO2与男性COPD患者发生骨质疏松无相关性,因此,低氧血症是否为COPD患者发生骨质疏松的危险因素有待进一步研究证实。吸烟是COPD的重要发病因素,吸烟导致骨质疏松的潜在机制可能是: 包括向钙激素代谢和肠道钙吸收的改变,性激素的产生和代谢失调,肾上腺皮质激素对核因子-κB受体活化因子(RANK)/RANKL/骨保护素(osteoprotegerin, OPG)系统的代谢改变,和吸烟对骨细胞的直接影响[13]。本研究发现男性COPD患者中,吸烟指数与骨密度间无相关性。有报导[14]指出: 与既往吸烟者相比,目前吸烟者骨密度在3年内表现出更快速地下降。产生此结果的原因可能是: 本研究中吸烟指数考量的是吸烟累积量,而目前是否吸烟的情况未能体现。 本次研究的不足之处在于: (1) 样本量较少,COPD1级患者缺失;(2) 未能对COPD急性加重的情况进行随访记录,且对于COPD并发症情况未能进行统计分析,因此,未能依据GOLD指南对COPD患者进行分组讨论;(3) 因临床工作中忽视对COPD患者胸腰椎常规摄片,本次研究对COPD合并骨质疏松性骨折的情况未做分析。 综上所述,骨质疏松症是慢阻肺患者的一种常见合并症,COPD患者较健康人骨密度下降。3级、4级COPD患者是发生骨量减少和骨质疏松的高危人群。低BMI、低FEV1%、高CAT评分可能是COPD患者发生骨密度下降的危险因素。因此,综合慢阻肺患者肺功能损害程度及CAT评分,结合可能存在的危险因素,可评估骨质疏松发生的风险,对于骨量正常或已发生骨量下降的患者,应督促指导患者戒烟,家庭氧疗,增加适当户外运动,加强营养,减少或避免使用可引起骨量减少的药物,如激素等。已发生骨质疏松症或合并骨质疏松性骨折的患者,建议以钙剂+维生素D为基础,加用双磷酸盐,严重骨痛的患者则加用降钙素[4],病情严重者建议骨科进一步诊治。此外,建议动态监测6~12个月骨密度情况,有助于观察骨质疏松进展,并有助于评价疗效。 [1] 徐铮,汤光宇.骨髓脂肪在骨质疏松骨质量研究中的进展[J].同济大学学报(医学版),2012,33(3): 121-124. [2] REGAN E A, RADCLIFF T A, HENDERSON W G, et al. Improving hip fractures outcomes for COPD patients.[J]. COPD, 2013,10(1): 11-19. [3] 文天林,孙天胜,王玲.骨质疏松症的流行病学、病因和分类[J].人民军医,2010(9): 662-663. [4] 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊疗指南(2017)[J].中华骨质疏松和骨矿盐疾病杂志,2017,10(5): 413-443. [5] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J/OL].中国医学前沿杂志(电子版),2014,6(02): 67-80. [6] ZHANG P F, PAN L, LUO Z Y, et al. Interrelationship of Circulating Matrix Metalloproteinase-9, TNF-α, and OPG/RANK/RANKL Systems in COPD Patients with Osteoporosis[J]. COPD, 2013,10(6): 650-656. [7] BAI P, SUN Y, JIN J, et al. Disturbance of the OPG/RANK/RANKL pathway and systemic inflammation in COPD patients with emphysema and osteoporosis[J]. Respir Res,12(1): 157. [8] SAKURAI-IESATO Y, KAWATA N, TADA Y, et al. The Relationship of Bone Mineral Density in Men with Chronic Obstructive Pulmonary Disease Classified According to the Global Initiative for Chronic Obstructive Lung Disease(GOLD) Combined Chronic Obstructive Pulmonary Disease (COPD) Assessment System[J]. Intern Med. 2017,56(14): 1781-1790. [9] 盛艳玲,刘燕,田涛,等.C反应蛋白及CAT问卷在COPD合并肺动脉高压患者不同时期中的临床意义[J].兰州大学学报(医学版),2017,43(1): 51-55. [10] ONG T, SAHOTA O, TAN W, et al. A United Kingdom perspective on the relationship between body mass index (BMI) and bone health: a cross sectional analysis of data from the Nottingham Fracture Liaison Service[J]. Bone, 2014,59(1): 207-210. [11] REMELS A H, GOSKER H R, LANGEN R C, et al. The mechanisms of cachexia underlying muscle dysfunction in COPD[J]. J Appl Physiol (1985), 2013,114(9): 1253-1262. [12] LING L, YE Q, XIN J, et al. Protective effect of salidroside against bone loss via hypoxia-inducible factor-1α pathway-induced angiogenesis[J]. Sci Rep, 2016,6: 32131. [13] YOON V, MAALOUF N M, SAKHAEE K. The effects of smoking on bone metabolism[J]. Osteoporos Int, 2012,23(8): 2081-2092. [14] POMPE E, BARTSTRA J, VERHAAR H J, et al. Bone density loss on computed tomography at 3-year follow-up in current compared to former male smokers[J]. Eur J Radiol, 2017,89: 177-181.1.3 统计学处理
2 结 果
2.1 一般情况
2.2 COPD组与对照组骨密度情况比较分析
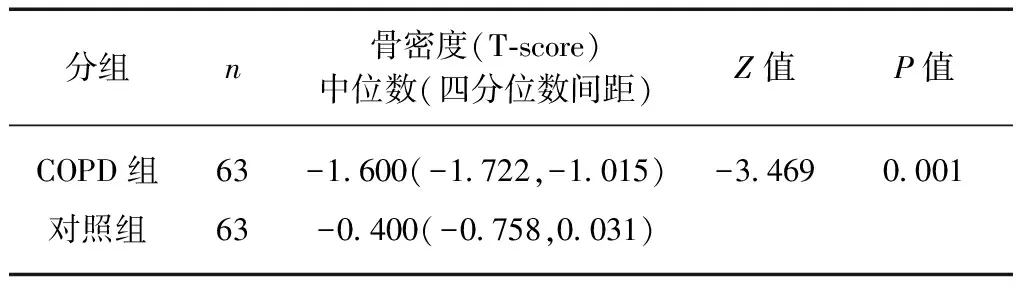
2.3 不同GOLD分级与对照组骨密度比较分析
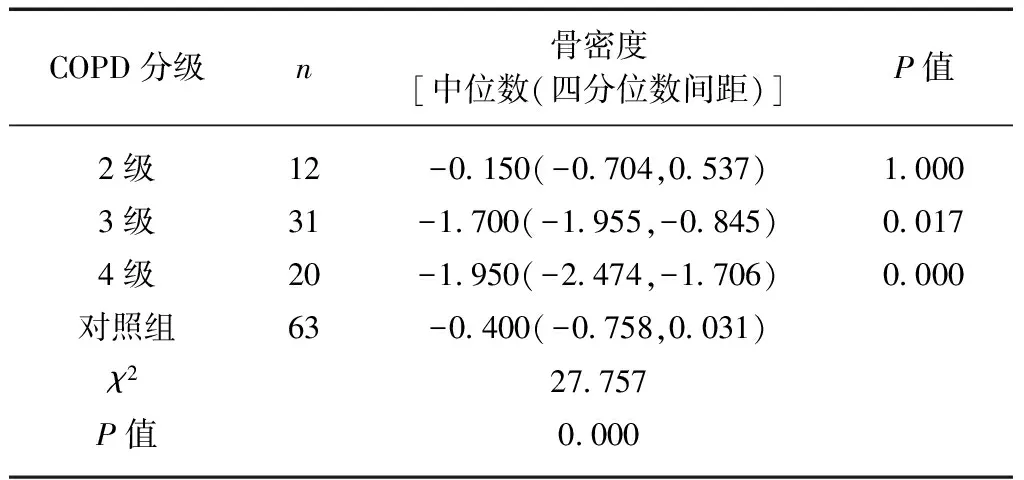
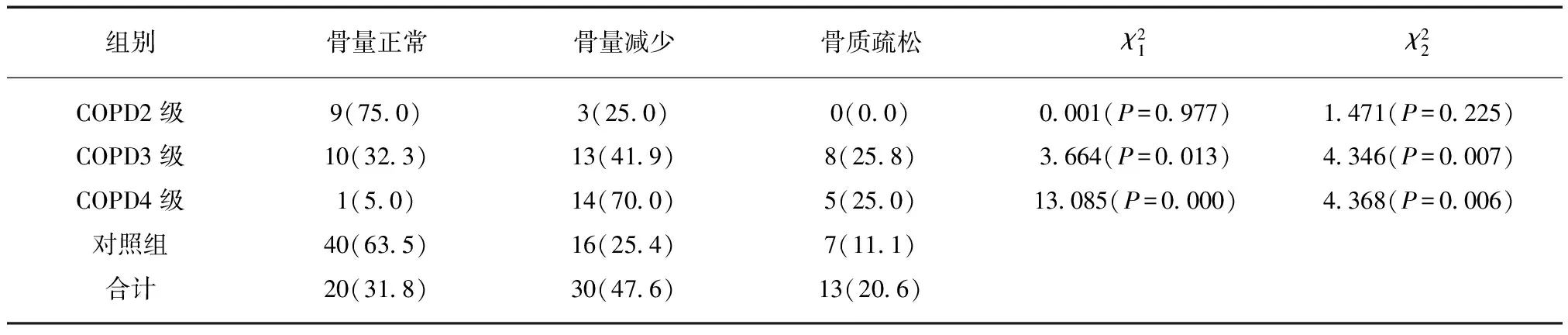
2.4 COPD组和对照组骨量减少和OP发生率
2.5 Logistic回归分析法结果
3 讨 论

