乙型肝炎病毒剪接蛋白 HBSP与泛转录表达因子剪接变异体1相互作用增强NF-κB活性
,, ,,龙飞,,
乙型肝炎病毒(hepatitis B virus,HBV)感染可导致急、慢性肝炎,肝硬化并最终可能发展成肝细胞癌(hepatocellular carcinoma, HCC)[1]。HBV前基因组RNA(pregenomic RNA,pgRNA)可在特定位点发生RNA剪接并逆转录产生剪接变异体,影响HBV的致病性[2]。单剪接型2.2 Kb HBV剪接变异体编码产生的剪接蛋白(Hepatitis B spliced protein, HBSP)具有重要的生物学功能[3-5]。本实验以HBSP作为诱饵蛋白,利用酵母双杂交实验筛选能够与HBSP相互作用的肝细胞蛋白,发现泛转录表达因子剪接变异体1(Ubiquitously expressed transcript splice variant 1,UXT-V1)是其靶蛋白。泛转录表达因子是NF-κB转录复合体的一个重要组成部分,可激活NF-κB通路,与肿瘤发生发展有关[6]。研究确证了HBSP-UXT-V1的相互作用及其对肝细胞NF-κB通路的影响,借此深入了解HBV的致病机制。
1 材料与方法
1.1 材料
1.1.1质粒与细胞 酵母表达重组质粒pGBKT7-HBSP(酵母双杂交诱饵质粒)、真核表达重组质粒phouge-Flag、phouge-HBSP-Flag(用于构建稳定表达HBSP的慢病毒细胞株)、pDsRed-monomer-N1-HBSP、pAcGFP-N1-UXT-V1、pAcGFP-N1-UXT-V2(用于激光共聚焦实验)、pBIND-HBSP 、pACT-UXT-V1(用于哺乳动物细胞双杂交实验)、pCMVTNT-UXT-V1 (用于体外转录翻译目的蛋白)、原核表达重组质粒pGEX-4T-1-HBSP(用于原核表达目的蛋白)由本实验室构建和保存; 相应空载体、对照载体或报告基因载体pDsRed-monomer-N1、pAcGFP-N1、pBIND 、pACT 、pBIND-Id、pACT-MyoD、pG5luc、pNF-κB-luc,pRL-tk由本实验室保存。Huh7肝癌细胞株购自上海细胞库;表达HBSP的Huh7/phouge-HBSP-Flag慢病毒细胞株及其对照细胞株Huh7/phouge-Flag由本实验室构建和保存。
1.1.2主要试剂 酵母双杂交相关试剂购自Clontech公司; DMEM高糖细胞培养液、胰酶购自Gibco公司,胎牛血清购自PAN公司;转染试剂Lipofectamine 3000购自Life公司; Red anti-FLAG M2 affinity gel 和Hoechst 33342购自 Sigma公司;Protein A & G、 Normal Mouse IgG、anti-UXT(J-19)抗体、AP偶联二抗Anti-Rabbit antibody购自SantaCruz公司;TNF-α、anti-FLAG标签抗体购自Cell Signaling Technology公司。TNT兔网织红细胞转录/翻译偶联系统、双荧光素酶报告基因检测试剂盒(Dual luciferase assay kit)购自Promega公司。
1.2 方法
1.2.1顺序转化法酵母双杂交筛选 酵母双杂交诱饵质粒pGBKT7-HBSP以PEG/LiAc法转化酵母菌株AH109,获得转化菌AH109[pGBKT7-HBSP],将肝细胞cDNA文库再转化入AH109[pGBKT7-HBSP],最终将转化菌涂布于QDO/X-α-gal/3-AT筛选平板上,选取21d内显现为蓝色的单克隆,从中分离氨苄抗性的猎物质粒,将猎物质粒转化AH109,而pGBKT7-HBSP或pGBKT7转化Y187菌株,将AH109转化菌与Y187转化菌混合,250 r/min,30 ℃,培养20~24 h,使分别携带猎物质粒和诱饵质粒的AH109与Y187发生接合(mating),以AH109[pGADT7-T]×Y187[pGBKT7-p53]做阳性对照,将接合菌涂布于QDO/X-α-gal/3-AT筛选平板。从平板上挑取阳性菌落,在滤纸上划线,液氮裂解,以X-gal为底物、固相法检测报告基因β-半乳糖苷酶的表达。以上实验方法均参照Clontech公司试剂盒说明书。
1.2.2细胞培养与转染 Huh7肝癌细胞株以 DMEM培养液 (含10 %胎牛血清)培养于37 ℃ CO2培养箱。转染前1 d,以胰酶消化细胞,按每皿种5×105个细胞接种于35 mm培养皿。18 h后以Lipofectamine 3 000转染试剂转染细胞,转染方案参照试剂说明书。
1.2.3内源性免疫共沉淀 以phouge-HBSP-Flag、phouge-Flag质粒分别转染Huh7细胞株,48 h后以RIPA裂解液裂解细胞,加入Red anti-FLAG M2 affinity gel(偶联有anti-Flag抗体的琼脂糖凝珠)沉淀FLAG标签蛋白及与之相互作用的蛋白,从凝珠上洗脱互作的蛋白后,用anti-UXT抗体进行Westernblot检测。
1.2.4激光共聚焦 将融合表达红色荧光蛋白的质粒(pDsRed-monomer-N1-HBSP)和融合表达绿色荧光蛋白的质粒(pAcGFP-N1-UXT-V1或pAcGFP-N1-UXT-V2)共转染Huh7细胞,48 h后,吸弃培养液,用PBS洗涤3遍。加入1 mL含0.6 μg/mL Hoechst 33342 的PBS,37 ℃孵育5 min。弃上清,用 PBS洗涤3遍,在Zeiss LSM510 META激光共聚焦显微镜下观察细胞内荧光分布情况。
1.2.5哺乳动物细胞双杂交 将pBIND-HBSP分别与pACT-UXT-V1重组质粒和报告载体pG5luc共转染;以pBIND-Id、pACT-myoD和pG5luc共转染组为阳性对照,pBIND空载体、pACT空载体和pG5luc共转染组为阴性对照,pBIND-HBSP和pACT空载体、pG5luc共转染组为实验对照。转染后48 h,使用双荧光素酶报告基因检测试剂盒检测萤火虫荧光素酶活性值及内参海肾荧光素酶活性值。转染及检测实验重复3遍。
1.2.6GST-Pulldown 以pCMVTNT-UXT-V1载体为模板,利用TNT兔网织红细胞转录/翻译偶联系统,体外转录翻译[35S]标记的目的蛋白。pGEX-4T-1-HBSP和pGEX-4T-1空载体分别转化Rosetta (DE3) 大肠杆菌感受态细菌,0.5 mmol/L IPTG诱导目的蛋白的表达、超声破碎裂解细菌后取裂解液上清用Glutathione Sepharose 4B Slurry纯化,并使GST融合蛋白固定于Glutathione Sepharose 4B Slurry柱子,加入体外转录翻译的蛋白,洗涤柱子后,以洗脱液洗脱柱子上与GST融合蛋白结合的目标蛋白,进行SDS-PAGE电泳分离目标蛋白,磷屏盒中曝光过夜,并在磷屏扫描仪上成像。
1.2.7RNA干扰合成siRNA 用于沉默UXT-V1,其序列为: 5′-GGC UGA ACC UCC AGC UUG ATT-3′[7],该siRNA仅沉默UXT-V1,对UXT-V2表达无影响。UXT-V1 siRNA和阴性对照NC-siRNA(Negative control siRNA,与已知人类基因均无同源性)均由上海吉玛制药技术有限公司合成。siRNA转染步骤同质粒DNA转染。
1.2.8TNF-α处理与NF-κB报告基因活性检测 pNF-κB-luc、pRL-tk共转染Huh7/phouge-HBSP-Flag或其对照细胞株Huh7/phouge-Flag,RNA干扰实验中另外加入UXT-V1 siRNA或NC-siRNA转染,转染 24 h后,以灭菌PBS轻柔洗涤细胞2遍,加入含有50 ng/mL TNF-α的无血清DMEM,继续培养。TNF-α处理9 h后,用PBS洗涤细胞3次,以双荧光素酶报告基因检测试剂盒裂解细胞并检测NF-κB反应性启动子驱动的萤火虫荧光素酶活性值及内参海肾荧光素酶活性值。转染及检测实验重复3次。
1.2.9相对萤火虫荧光素酶活性(RLU)计算 以海肾荧光素酶(内参基因)的表达量平衡转染效率,获得萤火虫荧光素酶校正值;将各组萤火虫荧光素酶校正值分别与阴性对照组的萤火虫荧光素酶校正值相除,得到相对萤火虫荧光素酶活性(Relative luciferase units,RLU)值。

2 结 果
2.1HBSP蛋白与UXT-V1在酵母内具有相互作用 本实验选用MATCHMAKER GAL4 Two-Hybrid System 3酵母双杂交系统,基于酵母细胞核中GAL4反应元件对4种报告基因ADE、HIS、MEL、LacZ的调控。本研究利用顺序转化的方法,依次将诱饵质粒pGBKT7-HBSP与肝细胞cDNA文库转化AH109酵母菌株,当诱饵蛋白HBSP与文库质粒编码的猎物蛋白相互作用,就能启动上述报告基因的转录,使转化菌能够在QDO/X-α-gal/3-AT平板上生长并显现蓝色。利用抗生素抗性不同,提取并分离猎物质粒,测序获知插入的猎物基因序列。本研究得到猎物基因-泛转录表达因子剪接变异体1(UXT-V1),进一步将猎物质粒转化酵母AH109菌株,转化子AH109[pACT2-UXT-V1]与Y187[pGBKT7-HBSP]或Y187[pGBKT7]分别进行接合实验,产物涂布于QDO/X-α-gal/3-AT平板上,进而用X-gal做底物检测报告基因LacZ的产物β-半乳糖苷酶的表达,发现AH109[pACT2-UXT-V1]×Y187[pGBKT7-HBSP]组与阳性对照组AH109[pGADT7-T]×Y187[pGBKT7-p53]在8 h内显现蓝色,而AH109[pACT2-UXT-V1]×Y187[pGBKT7]组不显色(图1),证明HBSP与UXT-V1在酵母内具有相互作用。

1: AH109[pACT2-UXT-V1]×Y187[pGBKT7] 2: AH109[pGADT7-T]×Y187[pGBKT7-p53] 3: AH109[pACT2-UXT-V1]×Y187[pGBKT7-HBSP]图1 HBSP蛋白与UXT-V1在酵母内具有相互作用Fig.1 HBSP could interact with UXT-V1 in yeast AH109
2.2免疫共沉淀验证HBSP与UXT-V1相互作用 对于酵母双杂交获得的实验结果,需要对它们分别在细胞内外进行蛋白相互作用的验证。人类的UXT基因主要以2种剪接变异体形式存在,分别是剪接变异体1(UXT-V1)和剪接变异体2(UXT-V2)[6]。尽管酵母双杂交实验未获得UXT-V2,但尚不明确在哺乳动物细胞内HBSP与UXT的2种剪接变异体是否均有相互作用。转染phouge-HBSP-Flag质粒使Huh7细胞过表达HBSP蛋白,利用偶联有anti-Flag抗体的琼脂糖凝珠免疫共沉淀、UXT单克隆抗体(针对UXT-V1与UXT-V2的共同结构域)检测,Westernblot结果表明(图2),与HBSP融合表达的FLAG标签抗体可以沉淀Huh7细胞株内源性UXT-V1蛋白,而在同泳道无法检测到UXT-V2蛋白条带(第4泳道),说明HBSP蛋白与内源性UXT-V1之间存在相互作用,而HBSP与UXT-V2应没有相互作用。
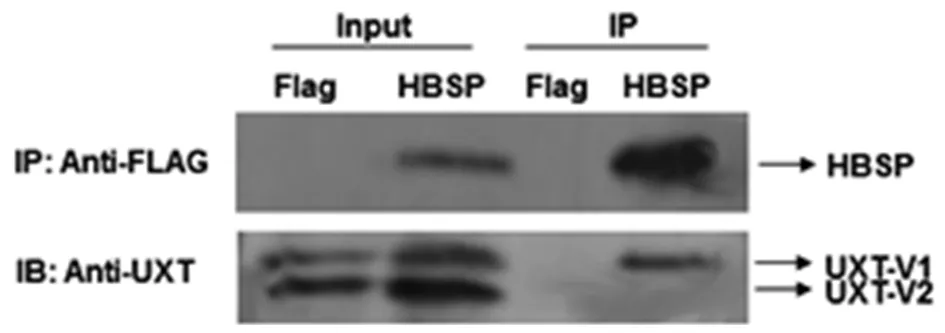
图2 内源性免疫共沉淀验证HBSP与UXT-V1相互作用Fig.2 Co-IP assay showing the interaction between HBSP and endogenous UXT-V1 in Huh7 hepatocytes
2.3激光共聚焦证实HBSP和UXT-V1在Huh7细胞内共定位 为在肝癌细胞株内进一步明确HBSP与UXT-V1和UXT-V2之间的相互作用,以融合表达红色荧光蛋白的pDsRed-N1-HBSP分别和融合表达绿色荧光蛋白的pAcGFP-N1-UXT-1及pAcGFP-N1-UXT-2共转染Huh7细胞,用Hoechst 33342对细胞核染色,激光共聚焦显微镜观察并拍照。结果表明(图3), HBSP(红色)主要分布于细胞浆中, UXT-V1(绿色)大部分定位在细胞浆中,而UXT-V2(绿色)主要分布在细胞核内;且共定位图显示HBSP与UXT-V1(黄色),而非与UXT-V2在细胞中共定位。
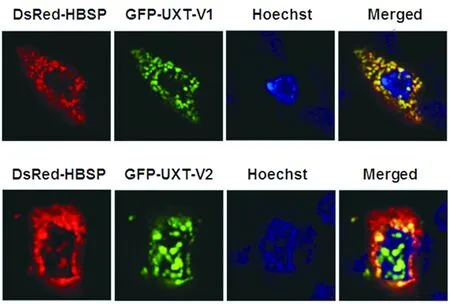
图3 激光共聚焦证实HBSP和UXT-V1在Huh7细胞内共定位Fig.3 Co-localization of HBSP with UXT-V1 in Huh7 hepatocytes
2.4哺乳动物细胞双杂交证实HBSP蛋白和UXT-V1在肝细胞中具有相互作用 以pACT-UXT-V1、pBIND-HBSP以及报告基因pG5luc共转染Huh7细胞株,利用双荧光素酶报告基因检测试剂盒检测报告基因,结果显示(见图4),pBIND-HBSP和pACT-UXT-V1共转染组,其相对萤火虫荧光素酶活性较对照组增高5.94倍(n=3,P<0.05),再一次证明HBSP蛋白与UXT-V1在Huh7细胞中存在相互作用。
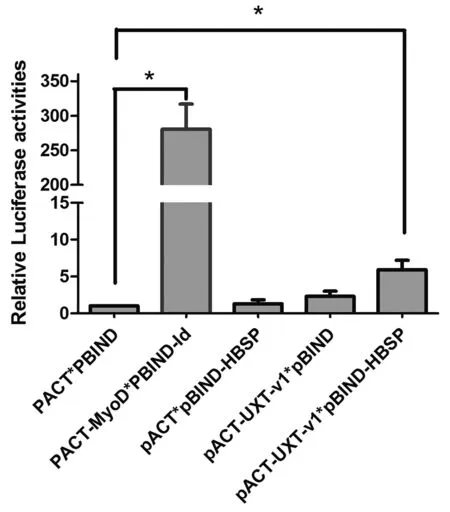
*P<0.05图4 哺乳动物细胞双杂交检测细胞内相对萤火虫荧光素酶活性Fig.4 Relative luciferase activities in Huh7 cells by mammalian two-hybrid assay
2.5GST-Pulldown 证实HBSP和UXT-V1在体外具有直接相互作用 GST-Pull down实验通过在试管内表达2种蛋白产物,排除细胞实验中各种内源性蛋白的影响,从而确定2种蛋白之间是否可以发生直接相互作用。将pGEX-4T-1-HBSP重组质粒和pGEX-4T-1分别转化大肠杆菌,表达和纯化GST-HBSP融合蛋白和GST蛋白(图5A)。利用兔网织红细胞转录/翻译系统获得35S标记的UXT-V1蛋白,将其与结合在谷胱甘肽柱子的GST-HBSP融合蛋白进行Pull-down反应,SDS-PAGE电泳分离蛋白产物、凝胶曝光于磷屏,扫描成像,证实了HBSP蛋白可以和UXT-V1在体外发生相互作用(图5B)。
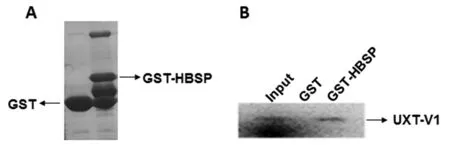
A: 原核表达纯化HBSP蛋白 B:GST-Pulldown实验A: Prokaryotic expression and purification of HBSP protein B: GST-Pulldown assay图5 HBSP与UXT-V1在体外具有直接相互作用Fig.5 In vitro interaction of HBSP and UXT-V1 by GST-Pulldown
2.6HBSP增强NF-κB活性 Huh7/phouge-HBSP-Flag及其对照细胞株Huh7/phouge-Flag是本实验室前期构建的稳定表达HBSP的慢病毒细胞株(图6A),pNF-κB-luc及pRL-tk 共转染Huh7/phouge-HBSP-Flag或其对照细胞株Huh7/phouge-Flag,以TNF-α处理细胞,检测胞内萤火虫荧光素酶活性。结果显示(图6B),转染报告载体的Huh7/phouge-HBSP-Flag细胞株经TNF-α处理后,相对萤光值显著高于Huh7/phouge-Flag组(RLU值 5.23倍 vs 3.82倍,n=3,P<0.05),提示HBSP能够增强NF-κB活性。
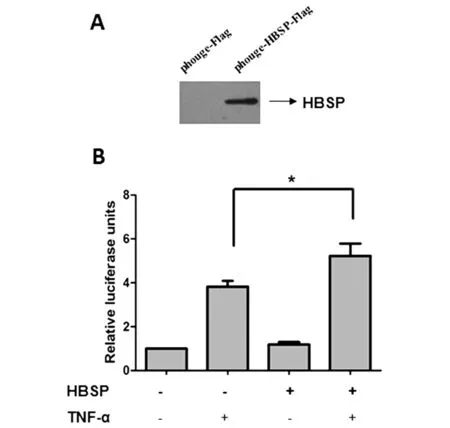
A:慢病毒细胞株Huh7/phouge-HBSP-Flag表达HBSP;B:相对萤火虫荧光素酶活性A: Expression of HBSP in Huh7/phouge-HBSP-Flag cells;B: Relative luciferase units*P<0.05图6 TNFα处理时HBSP增强NF-κB活性Fig.6 HBSP enhanced the activities of NF-κB when treated with TNF-α
2.7HBSP与UXT-V1相互作用激活NF-κB 为探讨HBSP对NF-κB的激活作用是否与UXT-V1有关 ,利用UXT-V1特异的siRNA下调Huh7细胞株中UXT-V1 的表达,而UXT-V2表达不受影响(见图7A)。同上作TNFα处理,检测细胞内萤火虫荧光素酶活性,结果显示:转染无关对照NC-siRNA、并经过TNF-α处理的Huh7/phouge-HBSP-Flag相对萤光值比Huh7/phouge-Flag组高(见图7B,4组与2组相比,RLU值 5.16倍 vs 3.87倍,n=3,P<0.05),此结果与图6B一致; UXT-V1 siRNA沉默UXT-V1表达后,同样是TNF-α处理,Huh7/phouge-HBSP-Flag组的相对萤光值略高于Huh7/phouge-Flag组(见图7B,8组与6组相比,RLU值4.31倍 vs 3.66倍,n=3,P<0.05,且涨幅比Nc-siRNA转染组的4组与2组相比要小)。最后,8组即Huh7/phouge-HBSP-Flag UXT-V1沉默且TNF-α处理组,与4组即Huh7/phouge-HBSP-Flag UXT-V1未沉默且TNF-α处理组比较,前者的相对萤光值低于后者(RLU值4.31倍 vs 5.16倍,n=3,P<0.05)。以上的数据说明,下调UXT-V1的表达可部分减弱HBSP对NF-κB的激活作用,由此证明HBSP对NF-κB的激活作用与UXT-V1和HBSP的相互作用有关。
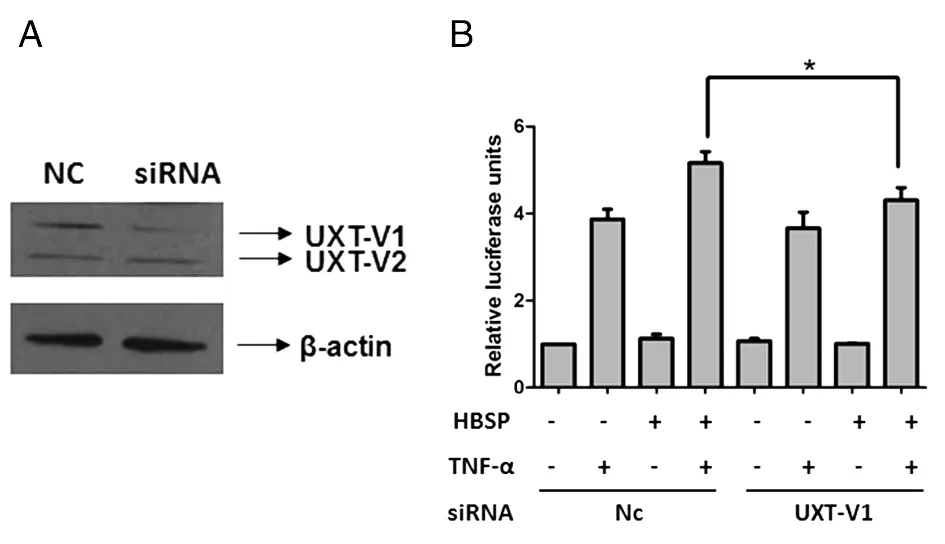
*P<0.05A: Knockdown of UXT-V1 by siRNA; B: Relative luciferase units 图7 UXT-V1沉默时HBSP对NF-κB通路的影响Fig.7 HBSP regulated NF-κB pathway while UXT-V1 knockdown
3 讨 论
HBV编码一种剪接特异性蛋白HBSP (Hepatitis B spliced protein)具有重要致病性:Soussan等[8-9]证实HBSP可诱导肝细胞凋亡,与肝炎、肝硬化有关;Mancini-Bourgine等[3]的研究发现HBSP可诱导特异性CTL活性,导致肝脏损伤;Duriez等[10]的研究则从另一个角度揭示HBSP在肝脏免疫损伤过程的作用,肝脏损伤导致HBSP表达上调,HBSP表达可反过来降低炎症因子表达。
本实验室前期系列研究发现,HBSP蛋白与组织蛋白酶B相互作用、激活PI3K/Akt通路及MAPK通路,增强肝癌细胞株的侵袭能力[4];HBSP能与纤维蛋白原γ链相互作用、干扰机体凝血,与出血倾向有关[5];HBSP通过促进肝微粒体环氧化物水解酶活性、促进苯并芘代谢增加,和苯并芘协同促进肝癌细胞生长[11];HBSP与转化生长因子1诱导蛋白1相互作用,促进TGFβ1诱导的肝癌细胞上皮间质转化并增强其侵袭迁移能力[12]。为了深入了解HBSP致病性,本实验室曾用不同的方法、不同的实验体系进行多次酵母双杂交实验,从不同角度探索可能与HBSP相互作用的肝细胞蛋白[4-5,11-12]。酵母双杂交筛选猎物基因可采用顺序转化,共转化和接合等方法,本文采用顺序转化的方法,此法较共转化方法的转化效率高,而较接合法的效率低,但与后两者相比,顺序转化法不仅能一定程度的保存弱相互作用的蛋白,也能有效降低实验的假阳性率。
人类的UXT基因位于染色体Xp11.23-p11.22区,属于α-前折叠素样家族(prefoldin)成员,UXT蛋白由7个外显子编码,同时存在两种剪接变异体[6]:剪接变异体1(UXT-V1)和剪接变异体2(UXT-V2),UXT-V1比UXT-V2多出其N端12个氨基酸,且UXT-V1主要在细胞质中表达,UXT-V2在细胞核中表达,由此存在一些功能差异。UXT-V1与TNFα受体相关因子3(TNFR-associated factor 3,TRAF3)相互作用,从而连接线粒体外膜上的2个分子-MAVS和TRAF3,触发NF-κB的激活以及IFN-β的表达,在抗病毒信号传导过程中发挥重要作用[7]。UXT-V1还是TNF受体信号复合体组分,与TNF 受体相关因子2(TNF receptor-associated factor 2)结合,阻止TNF 受体相关死亡结构域蛋白召募Fas相关死亡结构域蛋白,从而具有抗凋亡的作用[13]。UXT-V1与UXT-V2都能够与一种Toll样受体、促凋亡蛋白SARM (sterile a and HEAT armadillo motif-containing protein)相互作用,但在SARM诱导的内源性凋亡过程中却发挥着相反的作用:共表达SARM与UXT-V1导致caspase 8活性下降而抑凋亡,共表达SARM与UXT-V2则促进caspase 8活性而诱导凋亡[14]。另外,UXT-V2,又名ART-27,能够与雄激素受体(androgen receptor,AR)的N末端结合,上调AR的转录活性,而与肿瘤的发生发展有关[15]。本研究通过酵母双杂交筛查实验,分离得到HBSP的猎物蛋白UXT-V1,但未得到UXT-V2。鉴于UXT两种剪接变异体功能不同,本研究首先明确HBSP是否与UXT的两种剪接变异体均存在互作,通过免疫共沉淀、激光共聚焦明确了HBSP仅与UXT-V1而不与UXT-V2结合,并以哺乳动物双杂交实验进一步验证了两者在肝细胞内具有相互作用,而GST-Pulldown实验又证实了HBSP和UXT-V1在体外具有直接相互作用。
UXT-V1能与NF-κB p65亚基结合,促使NF-κB活化入核,并作为NF-κB转录增强子复合物的一部分,增强其转录活性,并促进TNFα诱导的凋亡[16]。 本研究首先发现HBSP能够激活NF-κB,通过沉默UXT-V1,又发现UXT-V1表达减少将削弱NF-κB的活化,证明HBSP与UXT-V1的互作能够促进NF-κB通路活化。NF-κB的激活涉及复杂的调控过程[17]:在TNFα、IL-1β等炎症因子刺激下,激活MAPK、AKT等信号通路,IκB 激酶(IKK)磷酸化而活化、使对NF-κB有抑制作用的IκBα泛素化降解,NF-κB的2个亚基p65与p50转位至细胞核内,p65识别结合特定的DNA序列,并调控靶基因的转录,在免疫、炎症、肿瘤的发生中发挥至关重要的作用[18]。HBSP可能是调控机体在HBV急性感染后转为慢性感染状态的重要病毒蛋白,HBSP与UXT-V1相互作用如何激活NF-κB信号通路,以及下游具体的效应分子如何影响HBV相关疾病病程进展,相关研究目前正在进行中。
[1] Lee WM. Hepatitis B virus infection[J]. N Engl J Med, 1997, 337: 1733-1745. DOI: 10.1056/NEJM199712113372406
[2] Rosmorduc O, Petit MA, Pol S, et al.Invivoandinvitriolexpression of defective hepatitis B virus particles generated by spliced hepatitis B virus RNA[J]. Hepatology, 1995, 22(1): 10-19. DOI: 10.1002/hep.1840220103
[3] Mancini-Bourgine M, Bayard F, Soussan P, et al. Hepatitis B virus splice-generated protein induces T-cell responses in HLA-transgenic mice and hepatitis B virus-infected patients[J]. J Virol, 2007, 81(10): 4963-4972. DOI: 10.1128/JVI.02619-06
[4] Chen WN, Chen JY, Jiao BY, et al. Interaction of hepatitis B spliced protein (HBSP) with cathepsin B promotes hepatoma cell migration and invasion[J]. J Virol, 2012, 86(24): 13533-13541. DOI: 10.1128/JVI.02095-12
[5] Chen JY, Chen WN, Liu LL, et al. Hepatitis B spliced protein (HBSP) generated by a spliced hepatitis B virus RNA participates in abnormality of fibrin formation and functions by binding to fibrinogen γ chain[J]. J Med Virol, 2010, 82(12): 2019-2026. DOI: 10.1002/jmv.21918
[6] Sun S, Tang Y, Lou X, et al. UXT is a novel and essential cofactor in the NF-kappaB transcriptional enhanceosome[J]. J Cell Biol, 2007, 178(2): 231-244. DOI: 10.1083/jcb.200611081
[7] Huang Y, Liu H, Ge R, et al. UXT-V1 facilitates the formation of MAVS antiviral signalosome on mitochondria[J]. J Immunol, 2012, 188(1): 358-366. DOI: 10.4049/jimmunol.1102079
[8] Soussan P, Garreau F, Zylberberg H, et al.Invivoexpression of a new hepatitis B virus protein encoded by a spliced RNA[J]. J Clin Invest, 2000,105(1): 55-60. DOI: 10.1172/JCI8098
[9] Soussan P, Tuveri R, Nalpas B, et al. The expression of hepatitis B spliced protein (HBSP) encoded by a spliced hepatitis B virus RNA is associated with viral replication and liver fibrosis[J]. J Hepatol, 2003, 38(3): 343-348. DOI: 10.1016/S0168-8278(02)00422-1
[10] Duriez M, Mandouri Y, Lekbaby B, et al. Alternative splicing of Hepatitis B virus: a novel virus/host interaction altering liver immunity[J]. J Hepatol, 2017, 67(4): 687-699. DOI: 10.1016/j.jhep.2017.05.025. S0168-8278(17)32065-2
[11] Chen JY, Chen WN, Jiao BY, et al. Hepatitis B Spliced Protein (HBSP) promotes the carcinogenic effects of Benzo [alpha] pyrene by interacting with microsomal epoxide hydrolase and enhancing its hydrolysis activity[J]. BMC Cancer, 2014,14(1): 282. DOI: 10.1186/1471-2407-14-282
[12] Chen WN, Huang JG, Liang FF, et al. Hepatitis B spliced protein triggers TGFβ1-induced epithelial-mesenchymal transition via interaction with transforming growth factor beta-1-induced transcript 1 protein[J]. Chin J Zoonoses,2017,33 (4): 305-311. DOI: 10.3969/j.issn.1002-2694.2017.04.003 (in Chinese)
陈婉南,黄俊高,梁菲菲,等.乙型肝炎病毒剪接特异性蛋白HBSP与TGFβ1诱导蛋白1相互作用促进TGFβ1诱导的肝癌细胞上皮间质转化[J].中国人兽共患病学报,2017 ,33 (4) :305-311.
[13] Huang Y, Chen L, Zhou Y, et al. UXT-V1 protects cells against TNF-induced apoptosis through modulating complex II formation[J]. Mol Biol Cell, 2011, 22(8): 1389-1397. DOI: 10.1091/mbc.E10-10-0827
[14] Sethurathinam S, Singh LP, Panneerselvam P, et al. UXT plays dual opposing roles on SARM-induced apoptosis[J]. FEBS Lett,2013,587(20): 3296-3302. DOI: 10.1016/j.febslet.2013.08.033
[15] Taneja SS, Ha S, Swenson NK, et al. ART-27, an androgen receptor coactivator regulated in prostate development and cancer[J]. J Biol Chem,2004,279(14): 13944. DOI: 10.1074/jbc.M306576200
[16] Sun S. UXT is a novel and essential cofactor in the NF-κb transcriptional enhanceosome[J]. J Cell Biol, 2007, 178(2): 231-244. DOI: 10.1083/jcb.200611081
[17] Gilmore TD. Introduction to NF-κB: players, pathways, perspectives[J]. Oncogene, 2006, 25(51): 6680-6684. DOI: 10.1038/sj.onc.1209954
[18] Hoesel B,Schmid JA. The complexity of NF-κB signaling in inflammation and cancer[J]. Mol Cancer, 2013,12(1): 86. DOI: 10.1186/1476-4598-12-86

