藏仔猪致病性大肠杆菌疫苗的制备及效果评价
, , ,, ,,
致病性大肠杆菌是目前集约化养猪场中最为常见,也是最为严重的仔猪病原菌之一,其主要引起仔猪腹泻症状,据研究,我国每年仔猪因腹泻死亡占仔猪死亡总数的39.8%[1-2]。仔猪腹泻不仅造成仔猪生长性能缓慢而且引起仔猪生长发育停滞(即所谓的僵猪),严重影响藏区养猪业的健康发展。近年来,随着西藏规模化养猪业的迅速发展,猪大肠杆菌病在西藏流行,猪腹泻疾病几乎遍布所有的猪场,发病率升高,给养猪业带来的经济损失越来越严重。同时,由于滥用抗生素等导致耐药性菌株的数量不断增多,加大了该病治疗难度[3-5]。
疫苗免疫接种是有效预防传染性疾病的主要手段,但西藏地区居住分散,科学教育基础差,动物疫苗接种推行和普及困难。研究西藏仔猪的肠道传染病的流行菌株,流行区域以及感染状况,针对疫苗接种过程中一般的注射免疫在藏区操作困难的问题,迫切需要探索新的疫苗和新的免疫策略,这对西藏养猪行业有非常重要的现实意义。
1 材料与方法
1.1 材料
1.1.1实验动物 采集西藏某猪场死亡藏仔猪组织,装入自封袋,编号;KM小鼠购自成都达硕实验动物有限公司。
1.1.2主要试剂 普通琼脂平板、麦康凯琼脂平板、伊红美蓝平板、生化培养基均由西藏大学农牧学院动物科学学院高原动物疫病检测中心制备。LB培养基,卡那霉素、氯霉素等储存液由四川大学华西基础医学院与法医学院微生物学实验室制备。甘露醇购自成都科龙化工,重组质粒pET28a(+)/CTB由课题组构建,表达纯化由四川万可泰生物技术有限公司提供。
1.2 方法
1.2.1细菌分离与鉴定 无菌取出待检组织,接种在普通平板上,在37 ℃培养24 h,观察生长情况,并进行革兰染色镜检。挑取普通平板上典型菌落分别接种在麦康凯及伊红美蓝琼脂平板上,37 ℃,培养24 h,观察结果。挑取大肠杆菌典型菌落分别进行生化鉴定和血清型鉴定,同时分离菌用致病性大肠杆菌菌株16S RNA 19-1523 bp特异序列引物进行PCR扩增, 扩增产物在含2%琼脂糖凝胶中电泳。具体引物和扩增目的片段如下表1。
表1 大肠杆菌菌株16S RNA特异序列引物16S rRNA序列引物
Tab.1 Pathogenic E. coli primers of 16S specific sequences RNA

PrimersSequences(5′⁃3′)SitesoftheprimersProduct/bpP1ATGGCTCAGATTGAACGC19⁃371505P2CAGGTTCCCCTACGGTTA1505⁃1523—
1.2.2重组霍乱毒素B亚单位的表达与纯化 将重组霍乱毒素B亚单位工程菌接种于LB液体培养基,增菌培养,至A600≈0.6加入终浓度为1 mmol/L IPTG诱导蛋白的表达。收集菌液,4 ℃,10 000 r/min离心10 min。沉淀按10 mL培养物加入1 mL Binding Buffe的比例加入缓冲液(同时加入PMSF至终浓度0.1 mmol/L),吹打悬浮细菌。加入溶菌酶至终浓度为1 mg/mL,冰上放置30 min后置于4 ℃摇床上孵育10 min。在冰上超声破碎细菌,300W,破碎10 s,间隔10 s,作用15 min。将超声破碎后的菌液,4 ℃,10 000 r/min离心20 min,收集上清液与沉淀。最后将上清参照GE公司HisTrapTMHP纯化柱说明书对表达的重组融合蛋白进行纯化,获得高纯度rCTB,然后冻干,备用。
1.2.3疫苗制备 将大肠杆菌接种在LB固体平板上,放于37 ℃恒温培养箱中,培养过夜;洗脱细菌,接种到1L LB液体培养基中,放于37 ℃恒温摇床中,培养24 h;培养后1%甲醛灭活;6 000~8 000 r/min离心10~15 min,收集菌体;用3%~5%的甘露醇溶液重悬,分高、低细菌浓度调整疫苗含特异抗原的最终浓度,一部分作为不含佐剂的疫苗直接冻干,另一部分加入重组霍乱毒素B亚单位作为免疫佐剂再冻干,制备获得仔猪大肠杆菌灭活苗和仔猪大肠杆菌灭活佐剂疫苗(白色疏松体,且加入蒸馏水3~8 min能完全溶解)。
1.2.4疫苗效果检测 用含佐剂和不含佐剂的疫苗按0、14、28、42 d的免疫程序,分别每次每只100 μL肌肉注射免疫小鼠或每次每只200 μL口服免疫小鼠。免疫前后采集眼球血以及4次免疫完成后14 d取小鼠胃 、肠液、血液,用间接ELISA方法测定特异的抗大肠杆菌特异抗体IgG和IgA。每组末次免疫结束后第14 d,用2倍LD50的致病性大肠杆菌攻击不同免疫处理的各组小鼠,观察3 d,记录攻击感染小鼠的存活数,分别计算死亡率和保护率。
1.2.5疫苗免疫后副反应监测 用含佐剂和不含佐剂的疫苗,按0、14、28、42 d的免疫程序,分别每次每只100 μL肌肉注射免疫小鼠或每次每只200 μL口服免疫小鼠。每次免疫后监测各组小鼠的体重、被毛和精神状况,与对照组比较,判断疫苗免疫后小鼠的副反应。
2 结 果
2.1大肠杆菌分离鉴定 在普通平板上生长出圆形、光滑、湿润、半透明、灰白色菌落,经革兰氏染色后发现革兰氏阴性两端钝圆的直杆菌。在麦康凯琼脂平板及伊红美蓝平板上分别形成红色菌落和带金属闪光的菌落,并能发酵乳糖、葡萄糖、蔗糖,其中乳糖发酵最快,甘露醇、吲哚、甲基红均阳性,VP、枸橼酸、氧化酶呈阴性,血清型为O66,分离菌PCR扩增电泳结果在1 500 bp处可以见到1条清晰的特异目的条带,大小与与预期结果相符,见图1。
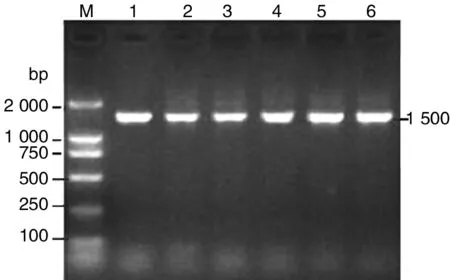
M: The molecular weight; 1,2,3,4,5,6 were detected E. coli strains图1 致病性大肠杆菌16S RNA特异性序列PCR扩增结果Fig.1 Results of 16S specific sequence RNA of pathogenic E. coli by PCR
2.2 免疫效果
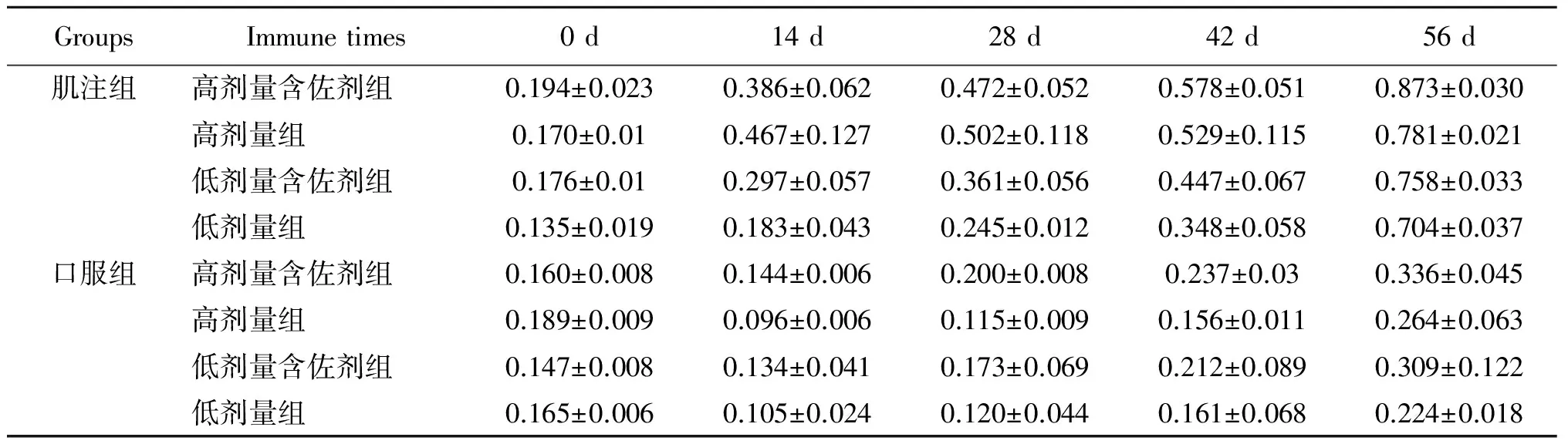
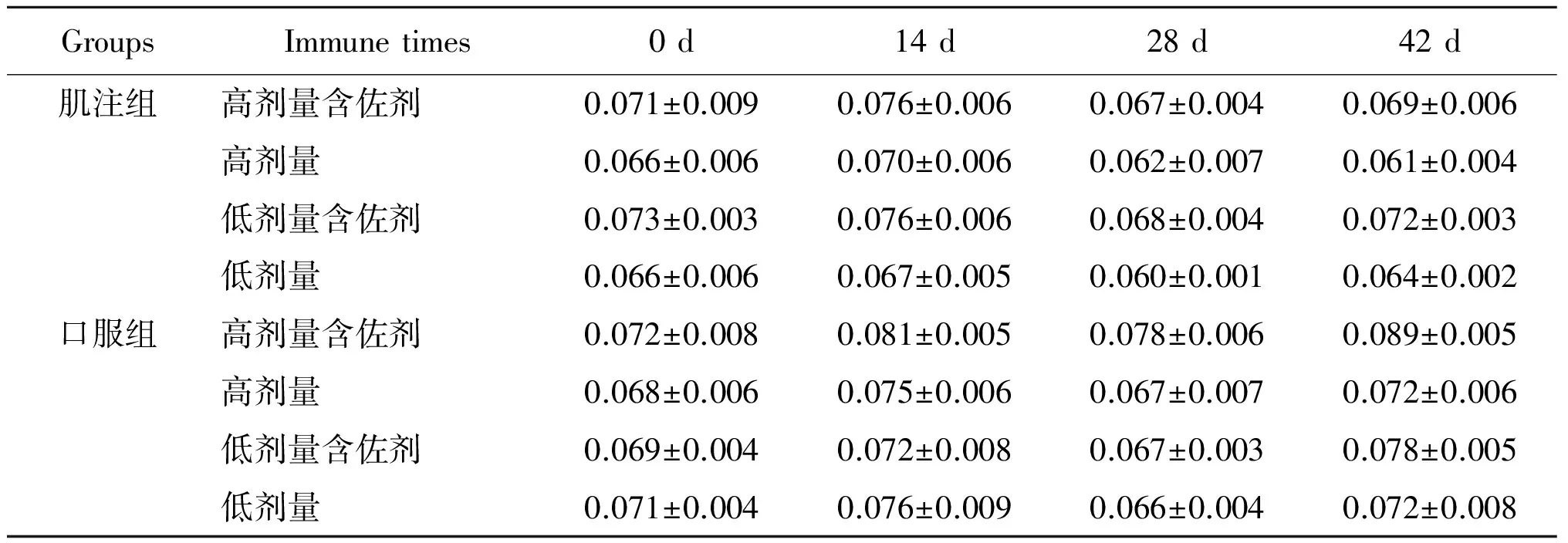
2.2.1抗体检测 血清抗体IgG实验结果见表2、图2和图3:肌注高剂量含佐剂组与高剂量不含佐剂组免疫效果相当,肌注低剂量含佐剂组比不含佐剂组免疫效果好;口服组无论是高剂量含佐剂组还是低剂量含佐剂组免疫效果均好于高、低剂量不含佐剂组,且高剂量免疫效果好于低剂量免疫效果。血清抗体IgA实验结果见表3、图4和图5:肌注组无论是高、低剂量佐剂组和高、低剂量不含佐剂组均未在血清中产生特异IgA抗体,而口服高剂量佐剂组在免疫末期血清中产生了比较高的特异IgA抗体。从免疫次数看,无论是肌注还是口服组免疫4次的抗体水平明显好于免疫1、2、3次的抗体水平。
表2 免疫不同时间不同组别血清抗体IgG的变化(A450)
Tab.2 Changes of serum antibodies IgG in different groups at different time (A450)
GroupsImmunetimes0d14d28d42d56d肌注组高剂量含佐剂组0.194±0.0230.386±0.0620.472±0.0520.578±0.0510.873±0.030高剂量组0.170±0.010.467±0.1270.502±0.1180.529±0.1150.781±0.021低剂量含佐剂组0.176±0.010.297±0.0570.361±0.0560.447±0.0670.758±0.033低剂量组0.135±0.0190.183±0.0430.245±0.0120.348±0.0580.704±0.037口服组高剂量含佐剂组0.160±0.0080.144±0.0060.200±0.0080.237±0.030.336±0.045高剂量组0.189±0.0090.096±0.0060.115±0.0090.156±0.0110.264±0.063低剂量含佐剂组0.147±0.0080.134±0.0410.173±0.0690.212±0.0890.309±0.122低剂量组0.165±0.0060.105±0.0240.120±0.0440.161±0.0680.224±0.018
表3 免疫不同时间不同组别血清抗体IgA的变化(A450)
Tab.3 Changes of serum antibodies IgA in different groups at different time (A450)
GroupsImmunetimes0d14d28d42d56d肌注组高剂量含佐剂0.071±0.0090.076±0.0060.067±0.0040.069±0.0060.070±0.069高剂量0.066±0.0060.070±0.0060.062±0.0070.061±0.0040.079±0.0056低剂量含佐剂0.073±0.0030.076±0.0060.068±0.0040.072±0.0030.073±0.0019低剂量0.066±0.0060.067±0.0050.060±0.0010.064±0.0020.078±0.0034口服组高剂量含佐剂0.072±0.0080.081±0.0050.078±0.0060.089±0.0050.280±0.14高剂量0.068±0.0060.075±0.0060.067±0.0070.072±0.0060.130±0.018低剂量含佐剂0.069±0.0040.072±0.0080.067±0.0030.078±0.0050.154±0.005低剂量0.071±0.0040.076±0.0090.066±0.0040.072±0.0080.120±0.005
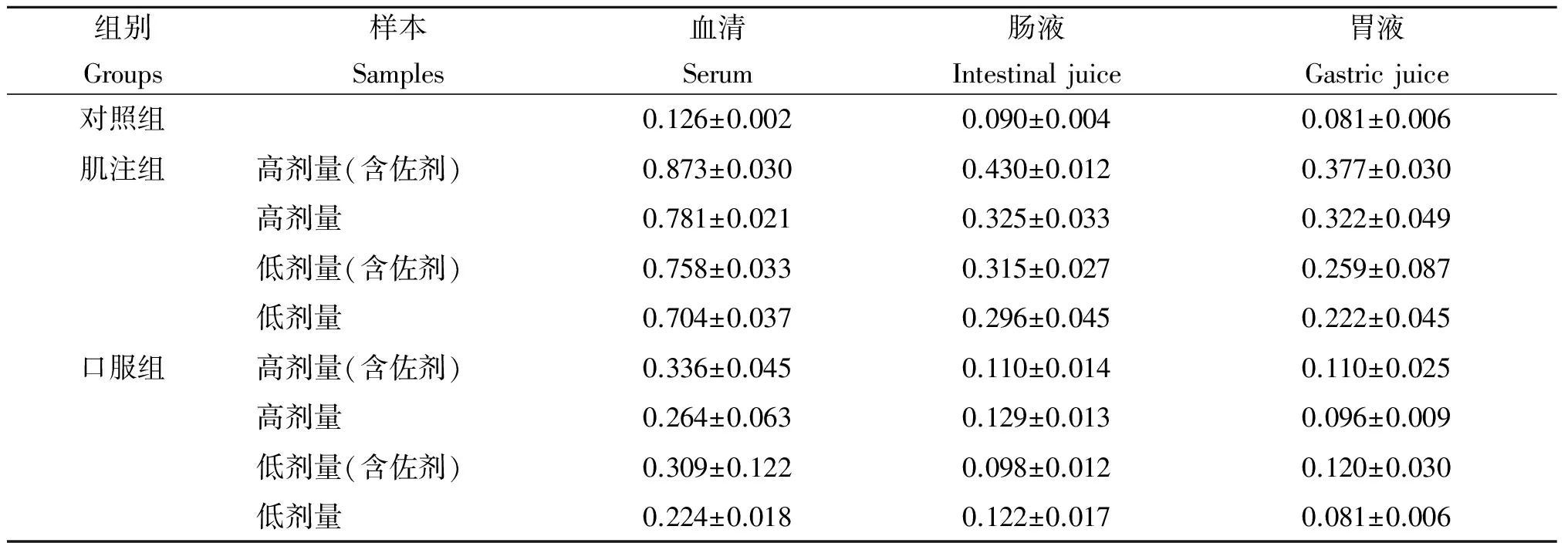
从表2和表3中可看出,含佐剂和不含佐剂的大肠杆菌灭活疫苗的肌注组在血清,胃液,肠液中均可以产生特异IgG抗体,而口服组只在血清中产生特异IgG抗体,同时肌注组特异IgG抗体水平高于口服组,不含佐剂的肌注组、不含佐剂的大肠杆菌疫苗口服组和含佐剂的大肠杆菌疫苗的肌注组均不产生特异IgA抗体,而含佐剂的大肠杆菌疫苗口服组在血清和肠液中可以产生特异IgA抗体。
表4 不同疫苗组分和不同免疫途径免疫小鼠后特异IgG抗体的变化(A450)
Tab.4 Changes of serum antibodies IgA in different groups at different time (A450)
组别Groups样本Samples血清Serum肠液Intestinaljuice胃液Gastricjuice对照组0.126±0.0020.090±0.0040.081±0.006肌注组高剂量(含佐剂)0.873±0.0300.430±0.0120.377±0.030高剂量0.781±0.0210.325±0.0330.322±0.049低剂量(含佐剂)0.758±0.0330.315±0.0270.259±0.087低剂量0.704±0.0370.296±0.0450.222±0.045口服组高剂量(含佐剂)0.336±0.0450.110±0.0140.110±0.025高剂量0.264±0.0630.129±0.0130.096±0.009低剂量(含佐剂)0.309±0.1220.098±0.0120.120±0.030低剂量0.224±0.0180.122±0.0170.081±0.006
表5 不同疫苗组分和不同免疫途径免疫小鼠后特异IgA的变化(A450)
Tab.5 Changes of specific IgA with different vaccine components and different immune treatments in mice (A450)
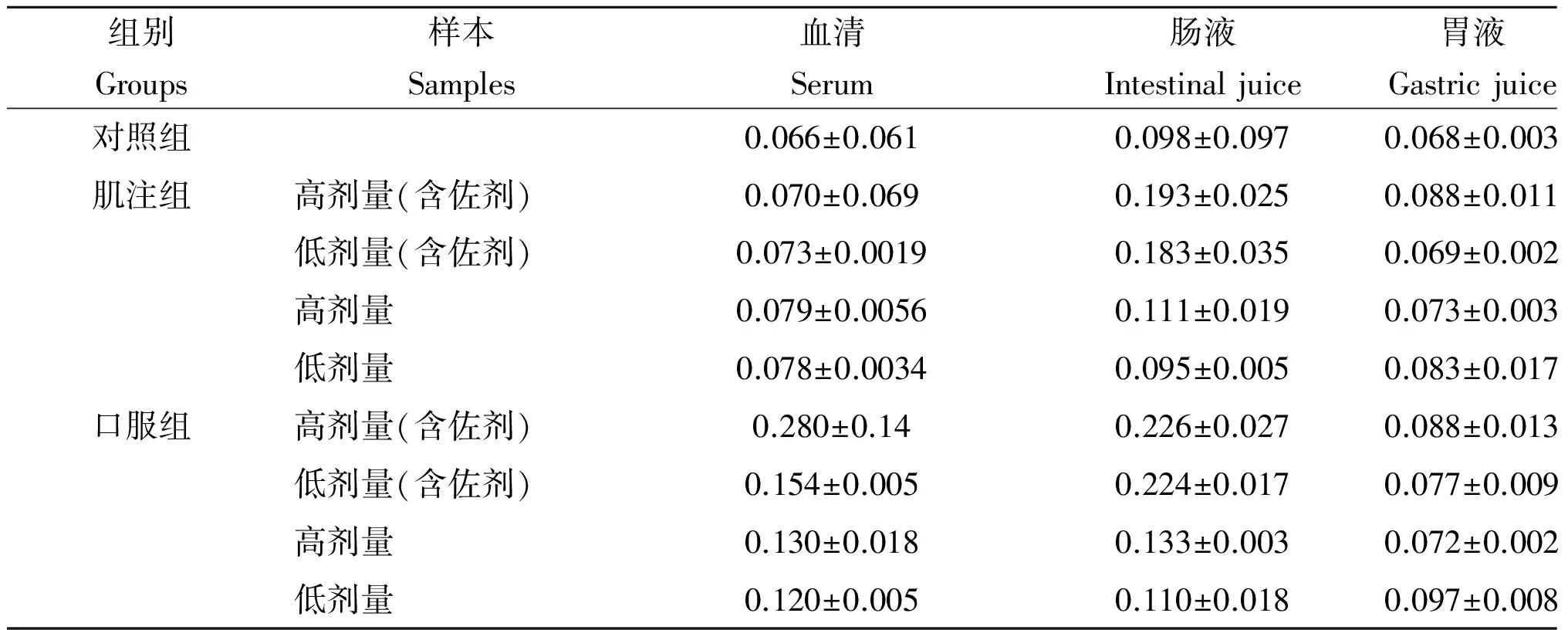
组别Groups样本Samples血清Serum肠液Intestinaljuice胃液Gastricjuice对照组0.066±0.0610.098±0.0970.068±0.003肌注组高剂量(含佐剂)0.070±0.0690.193±0.0250.088±0.011低剂量(含佐剂)0.073±0.00190.183±0.0350.069±0.002高剂量0.079±0.00560.111±0.0190.073±0.003低剂量0.078±0.00340.095±0.0050.083±0.017口服组高剂量(含佐剂)0.280±0.140.226±0.0270.088±0.013低剂量(含佐剂)0.154±0.0050.224±0.0170.077±0.009高剂量0.130±0.0180.133±0.0030.072±0.002低剂量0.120±0.0050.110±0.0180.097±0.008
2.2.2保护性检测 每组末次免疫结束后第14 d,用2倍LD50的致病性大肠杆菌菌量攻击各组不同免疫处理的小鼠,观察3 d,记录攻击感染小鼠的存活数,分别计算死亡率和保护率,具体见表6。
表6 小鼠不同免疫处理对致病性大肠杆菌的攻击保护率
Tab.6 Protection rates of pathogenic E. coli in different immunization treatments of mice

Groups(n=15)Mortalityrate(%)Protectionrate(%)对照组8020肌注组高剂量(含佐剂)0100低剂量(含佐剂)0100高剂量0100低剂量0100口服组高剂量(含佐剂)0100低剂量(含佐剂)2080高剂量2080低剂量4060
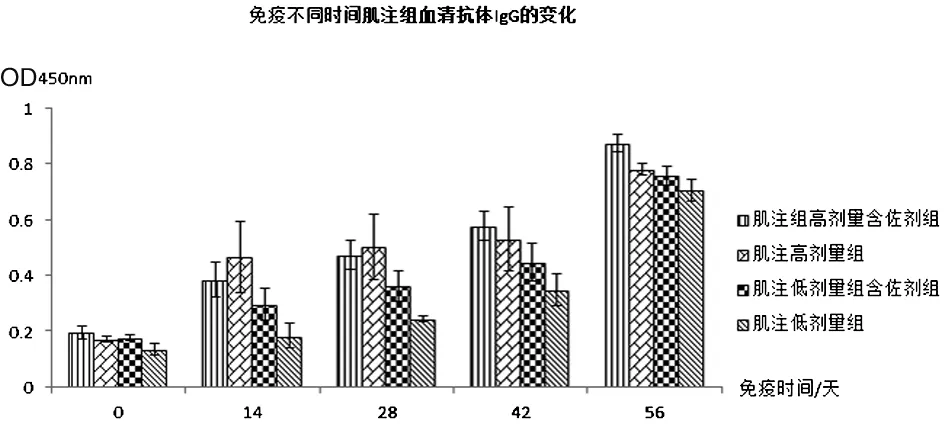
图2 免疫不同时间血清抗体IgG的变化(肌注组)Fig.2 Changes of serum IgG in different time of immunization (intramuscular injection group)
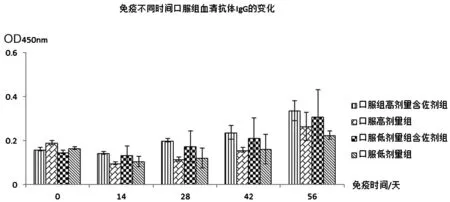
图3 免疫不同时间血清抗体IgG的变化(口服组)Fig.3 Changes of serum antibody IgG in different time of immunization (oral group)
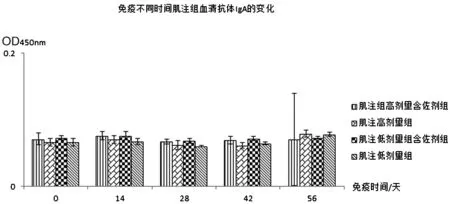
图4 免疫不同时间血清抗体IgA的变化(肌注组)Fig.4 Changes of serum antibody IgA at different time of immunization (intramuscular injection group)
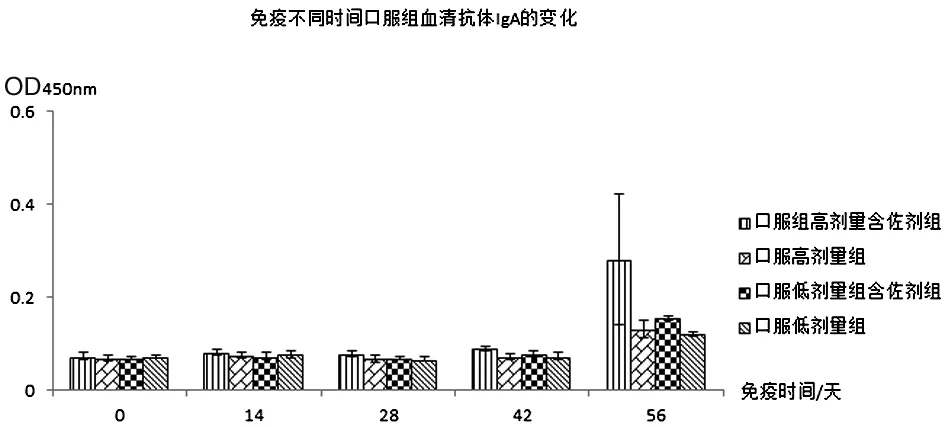
图5 免疫不同时间血清抗体IgA的变化(口服组)Fig.5 Changes of serum antibody IgA at different time of immunization (oral group)
2.2.3免疫后的副反应监测 按0、14、28、42 d的免疫程序肌肉注射免疫小鼠或口服免疫小鼠后观察,无论含佐剂和不含佐剂的疫苗,其各组小鼠的体重、被毛和精神状况与对照组比较无可见差异。
3 讨 论
免疫佐剂可增强抗原所激发的免疫应答,可提高疫苗抗原的免疫原性,以及增强吞噬细胞的非特异性杀伤功能和特异性细胞免疫的刺激作用等,提高疫苗的免疫效力[5]。佐剂是疫苗特别是灭活疫苗所必不可少的成分,因此,本试验选择了重组霍乱毒素B亚单位免疫佐剂。大量的研究结果已经证明, 重组霍乱毒素B亚单位是一种良好的免疫佐剂和输送抗原载体, 通过黏膜途径免疫其效果更佳[6-11]。该免疫佐剂作为新型提高粘膜免疫抗原提呈能力的蛋白质分子,无毒害无残留,课题组在小鼠的实验结果证明本次配方中,无论对口服途径免疫还是肌肉注射途径免疫,重组霍乱毒素B亚单位作为疫苗佐剂均能显著提高藏猪大肠杆菌灭活疫苗免疫效力。
本研究用西藏地区分离鉴定的猪致病性大肠杆菌临床菌株为关键抗原材料,制备含生物佐剂的仔猪大肠杆菌灭活疫苗,经过口服和肌注法4次免疫实验小鼠后,该灭活疫苗能够有效的提高小鼠肠液特异的Ig G或IgA抗体,达到有效增强肠道和血液免疫反应的目的,此实验数据为致病性大肠杆菌的佐剂研究和免疫接种途径研究提供了新数据。
本研究以小鼠为模型,攻击保护性实验研究显示无论口服还是肌肉注射,本次制备的疫苗免疫小鼠后均可对致病性大肠杆菌产生很好的保护性。特别是高剂量含佐剂疫苗口服4次免疫小鼠对致病性大肠杆菌的保护率达到了100%,初步证明本疫苗口服免疫接种方便,对大肠杆菌攻击保护有效。本研究初步探索了藏猪养殖过程中致病性大肠杆菌的疫苗开发新思路,为西藏地区猪致病性大肠杆菌疫苗的抗原、佐剂、剂量、免疫程序和免疫途径的研究奠定了基础。
[1] Yang JS, Zheng EH, Lin J, et al. Surveillance of diarrheagenicEscherichiacoliinfection in Yanping and Yongan, Fujian Province, China[J]. Chin J Zoonoses, 2017, 33(4): 353-356. DOI: 10.3969/j.issn.1002-2694.2017.04.012 (in Chinese)
杨劲松, 郑恩惠, 林杰,等.福建省延平区及永安市致泻性大肠埃希菌监测分析[J].中国人兽共患病学报,2017, 33(4): 353-356.
[2] Wei XY, You L, Tian KC, et al. Etiological surveillance of diarrheagenicEscherichiacolifrom infectious diarrheal patients in Guiyang, China, 2013[J]. Chin J Zoonoses, 2015, 31(9): 881-885. DOI: 10.3969/j.issn.1002-2694.2015.09.020 (in Chinese)
韦小瑜, 游旅, 田克诚, 等. 贵阳地区2013年腹泻病例中致泻性大肠杆菌的病原监测分析[J].中国人兽共患病学报, 2015, 31(9): 881-885.
[3] Qian MM, Xu HY, Zong Q, et al. Establishment of conventional RT-PCR and real-time RT-PCR to detect norovirus and its application[J]. Chin J Zoonoses, 2015, 31(7): 602-606. DOI: 10.3696/j.issn.1002-2694.2015.07.002 (in Chinese)
钱明明,许海燕,宗晴,等.常规RT-PCR与荧光定量RT-PCR检测GΙ、GП型诺如病毒方法的建立及其应用[J]. 中国人兽共患病学报,2015,31(7): 602-606.
[4] Song X, Zhao G, Wang J, et al. Establishment and application of multiplex direct PCR for rapid detection of common food borne pathogens in swine products[J]. Chin J Zoonoses, 2017, 33(8): 710-715. DOI: 10.3969/j.issn. 1002-2694.2017.08.013 (in Chinese)
宋雪, 赵格, 王娟, 等.猪肉中常见致病菌的多重直接PCR法的建立与应用[J].中国人兽共患病学报,2017, 33(8): 710-715.
[5] Bai WB, Yu KZ. Diagnosis of animal infectious diseases[M]. Beijing: Agricultural Publishing House, 2002, 12: 37-372. (in Chinese)
白文彬,于康震.动物传染病诊断学[M].北京:农业出版社,2002,12:37-372.
[6] Oien NL, Brideau RJ, Walsh EE, et al. Induction of local and systemic immunity against human respiratory syncytial virus using achimeric FG glycoprotein and cholera toxin B subunit[J]. Vaccine, 1994, (12): 731-735.
[7] Wu HY, Russell MW. Induction of mucosal and systemic immune responses by intranasal immunization using recombinant cholera toxin B subunit as an adjuvant[J]. Vaccine, 1998, (16): 286-292.
[8] Isaka M, Yasuda Y, Kozuka S, et al. Systemic and mucosal immune responses of mice to aluminum-absorbed or aluminum nonabsorbed tetanus toxoidadmistered intranasally with recombinant cholera toxin B subunit[J]. Vaccine, 1998, (16): 1620-1626.
[9] Shi CH, Cao C, Zhing JS, et al. Gene fusion of choleras toxin B subunit and HBV PreSepitope and the antigenicity of fusion protein[J]. Vaccine, 1995, 13: 933-937.
[10] Li SQ, Zhang ZS, Tu HL. Construction of expression vector of cholera toxin B subunit fusion protein[J]. J Mil Medical Sci, 1996, 4: 179-181. (in Chinese)
李淑琴, 张兆山, 涂火林.霍乱毒素B 亚单位融合蛋白表达载体的构建[J].军事医学科学院院刊, 1996 , 4 :179-181 .
[11] Wang BN, Pan X, Huang XJ, et al.Helicobacterpylorirecombinant multi epitope vaccine construction engineering strain and its microbiological characteristics[J]. J Sichuan Univ, 2015, 03: 354-358. (in Chinese)
王保宁,潘兴,黄筱钧,等.重组幽门螺杆菌多表位疫苗工程菌株的构建及其微生物学特性研究[J].四川大学学报,2015,03:354-358.

