星点设计-效应面法优化马钱子碱-士的宁(B-S)双载药固体脂质纳米粒的制备工艺研究
史磊,曹思思,吕邵娃,孙爽 ,赵程程 ,李永吉*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.哈尔滨职业技术学院,黑龙江 哈尔滨 150036)
马钱子始载于《本草纲目》,又称番木鳖,为马钱科植物马钱子(Strychnosnux-vomicaL.) 及长籽马钱(Strychnos wallichiana steud.Ex DC.) 的干燥成熟种子,马钱子味苦、性寒,有大毒。具有通络止痛、散结消肿的功效[1]。马钱子种子含总生物碱约2%~5%[2],其中,士的宁(番木鳖碱,strychnine,C21H22O2N2)约占总生物碱的40%~50%,但毒性较大,其次为马钱子碱(brucine,C22H26O4N2),其毒性是士的宁的1/40。口服马钱子生药7 g可致死,中毒潜伏期30~180 min[3~5]。马钱子主要成分马钱子碱和士的宁既是有效成分也是毒性成分,占马钱子总生物碱的80%左右,其中,士的宁毒性最强,而且治疗量与中毒量非常接近。固体脂质纳米粒(solidlipidnanoparticles,SLN)是20世纪90年代起发展起来的一种在体内可生物降解、固体的、以天然或合成类脂材料为药物载体,将药物吸附或包裹于脂质核制成的粒径约为50~1 000 nm的亚微粒给药系统[6]。具有良好的生理相容性,能提高难溶性药物的溶解度;具有长效缓控释、靶向的作用,适合多种途径给药[7]。目前市场上马钱子制剂存在毒性大、安全剂量达不到治疗效果等缺陷,为了提高制剂的生物利用度、降低药物毒性,本文采用马钱子碱-士的宁双载药系统进行固体脂质纳米粒包合,通过星点设计-效应面法研究其制备工艺,并进行处方优化。
1 材料
1.1 仪器 752型紫外分光光度计(上海菁华科技仪器有限责任公司);BS124S电子天平(德国赛多利斯公司);KQ-500E型超声清洗仪(昆山市超声仪器有限公司);JEM-1200EX透射电镜(日本电子株式会社);Zetasizer Nano-ZS90激光粒度分析仪(马尔文仪器有限公司);SENCO-R系列旋转蒸发仪(上海申科技有限公司);SHB-3循环水多用真空泵(郑州杜甫仪器厂);DF-101Z集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);Waters2695高效液相色谱仪,包括Waters2996 DAD 检测器、Empower色谱工作站(美国Waters公司);DiamonsilC-18色谱柱(4.6 mm×250 mm,5 μm)(北京迪马科技有限公司)。
1.2 药品及试剂 马钱子碱对照品(≥98%,上海源叶生物科技有限公司,批号652154-10-4);士的宁对照品(≥98%,上海源叶生物科技有限公司,批号1421-86-9);乙腈、甲醇为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 脂质体制备工艺
采用乳化蒸发法制备,称取单硬脂酸甘油酯(50 mg)-卵磷脂(100 mg)分散于10 mL无水乙醇中,超声使其溶解形成有机相。配制20 mL浓度为0.2%的F-68水溶液形成水相。分别称取约2 mg马钱子碱(Brucine,以下简称B)和士的宁(Strychnine,以下简称S),溶解于有机相,将有机相用1 ml注射器在1 000 r/min的磁力搅拌的条件下注入水相中,磁力搅拌1 h,冰浴中固化1 h,即得脂质体溶液。
2.2 含量测定及方法学考察
2.2.1 色谱条件 波长265 nm;流速1.0 mL/min;柱温30℃;进样量10 μL;等度洗脱,流动相:乙腈(21%)-[0.01 mol/L庚烷磺酸钠溶液与0.02 mol/LKH2PO4的等量混合液(10%磷酸调pH值2.8)](79%)。
2.2.2 对照品溶液制备 精密称取B对照品4.4 mg和S对照品2.7 mg至25 ml容量瓶中,加入甲醇使其溶解,定容,得对照品贮备液。
2.2.3 供试品溶液制备 按“2.1”项下制备脂质体样品,精密量取 B-S双载脂质体混悬液0.5 mL,置5 mL量瓶中,甲醇稀释近刻度,超声处理10 min使其完全破乳,定容,0.22 μm有机微孔滤膜滤过,续滤液作为供试品溶液。
2.2.4 专属性考察 按照“2.2.1”项下色谱条件,将空白纳米粒溶液、B与S的混合对照品溶液、B-S脂质体供试品溶液注入HPLC进行检测(色谱图见图1)。在此色谱条件下,载体等材料不干扰样品的测定,灵敏度高专属性强、方法可靠。
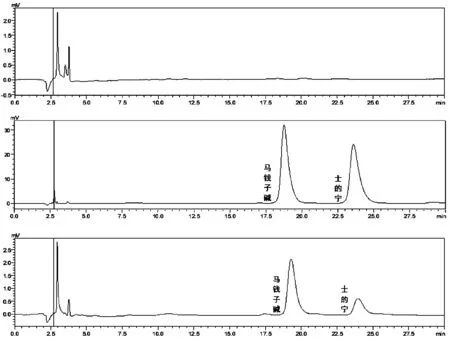
Fig.1 Chromatogram of specificity(from the top down:blank SLN,BS reference substance and BS-SLN)
2.2.5 线性关系的考察 分别精密量取“2.2.2”项下的对照品储备液1 ml、2 ml、3 ml、4 ml、5 ml至10 ml容量瓶中,甲醇定容,得系列混合对照品溶液。按“2.1.2”项下色谱条件测定,峰面积为纵坐标(Y),浓度为横坐标(X),绘制标准曲线。马钱子碱线性方程为:Y=23 130X-643.7(R=0.999 8);士的宁线性方程为Y=35 521X-4 130(R=0.999 9)。结果表明,B在17.60~88.00 μg/mL、S在10.8~54.00 μg /mL范围内线性关系良好。
2.2.6 方法学考察 经回收率实验、精密度实验、稳定性实验验证、重复性实验证实,方法可靠。
2.3 包封率测定方法的建立
采用葡聚糖凝胶色谱法测定包封率,取载药脂质体纳米粒溶液2 mL,加入到Sephadex G-50凝胶柱顶部,用蒸馏水以1 mL/min洗脱,分离纳米粒和游离药物,接取游离药物定容至50mL容量瓶中,摇匀,0.22 μm微孔滤膜滤过,进样(10 μL),计算包封率以及载药量。包封率以及载药量计算公式为:包封率 (Entrapment efficiency,EE)=(WQ-QL)/WQ×100%;载药量(Durg loadingy,DL)=(WQ-WL)/(WP+WR-WL);其中,WP为硬脂酸甘油酯-大豆卵磷脂用量,WQ为药物的投入量,WL为测得的游离药物量,WR为乳化剂用量。
2.4 星点设计-效应面法优化实验
2.4.1 星点设计实验
经预实验及单因素考察,双载药系统的单硬脂酸甘油酯与卵磷脂比例、硬脂酸甘油酯用量、马钱子碱与士的宁比例、表面活性剂浓度四个因素对BS-SLN有显著的影响,可对其进一步优化,故采用四因素的星点设计-效应面法设计实验。此设计中,单硬脂酸甘油酯与卵磷脂比例(X1)、单硬脂酸甘油酯用量(X2)、马钱子碱与士的宁比例(X3)、F-68浓度(X4)分别为独立因素X1,X2,X3,X4,共设五水平表,包括析因设计点、极值点(即+1,-1,0,+а 和-а)。真实值和代码值见Tab.1。以总包封率(Y1,%),总载药量(Y2,%)为响应参数,按照星点设计方案安排试验。

Tab.1 The real value and code
2.4.2 模型拟合及方差分析
2.4.2.1 对总包封率的分析
实验设计方差分析表见Tab.2,各因素与指标之间的等高线及响应面3D效果图见Fig.2。经SAS软件分析,模型显著性检验F=20.39,P<0.01, 说明该模型具有统计学意义,决定系数R2=0.941 1,调整后的Adj.R2=0.886 1,均较高,说明回归方程拟合度好。其中X2、X3、X1X2、X2X3、X2X4、X3X4、X12、X22、X32、X42对方程影响显著。回归方程为:Y1=-0.890 65-0.348 95X1+0.013 842X2+0.243 32X3+3.414 68X4+0.026 130X1X2-0.054 182 X1X3-0.633 41X1X4+3.238 27×10-3X2X3+0.033 514X2X4-0.329 43X3X4-0.675 27X12-3.399 13×10-4X22-0.059 061X32-6.855 97 X42,R2=0.946 1,调整R2= 0.971 7,P<0.000 1,小于0.05,模型显著。对于包封率来说,单硬脂酸甘油酯用量(X2)、马钱子碱与士的宁比例(X3)是主要的影响因素。
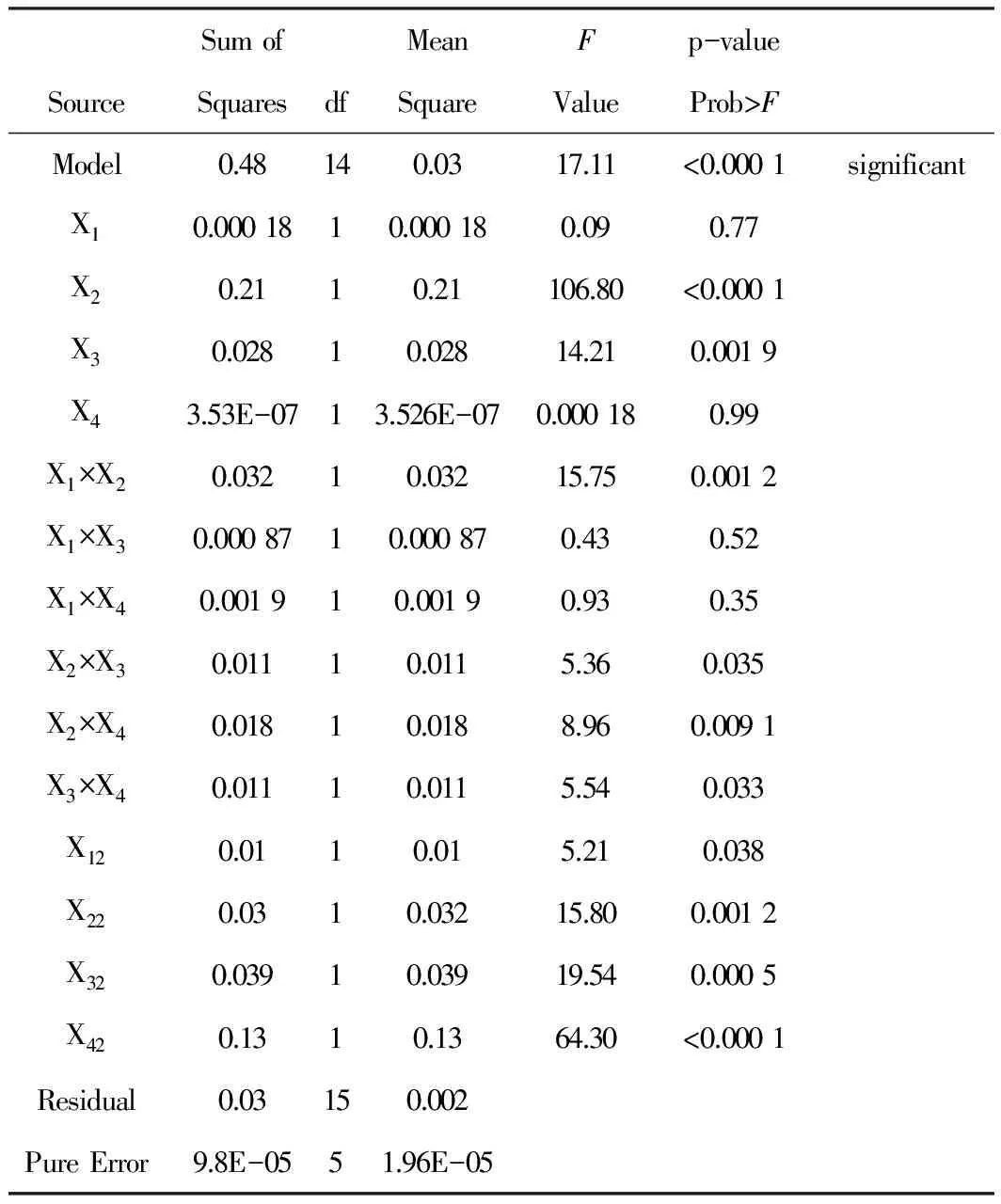
Tab.2 ANOVA for response surface quadratic model of Y1
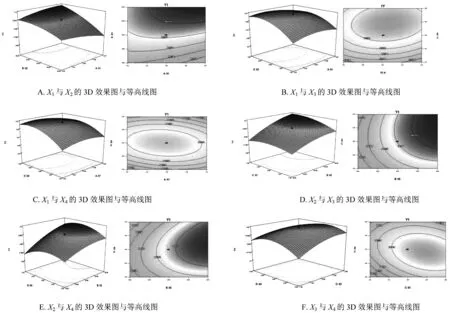
Fig.2 Contour plot and response surface of Y1 follows independent variables interaction for X1X2(A)、X1X3(B)、X1X4(C)、X2X3(D)、X2X4(E) and X3X4(F)
2.4.2.2 对总载药量的分析
实验设计方差分析表见Tab.3。经SAS软件分析,模型显著性检验F=27.46,P<0.01, 说明该模型具有统计学意义,决定系数R2=0.951 2,调整后的Adj.R2=0.905 7,均较高,说明回归方程拟合度好。其中X1、X2、X3、X1X2、X2X3、X2X4、X22、X32、X42对方程影响显著。
回归方程为:
Y2=4.06×10-3-0.029X1+2.47×10-4X2-2.40×10-3X3+0.058X4+7.31×10-4X1X2+2.80×10-3X1X3-7.39×10-3X1X4+1.03×10-4X2X3+7.50×10-4X2X4-7.80×10-4X3X4-4.77×10-3X12-9.32×10-6X22-6.92×10-4X32-0.15 X42
各因素与指标之间的等高线及响应面3D效果图为Fig.3,可见4个因素对指标的影响。由Tab.3方差分析结果知,P<0.05表明模型是显著的。对于载药量来说,单硬脂酸甘油酯与卵磷脂比例(X1)、单硬脂酸甘油酯用量(X2)、马钱子碱与士的宁比例(X3)是主要的影响因素。
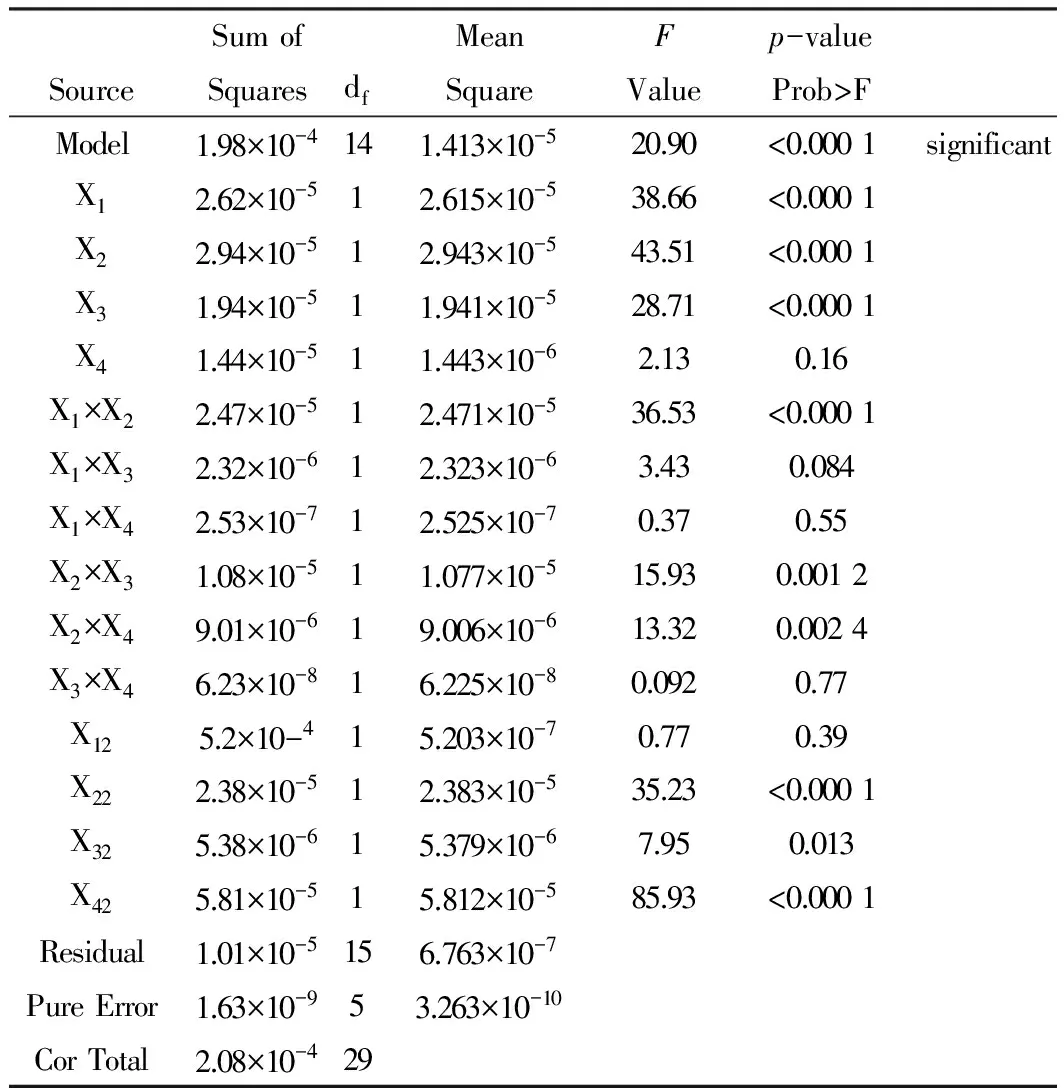
Tab.3 ANOVA for response surface quadratic model of Y2
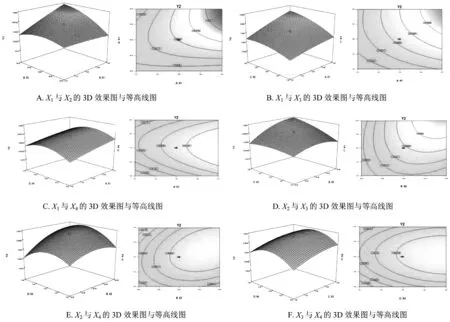
Fig.3 Contour plot and response surface of Y2 follows independent variables interaction for X1X2(A)、X1X3(B)、X1X4(C)、X2X3(D)、X2X4(E) and X3X4(F)
2.4.3 优化处方验证
本实验确定最佳处方条件为:当单硬脂酸甘油酯:大豆卵磷脂选择0.66(即单硬脂酸甘油酯:大豆卵磷脂=2:3),单硬脂酸甘油酯用量选择60 mg,B:S选择2.62, F-68用量选择0.31时,Y1(包封率)预测最大值为0.499 9,Y2(载药量)预测最大值为0.010 5。
依据最优工艺与处方条件制备三批样品,比较实测值与预测值的相对偏差,评价模型方程的可靠性。各批次样品的总包封率及总载药量的实测值和预测值见Tab.4,PS、ZP、PDI、EE及DL的指标结果见Tab.5。

Tab.4 The compare of the predicted and obserbed responses(n=3)
注:相对偏差=(预测值-实测值)/预测值×100%
由Tab.5中数据可知,实测值与预测值之间的偏差率较小,各项指标偏差均小于±5%,说明优化后的处方验证试验的预测值和实测值基本相吻合,星点设计-效应面法的预测效果良好,可以描述效应面和影响因素之间的关系。
由Tab.5及Fig.4所示,优化后工艺制备的三批样品外观为淡蓝色乳光的液体,批间的各项指标变化差异小,重现性良好。

Tab.5 The verification results(n=3)

Fig.4 The picture of PS, ZP andappearance(from left to right: PS, ZP and appearance)
3 讨论
3.1 制备方法
本实验在载药纳米粒制备方法考察时,考察了沉淀法、乳化蒸发法、复乳法,传统的沉淀法制备的纳米粒包封率和载药量不高且粒径超过200 nm,可能是由于在乳化的过程中,水溶性药物易从油相中脱离,并从粒子内部不断扩散进水相,这不仅降低药物的包封率,而且很有可能因为扩散后形成的孔道,造成药物释放过程中的“突释”现象。为了提高水溶性药物的包封率及载药量,本实验尝试使用复乳法,包封率及粒径均不及乳化蒸发法,每批产品波动较大,与文献报道的此法影响因素较多、对实验条件及操作人员操作要求高相符。乳化蒸发法制备的纳米粒溶液,外观呈淡蓝色乳光,粒径小于120 nm,分布较窄,Zeta电位绝对值较大,包封率和载药量较高,TEM观察纳米粒大小均匀圆球形,该方法操作简单,故确定用乳化蒸发法制备纳米粒。
3.2 稳定剂的选择
脂质体纳米粒具有颗粒细小的特点,比表面积巨大而极易聚集或成团从而导致体系稳定性降低。因此,制备时需要加入稳定剂来抑制纳米粒的聚集,并增加体系的粘度,以减缓其沉降速率,同时稳定剂需具备低毒、安全等特点。故本研究选择F-68为稳定剂。
3.3 包合材料的选择
在包载药物的过程中,B和S两个成分之间存在竞争关系。在有限的载体材料中,包载药物的能力也是有限的,故改变药物用量及二者比例时,对两个成分的包封率及载药量均有影响。在星点考察或单因素考察的实验过程中,会有士的宁的包封率高于马钱子碱的情况,但总包封率比较高(总包封率30%以上)的样品中,马钱子碱均为投药量高于士的宁;且在总包封率相对较高的样品当中,马钱子碱的包封率总是大于士的宁的包封率。因此,通过前面的实验可以总结出,在投药时采用马钱子碱高于士的宁投药量的方式。主要原因可能是由于马钱子碱结构与士的宁比较,差别只在结构式上引入了两个甲氧基,因此马钱子碱的极性要小于士的宁,在所选用的载体材料单硬脂酸甘油酯为脂溶性成分时,马钱子碱与其亲和性较大,因此才体现出马钱子碱比例高有利于提高总包封率的情况。
[1] 南京中医药大学.中药大辞典[M]上海:上海科学技术出版社,2012:348-351.
[2] 魏宁,张松伟.马钱子的研究进展[J].航空军医,2004,32(3):131-134.
[3] 张卫清,夏俐俐.马钱子使用体会[J].浙江中西医结合杂志,2000,10(6):373.
[4] 于智敏,王克林,李海玉,等.常用有毒中药的毒性分析与配伍宜忌[M].北京:科学技术文献出版社,2005:59.
[5] 陈海英,陆红.马钱子治疗风湿性关节炎研究进展[J].中国中医药科技,2000,10(6):373-375.
[6] MEHNERT W,MADER K.Solid lipid nanoparticles:production characterization and applications[J].AdvDrugDelRev,2006,47(2-3):165.
[7] JORES K,HABERLAND A,WARTEWIG S,et al.Solid lipid nanopartielesandoil-loaded SLN studied by spectrofluorometry and Ramanspectroscopy[J].Pharm Res,2005,22(11):1887.

