变应性肉芽肿性血管炎14例临床表现及周围神经损害
赵海燕, 刘向一, 孙阿萍, 张 朔, 樊东升
变应性肉芽肿性血管炎(Eosinophilic Granulomatosis with Polyangiitis)是主要累及中小动脉的一种血管炎,主要表现为哮喘、外周血嗜酸性粒细胞增多及系统性血管炎[1],1951年Churg和Strauss首次描述该病,故将其命名为Churg-Strauss综合征(CSS),又称嗜酸性肉芽肿性血管炎[2]。CSS可以累及周围神经,但关于周围神经损伤的文献并不多[3~7]。CSS是一种少见的血管炎,普通人群中年发病率为2.413/100万[8]。由于CSS发病率低以及临床表现的多样性,因此诊断非常困难。本研究收集自2005年1月~2016年12月在北京大学第三医院收治的14例CSS患者的临床资料,回顾性分析其临床表现及周围神经受损的情况,以提高临床诊治水平。
1 对象与方法
1.1 研究对象 收集2005年1月1日~2016年12月31日在北京大学第三医院就诊的符合1990年美国风湿协会(ACR)提出的CSS诊断标准[9]的患者14例,男性10例(71.4%),女性4例(28.6%),年龄20~78岁(53.6±16.2)。
1990年美国风湿协会提出的CSS分类诊断标准[9]:(1)哮喘;(2)外周血嗜酸性粒细胞增高>10%;(3)单发性或多发性周围神经炎;(4)一过性或游走性肺内阴影;(5)鼻窦炎;(6)血管外嗜酸性细胞浸润。符合4条及以上可诊断为CSS。其敏感性85%,特异性99.7%。
1.2 研究方法
1.2.1 临床资料收集 收集14例CSS患者的临床资料,包括起病年龄、诊断年龄、性别、临床表现、化验检查结果、神经活检结果、用药情况及疗效。其中化验结果包括红细胞沉降率(ESR)、白细胞计数(WBC)、嗜酸性粒细胞计数(EO)、嗜酸性粒细胞百分比(EO%)、抗中性粒细胞胞浆抗体(ANCA)及免疫球蛋白E(Ig E)检查结果包括心电图、超声心动图、胸部X平片、胸部CT、肌电图、下肢静脉彩超及鼻窦CT。
1.2.2 病理检查方法 神经标本均进行了光镜和电镜检查,分别进行了苏木精.伊红染色(HE染色)及免疫组化染色,包括神经丝(NF)、髓鞘碱性蛋白(MBP)、外周髓鞘蛋白22(PMP22),以及半薄切片甲苯胺蓝染色,超薄切片铅铀染色。
2 结 果
2.1 CSS患者的临床表现 14例CSS患者基本资料见表1。患者平均起病年龄51.2岁(19~75岁);诊断CSS平均年龄为53.6岁(20~78岁);起病至诊断间隔平均15.9 m(1~72 m)。男性10例(71.4%),其中4例(40%)累及周围神经;女性4例(28.6%),其中2例(50%)出现周围神经损害。10例(71.4%)患者签署知情同意书后完善活检(包括皮肤、神经、肺及消化道)。9例(64.3%)CSS在确诊前存在误诊,误诊疾病包括咽喉炎、肺癌、肺结核、急性胃肠炎等。

表1 14例变应性肉芽肿性血管炎患者临床基本资料
数值,平均值(范围)或百分比;ACR,美国风湿协会;Ig E,免疫球蛋白E;ESR,红细胞沉降率;ANCA,抗中性粒细胞胞浆抗体。
所有患者均符合1990年美国风湿协会提出的CSS分类标准[9]4条及以上,其中2例符合6条标准(14.3%),3例符合5条标准(21.4%),其余9例符合4条标准(64.3%)。在6条美国风湿协会提出的CSS分类标准中,外周血嗜酸性粒细胞升高是最常见(100%),其次是游走性肺内阴影(85.7%)、血管外嗜酸性粒细胞浸润(71.4%)、哮喘(64.3%)、副鼻窦炎(64.3%)及周围神经病(42.9%)。
9例患者伴有哮喘,哮喘发生距离诊断CSS的平均间隔时间为8.3 y(0~20 y),仅1例患者在CSS同时发现哮喘,其余8例患者哮喘发生均早于CSS诊断。
2.2 CSS患者器官受累情况 14例CSS患者器官受累情况见表2。呼吸系统是最常受累的器官(100%),包括9例(64.3%)哮喘,9例(64.3%)鼻窦炎,12例(85.7%)肺部病变;其次为消化道及全身非特异症状(85.7%),消化道受累表现包括3例(21.4%)腹痛,4例(28.6%)腹泻及10例(71.5%)食欲下降,而全身非特异症状10例,其中2例(14.3%)乏力,3例(21.4%)体温升高,11例(78.6%)体重下降(0~15 kg);6例(42.9%)周围神经受累,表现为单下肢、双下肢、双手或四肢末梢麻木、无力、疼痛,无中枢神经系统受累,所有患者均未出现中枢神经系统受累;4例(28.6%)皮肤受累,均为荨麻疹;4例(28.6%)心脏受累,其中2例(14.3%)心包积液,1例(7.1%)局灶室壁运动障碍,1例(7.1%)心脏舒张功能障碍,1例(7.1%)心功能衰竭;肾脏受累患者仅3例(21.6%),2例(14.3%)蛋白尿,3例(21.4%)血尿。
2.3 化验结果 所有患者完善血常规化验,白细胞计数平均值为10.3×109/L[(5.0~26.3)×109/L,参考值(4.0~10.0)×109/L],嗜酸性粒细胞计数平均值2.3×109/L[(0.5~7.4)×109/L,参考值(0.02~0.52)×109/L],嗜酸性粒细胞平均升高20.7%,(10.3~55%,参考范围0~8.0%),14例嗜酸性粒细胞比例均>10%(100%)。12例完善ESR化验,平均值为41.2 mm/h(8~94 mm/h,参考值0~20 mm/h),其中7例(58.3%)升高。11例完善Ig E化验,平均值为1234.8 IU/ml(131~2500 IU/ml,参考值0~100 IU/ml),其中10例(91.0%)升高。14例CSS患者均完善ANCA化验,5例(35.7%)ANCA(+)患者中有2例(40.0%)存在周围神经损伤,ANCA(-)的9例患者中4例(44.4%)存在周围神经损伤。
2.4 神经电生理检查及神经病理结果 6例周围神经受损的CSS患者均完善四肢神经传导速度检查。电生理结果提示不对称性多发性单神经病,2例(33.3%)上下肢周围神经同时受损,4例(66.7%)仅累及下肢周围神经,而上肢神经传导速度及波幅均无异常。感觉神经纤维与运动神经纤维均受累,均出现波幅下降,但神经传导速度基本正常,提示以轴索损害为主。
3例周围神经受损的CSS患者行腓肠神经活检(见图1)。3例患者有髓及无髓纤维数量呈轻-中度减少,大直径厚髓纤维重度减少,几乎未见再生薄髓纤维,残存有髓纤维呈脱髓鞘改变伴施万细胞变性及吞噬现象;无髓纤维轻度增生,其内轴索萎缩变细,施万细胞轻度增生,但未见洋葱头样结构形成;间质有增生,可见多量单核淋巴细胞浸润神经束内小血管壁、神经纤维周围及神经束膜内小血管周围,其中2例可见少量嗜酸性粒细胞浸润,免疫组化提示炎症细胞以CD3阳性T淋巴细胞为主,偶见CD20阳性B淋巴细胞浸润小血管壁周围。
2.5 治疗及转归 所有患者均接受糖皮质激素治疗,8例疗效欠佳的患者联合环磷酰胺治疗。经治疗其嗜酸性粒细胞比例、ESR、Ig E降至正常范围,脏器受累表现减轻或消失,周围神经受累症状(麻木、疼痛、无力)改善。
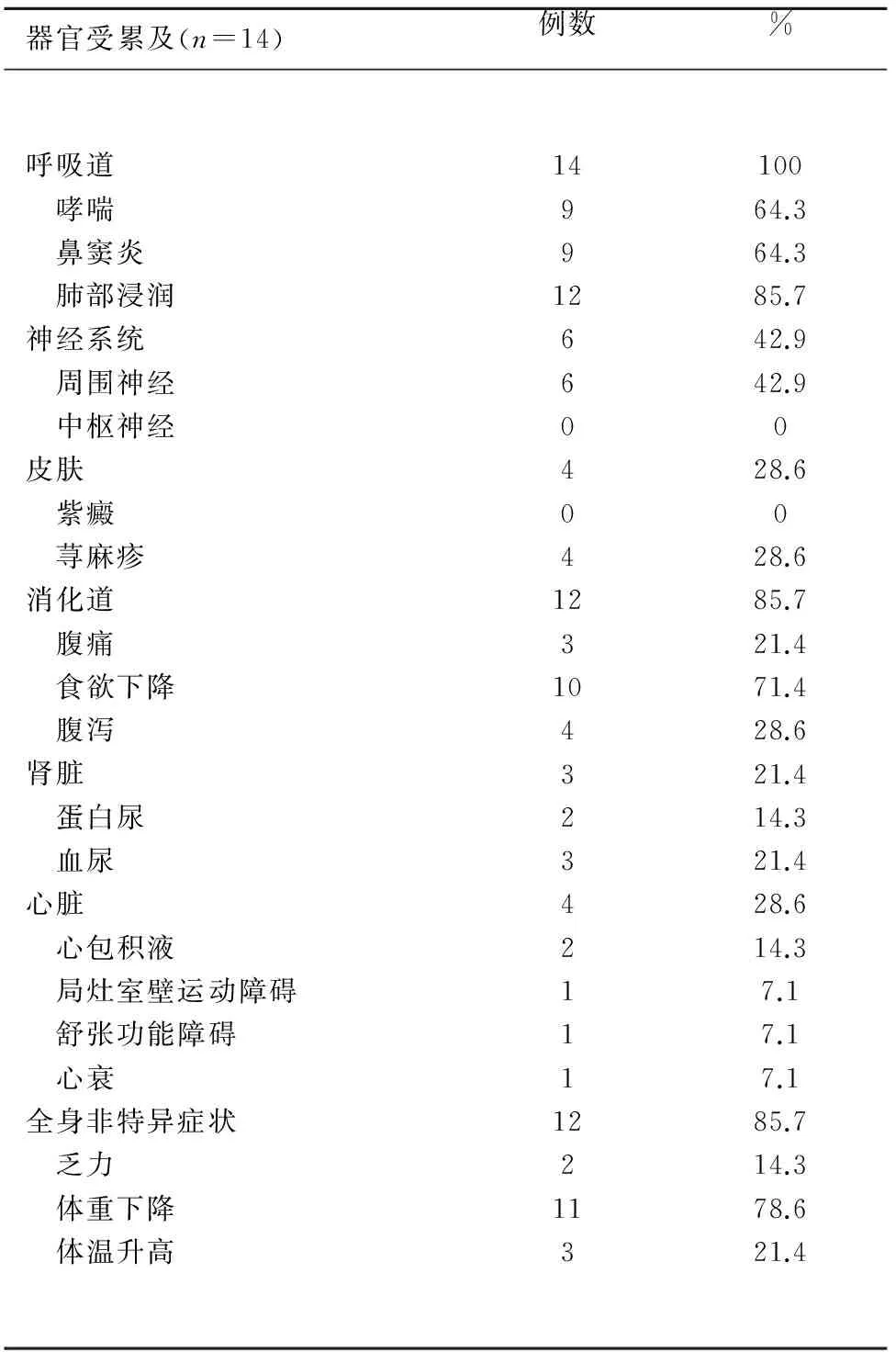
表2 变应性肉芽肿性血管炎各脏器受累及情况
3 讨 论
CSS的起病年龄为(7~74)岁不等,起病平均年龄为(38~54)岁,本研究中,14例CSS患者平均起病年龄51.2岁,与文献结果一致[1]。Greco等报道CSS发病无性别差异[1],Comarmond等发现383例CSS患者中男性较女性稍多(199:184)[10],而Cho等报道的61例CSS患者中女性较男性稍多(33∶28)[4],国内宋丽等报道的30例CSS患者性别差异也不明显(男:女=16:14)[11],而本研究中男性患者较女性多(10:4),因此,本研究中性别偏差可能与病例数较少有关。
哮喘出现于CSS的第一阶段,发生率在78.8%~100%[1,10,12],本研究中CSS患者哮喘发生率为64.3%,低于文献报道。Kim等报道了52例CSS患者,其中伴有哮喘的41例患者,其哮喘发生一般早于CSS诊断,平均2 y(0~17 y),其中6例在诊断CSS同时发现哮喘[12]。本研究中9例患者伴有哮喘,哮喘发生距离诊断CSS的平均间隔时间为8.3 y(0~20 y),仅1例患者在CSS同时发现哮喘。哮喘发生距离CSS诊断时间较文献研究间隔时间长,不除外国内诊断延误的可能性。
本研究中14例CSS患者,其中周围神经病变患者6例(42.9%),Cho等报道61例患者中有46例(75.4%)存在周围神经损害[4],Samson等发现118例CSS患者中87例(73.7%)周围神经受累[13],而Comarmond等随访了383例CSS患者,发现51.4%累及周围神经[10],因此,本研究中CSS患者周围神经病变的发生率较文献报道发生率低[4,10,13],可能与部分患者神经系统表现不显著,未完善神经系统查体及电生理检查有关,建议对于CSS患者均完善电生理检查,明确周围神经受损情况,避免漏诊。Cho等[4]报道的61例CSS患者,男女性出现周围神经病变比例无明显差异,本研究中女性患者中2例(50%)存在周围神经损伤,而男性患者4例(40%)存在周围神经病变,比例相当,与文献结果一致。
Greco等报道CSS的周围神经病变为多发性单神经炎,可同时累及感觉和运动神经纤维[1]。CSS相关的周围神经病多累及下肢[6,7],仅上肢周围神经受累的病例极少见[3],Kim等发现25例完善电生理检查的CSS患者,其中10例(40%)轴索损伤,9例(36%)感觉运动同时受累的多发性神经病。本研究中6例CSS患者出现不对称性多发性单神经病表现,6例患者均出现下肢神经受累,只有2例(33.3%)同时累及上肢周围神经,且电生理结果提示轴索损害明显,神经传导速度无明显变化,感觉与运动神经纤维均受损,这与文献结果一致[1,3,6,7]。
ANCA可能对于CSS的病理生理改变起到一定作用。有研究认为ANCA能激活中性粒细胞,后者又产生活性氧并释放溶酶体蛋白水解酶,包括中性粒细胞颗粒[14];其次,动物实验发现ANCA通过影响血管内皮细胞功能增加血管通透性[15]。Pagnoux等发现CSS患者中ANCA(+)约为38%~50%[16],本研究中,5例(35.7%)患者ANCA(+),与文献结果相似。ANCA(+)患者中有2例(40.0%)存在周围神经损伤,ANCA(-)的患者中4例(44.4%)存在周围神经损伤,两者比例接近。嗜酸性粒细胞浸润及ANCA诱导的内皮损伤可能是CSS最主要的发病机制[1]。本研究中所有患者均完善血常规化验,并且所有患者外周血嗜酸性粒细胞平均升高20.7%(10.3%~55%),而在腓肠神经活检可见多量单核淋巴细胞浸润神经束内小血管壁、神经纤维周围及神经束膜内小血管周围,部分患者可见少量嗜酸性粒细胞浸润。此外,本研究腓肠神经活检免疫组化结果提示小血管壁周围浸润的炎症细胞以CD3阳性T淋巴细胞为主,这也与文献认为 CSS是经典的辅助性T细胞介导的疾病吻合[1]。
本研究发现,CSS临床表现多样以及发病率低,容易误诊;存在嗜酸性粒细胞升高,且临床和电生理结果提示非对称性以轴索损害为主的周围神经病患者,需考虑CSS的可能性。该病对于糖皮质激素以及免疫抑制剂反应好,但神经病变恢复缓慢。因此,需加强对该病的认识,早期诊断,早期治疗。
[1] Noth I,Strek ME,Leff AR. Churg-Strauss syndrome[J]. Autoimmun Rev,2015,14(4):341-348.
[2] Churg J,Strauss L. Allergic granulomatosis,allergic angiitis,and periarteritis nodosa[J]. Am J Pathol,1951,27(2):277-301.
[3] Roh YH,Koh YD,Noh JH. Low median nerve palsy as initial manifestation of Churg-Strauss syndrome[J]. J Hand Surg Am,2017,42(6):478.
[4] Cho HJ,Yune S,Seok JM,et al. Clinical Characteristics and Treatment Response of Peripheral Neuropathy in the Presence of Eosinophilic Granulomatosis with Polyangiitis (Churg-Strauss Syndrome):Experience at a Single Tertiary Center[J]. J Clin Neurol,2017,13(1):77-83.
[5] Pati AR,Capecchi PL,Malandrini M,et al. Polyneuropathy with demyelinating changes in Churg-Strauss syndrome:an unusual association[J]. Neurol Sci,2017,38(4):695-697.
[6] Maramattom BV,Kachare N. Montelukast-associated Churg-Strauss syndrome with mononeuritis multiplex[J]. Ann Indian Acad Neurol,2015,18(3):357-358.
[7] Pandita KK,Bhat KJ,Razdan S. “Peripheral neuropathy crippling bronchial asthma”:two rare case reports of churg-strauss syndrome[J]. Case Rep Pulmonol,2014,2014:673906.
[8] Dunogue B,Pagnoux C,Guillevin L. Churg-strauss syndrome:clinical symptoms,complementary investigations,prognosis and outcome,and treatment[J]. Semin Respir Crit Care Med,2011,32(3):298-309.
[9] Masi AT,Hunder GG,Lie JT,et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis)[J]. Arthritis Rheum,1990,33(8):1094-1100.
[10] Comarmond C,Pagnoux C,Khellaf M,et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss):clinical characteristics and long-term followup of the 383 patients enrolled in the French Vasculitis Study Group cohort[J]. Arthritis Rheum,2013,65(1):270-281.
[11] 宋 丽,陈嘉林,陈 雨,等. 特发性嗜酸性粒细胞增多、变应性肉芽肿性血管炎、非霍奇金淋巴瘤合并嗜酸性粒细胞增多的临床热点比较[J]. 中华临床免疫和变态反应杂志,2012,6(4):285-289.
[12] Kim MY,Sohn KH,Song WJ,et al. Clinical features and prognostic factors of Churg-Strauss syndrome[J]. Korean J Intern Med,2014,29(1):85-95.
[13] Samson M,Puéchal X,Devilliers H,et al. Long-term outcomes of 118 patients with eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome) enrolled in two prospective trials[J]. J Autoimmun,2013,43:60-69.
[14] Falk RJ,Terrell RS,Charles LA,et al. Anti-neutrophil cytoplasmic autoantibodies induce neutrophils to degranulate and produce oxygen radicals in vitro[J]. Proc Natl Acad Sci USA,1990,87(11):4115-4119.
[15] Xiao H,Heeringa P,Hu P,et al. Antineutrophil cytoplasmic autoantibodies specific for myeloperoxidase cause glomerulonephritis and vasculitis in mice[J]. J Clin Invest,2002,110(7):955-963.
[16] Pagnoux C,Guilpain P,Guillevin L. Churg-Strauss syndrome[J]. Curr Opin Rheumatol,2007,19(1):25-32.

A:神经束膜内小血管周围炎性细胞浸润(HE×100);B:神经束膜内小血管内膜和肌层增厚,管腔闭塞(HE×100);C:神经纤维内轴索变性(NF染色×40);D:神经纤维内髓鞘脱失(MBP染色×40);E:神经束膜内小血管周围大量CD3+T淋巴细胞浸润(免疫组化×40);F:神经束膜内小血管周围偶见CD20+B淋巴细胞浸润(免疫组化×40)
图1 腓肠神经活检

