SB-271046对匹罗卡品致痫大鼠空间学习记忆的影响
黄明珠, 黄华品, 林婉挥, 陈圣根
癫痫患者合并认知功能障碍越来越得到人们的关注,不论是在临床研究还是动物模型研究中都有大量的报道[1,2]。目前研究表明5-HT与癫痫关系密切,其可能通过受体起作用。大量的研究表明5-HT6R拮抗剂可以改善认知功能[3,4],有些5-HT6R拮抗剂已经作为治疗阿尔茨海默病AD的药物[5]。然而这些相关研究大部分都是在痴呆模型上进行的,在癫痫模型上的学习记忆相关研究目前国内外较少报道。因此我们通过建立氯化锂-匹罗卡品慢性癫痫模型,然后侧脑室注射5-HT6R拮抗剂SB-271046(10 μg,20 μg),最后予Y迷宫、Morris水迷宫来检测SB-271046对癫痫大鼠学习记忆的影响,为临床上癫痫患者的学习记忆障碍的治疗提供新的思路。
1 材料与方法
1.1 化学药品及实验仪器 氯化锂(Sigma公司),匹罗卡品 (Sigma公司),10%羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrine,HP β CD)(溶解SB-271046用,Sigma公司),SB-271046(Tocris 公司),脑立体定位仪(Stoelting公司),Y迷宫、Morris 水迷宫系统(Smart-ma-ss,西班牙Panlab公司)。
1.2 实验动物分组 清洁级雄性SD成年大鼠,由中科院斯莱克实验动物有限公司提供,生产许可证号:SCXK(沪):2007-0005。大鼠体重200~250 g,10~13 w龄,12 h光照,12 h黑暗,自由摄取水和食物。动物房温度保持在22~26 ℃。实验动物按照随机法首先分为2组:空白对照组(Vehicle)10只,匹罗卡品组(PILO)40只;然后根据腹腔注射PILO后是否出现Ⅳ级及Ⅳ级以上发作(Racine分级),未达到者予以剔除,达到者纳入实验;4 w后再将存活的PILO组按照随机数字表分为:模型组(HP-CD)即侧脑室注射HP-β-CD4 μl组;10 μg-SB组即侧脑室注射SB-271047剂量为10 μg,4 μl;20 μg-SB组即侧脑室注射SB-271046剂量为20 μg,4 μl。
1.3 LiCl-PILO癫痫动物模型建立 于腹腔注射氯化锂(LiCl)127 mg/kg,16~18 h后腹腔注射PILO 30 mg/kg,在给药PILO前30 min,腹腔注射阿托品1 mg/kg,以缓解PILO的外周胆碱能效应。连续观察30 min,根据Racine分级,发作级数达到Ⅳ级及Ⅳ级以上并持续30 min以上的即造模成功。不成功者按照原剂量每30 min追加1次,追加3次仍不成功者,剔除。造模成功的大鼠60 min后,予以地西泮10 mg/kg解痉,解痉效果不佳者按原剂量每60 min追加一次。存活大鼠腹腔注射平衡葡萄糖盐水5 ml/只,2次/d,连续3 d,同时予以流质饮食。
1.4 侧脑室注射5-HT6R拮抗剂SB-271046 大鼠造模成功后4 w,予10%水合氯醛深度麻醉,在脑立体定位仪帮助下,按照 Watson《大鼠脑立体定位图谱》,侧脑室(前囟后0.8 mm,旁开1.5 mm,深度4 mm)注射药物。HP-CD组注入10% HP-β-CD 4 μl;10 μg-SB组注入SB-271046,2.5 μg/ μl,4 μl;20 μg-SB组注入SB-271046,5 μg/μl,4 μl[6]。注射时间维持4 min,速度1 μl/min。手术后恢复1 w。
1.5 Y迷宫、Morris水迷宫测评 造模成功后6 w进行Y迷宫、Morris水迷宫实验,检测大鼠空间学习记忆。
Y迷宫装置是由3个等长的黑色臂和一个中间区域组成,各臂互成120°。臂长50 cm,宽10 cm,高20 cm,支架高50 cm。动物放入后,采用SMART-ma-ss软件采集图像和分析数据。Y迷宫为时2 d,方法学按Robert[7],Dellu等[8]的描述。1 d为自主交替实验,每只大鼠从同一个臂即起始臂放入,连续自主交替8 min,检测自主交替自主交替率。每只大鼠结束后放回笼子,在进行下一只实验时,用75%的酒精消除Y迷宫臂内的气味。交替率%=交替次数/(总次数-2)%。 2 d为新奇事物探索实验,采用4 h间隔,先随机封闭一个臂,让大鼠在剩余的两个臂中自由探索10 min,4 h后打开挡板,每只大鼠自由探索5 min,记录大鼠进入各臂的次数和时间,尤其是新臂的次数和时间。每只大鼠结束后放回笼子,进行下一只前同样用75%酒精消除气味影响。
Y迷宫实验结束后2 d进行Morris水迷宫实验。水迷宫方法学按照Charles等[9]描述的方法。实验总共历行6 d。1~5 d为定位航行实验,每只大鼠每天进行4个象限,记录在120 s内找到平台的时间(逃避潜伏期)、速度、路程等;6 d撤离平台,记录大鼠120 s内在目标象限(原平台所在象限)停留的时间、穿越平台(原平台所在位置)次数等。
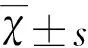
2 结 果
2.1 实验大鼠存活 Vehicle组10只大鼠全部存活。造模组40只大鼠,注射PILO后成功出现Ⅳ级及Ⅳ级以上并持续30 min的有34只,6只再追加3次后仍失败,剔除。成功率为85%。由于急性期大鼠易死亡,但2 w后大鼠基本稳定,死亡率大大下降,故在2 w后统计成功SE的大鼠,存活24只,死亡10只,死亡率29.4%。4 w后进行侧脑室给药,至6 w后行为学实验时,HP-CD组、10 μg-SB组和20 μg-SB组各死亡2只。故最后行为学的大鼠共28只,Vehicle组10只,HP-CD组6只,10 μg-SB组6只,20 μg-SB组6只。
2.2 Y迷宫测评
2.2.1 Y迷宫自主交替行为实验,检测在8 min内各组大鼠的自发性交替率。
在Y迷宫SAB中,4组的自主交替率有差别(P<0.001,ANOVA,F(3,27)=12.048,P=0.000,见图1及表1);与Vehicle相比,P(HP-CD)=0.000,P(10 μg-SB)=0.004;与HP-CD相比,P(20 μg-SB)=0.018;余两两比较,按照α=0.05水平,均未达统计学意义。可见,HP-CD组其自主交替率明显下降(P<0.001),药物组自主替率提高尤其是20 μg剂量(P<0.05),提示可能具有剂量依赖性。
2.2.2 Y迷宫新奇事物探索实验,检测各组大鼠在各臂的时间,尤其是新臂的时间。
在Y迷宫NOD中,各组内3个臂时间比有差别。在Vehicle组,3个臂时间比有差别(P<0.01,ANOVA,F(2,29)=5.835,P=0.008,见图2);与新臂相比,有差别P(Start)=0.015,余两两比较无差别(P>0.05)。在HP-CD组,3个臂时间比也有差别(P<0.01,ANOVA,F(2,17)=7.116,P=0.007,见图2及表1),与新臂相比,有差别P(Open)=0.006,余两两比较无差别(P>0.05)。药物组各臂时间比差别不明显(P>0.05,ANOVA,F10 μg-SB(2,17)=0.21,P10 μg-SB=0.813;F20 μg-SB(2,17)=0.378,P20 μg-SB=0.691。见图2)。各组新臂时间比有差别(P<0.05,ANOVA,FNew(3,27)=3.595,PNew=0.028,见图2);与Vehicle组相比,HP-CD组其新臂时间比显著下降(P<0.01,P(HP-CD)=0.019,余两两比较均无差别(P>0.05)。大鼠各臂的时间比和随机概率33.33%比较,采用t检验。各组新臂和33.33%比较,结果如下:t(Vehicle,9)=2.086,P(Vehicle)=0.067;t(HP-CD,5)=-3.069,P(HP-CD)=0.028,t(10 μg-SB,5)=-0.117,P(10 μg-SB)=0.912;t(20 μg-SB,5)=1.175,P(20 μg-SB)=0.293。可见,各组组内的新臂时间比较,Vehicle组其新臂时间明显延长,而HP-CD组新臂时间明显缩短,而且明显低于33.33%的随机概率(P<0.05),尽管药物组未达统计学意义,但20 μg组其新臂时间是延长的,而且高于随机概率,各组间新臂时间比较,HP-CD也是明显下降的,而药物组提高未达统计学意义。
2.3 Morris水迷宫测评
2.3.1 Morris水迷宫定位航行实验中,连续进行5 d,测定大鼠空间学习记忆的获取阶段的学习能力,主要测定大鼠找到隐蔽平台的潜伏期。
在1 d的实验中,各组的平均潜伏期有差别(P<0.001,ANOVA,F(3,15)=15.478,P=0.000,见图3)。与Vehicle相比,P(HP-CD)=0.001,P(10 μg-SB)=0.000;与HP-CD相比,P(20 μg-SB)=0.032;与10 μg-SB组相比,P=0.011,余两两比较无差别(P>0.05)。可见,HP-CD,10 μg-SB其平均潜伏期较正常组明显延长,与HP-CD相比,药物组平均潜伏期明显缩短,尤其是20 μg-SB组,而且两个药物组比较,有差别(P<0.05),提示可能具有剂量依赖性。

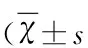

图2 SB-271046对大鼠Y迷宫新奇事物探索实验的影响(各组新臂 vs 起始臂及开放臂:*P<0.05,**P<0.01;模型组新臂 vs 空白组新臂:#P<0.01)

图3 SB-271046 对大鼠在水迷宫定位航行实验1 d到达平台潜伏期的影响(空白组 vs 模型组、10 μg药物组、20 μg药物组比较:***P<0.001;20 μg药物组 vs 模型组及10 μg药物组,﹟P<0.05)

4组5 d的平均潜伏期也是有差别的(P<0.01,Welch,F(3,8.576)=11.896,P=0.002,见图4);与Vehicle组相比,P(HP-CD)=0.004,P(10 μg-SB)=0.025;与HP-CD组相比,P(20 μg-SB)=0.036;余两两比较无差别(P>0.05)。可见,HP-CD组和10 μg-SB组平均潜伏期较正常组明显延长,而尤其是前者(P<0.01);同时与HP-CD相比,药物组则明显缩短,尤其是20 μg-SB(P<0.05)。
2.3.2 Morris水迷宫探索性试验,检测大鼠学习记忆的维持阶段的再现能力。
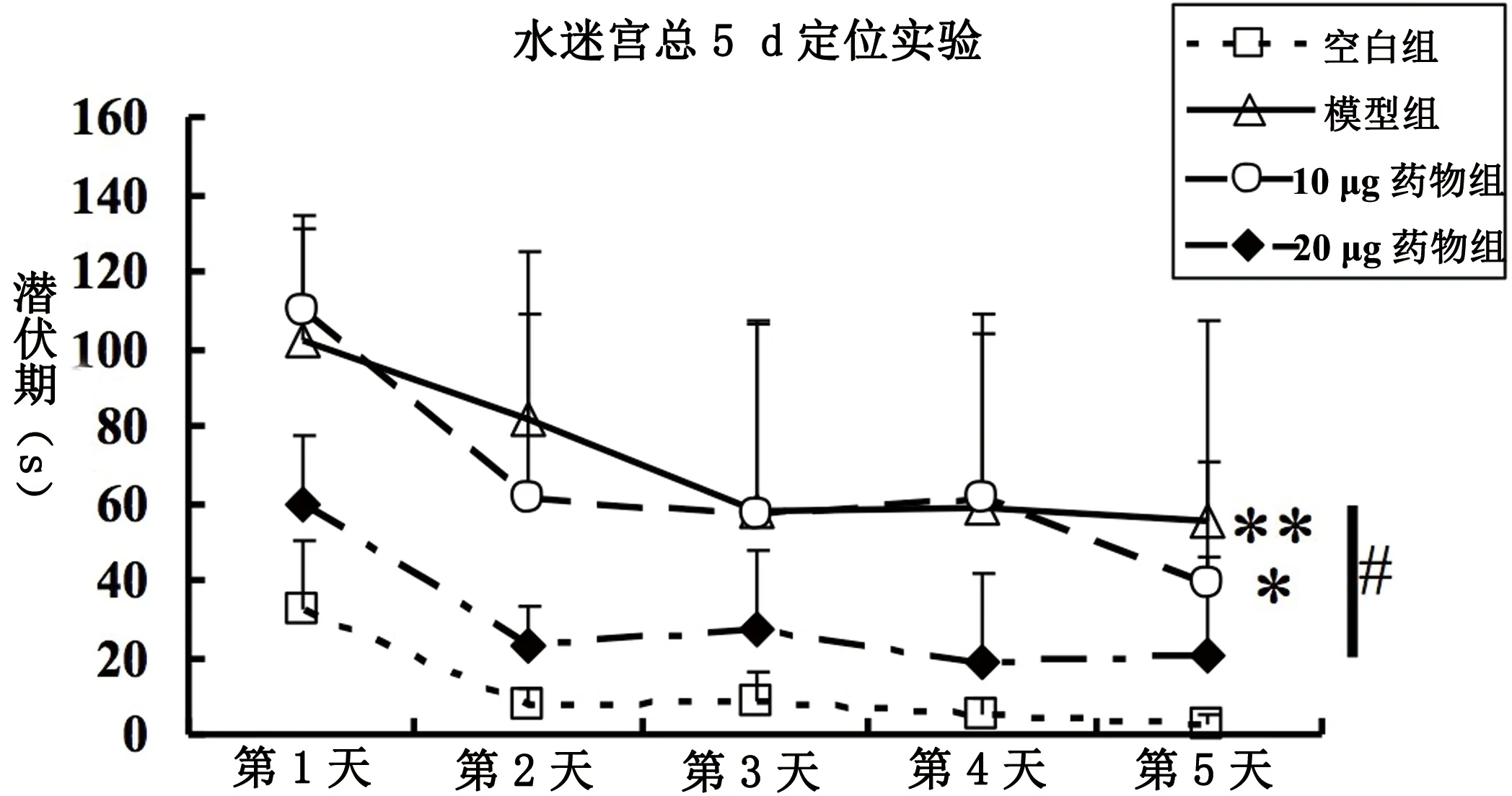
图4 SB-271046对大鼠在水迷宫总5 d定位航行实验到达平台潜伏期的影响(空白组 vs 模型组、10 μg药物组、20 μg药物组:*P<0.05,**为P<0.01;模型组 vs 20 μg药物组:#P<0.05)

图5 SB-271046对大鼠在水迷宫空间探索实验到达平台潜伏期的影响(空白组 vs 模型组、10 μg药物组、20 μg药物组:**P<0.01)

图6 SB-271046对大鼠在水迷宫空间探索实验穿越平台次数的影响(空白组 vs 模型组、10 μg药物组、20 μg药物组:*P<0.05)

图7 SB-271046对大鼠在水迷宫空间探索实验靶象限停留时间比的影响 (空白组 vs 模型组、10 μg药物组、20 μg药物组:*P<0.05)
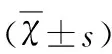
表1 SB-271046对大鼠Y迷宫自主交替率及新奇事物探索行为的影响
空白组 vs 模型组、10 μg药物组、20 μg药物组:*P<0.05,**P<0.01,***P<0.001;模型组 vs 20 μg药物组、空白组:#P<0.05
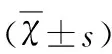
表2 SB-271046对大鼠水迷宫探索实验的影响
空白组 vs 模型组、10 μg药物组、20 μg药物组:*P<0.05,**P<0.01
3 讨 论
临床上癫痫患者的记忆损害的类型多样,如言语性记忆,片段性记忆,空间记忆等;同样,在PILO癫痫动物模型上也有类似发现[2]。研究表明Y迷宫自主交替实验可以检测动物空间工作记忆,Y迷宫新奇事物探索的场地再认实验可检测片段式记忆[3],水迷宫实验可检测空间参照记忆和空间工作记忆。因此本实验建立LiCl-PILO癫痫模型,采用Y迷宫和水迷宫来研究癫痫大鼠的学习记忆是合理的。在连续8 min的Y迷宫SAB中,HP-CD组其自主交替率显著下降,提示其学习记忆能力的严重受损,可见癫痫大鼠其学习能力下降,这与临床上癫痫患者空间学习记忆和短时记忆受损表现[10]是一致的;药物组提高,尤其是20 μg剂量,提示药物具有改善癫痫大鼠学习记忆的能力。在Y迷宫新奇事物探索4 h间隔的实验中,在 Vehicle组其新臂时间明显延长,而且大于随机概率33.33%,提示其学习提取再现能力是正常的;而HP-CD组却明显缩短,并且与随机交替率33.33%相比,明显下降(P<0.05),表现出不能识别新臂,提示其学习记忆的提取再现能力严重受损。4组的新臂时间比较,发现HP-CD组明显下降为26.15%,可见癫痫大鼠空间记忆能力受损,尤其是记忆提取再现过程受损;而药物组新臂时间是延长的,尽管未达统计学意义,这可能提示5-HT6受体拮抗主要作用于记忆的获得阶段而非提取再现阶段。这与Costa等[3]的结果一致。他们发现5-HT6R拮抗剂可以改善年轻成年鼠的记忆获得巩固阶段,并可逆转老年鼠因年老而造成的记忆巩固能力的缺陷。
在Morris水迷宫定位航行实验中,大鼠在每天4次的实验中,几乎都是第1次的潜伏期最长,而后逐渐缩短,而且随着天数增加,每天的平均潜伏期也是不断缩短的,尤其是Vehicle组和20 μg-SB组,其5 d的平均潜伏期明显缩短(P<0.05)。这就提示了Vehicle组和药物20 μg组的大鼠其学习记忆能力是良好的,能形成对平台位置的长期记忆并能提取储存的空间记忆。HP-CD组的大鼠在2 d~5 d的试验中,其每天4次的试验的潜伏期无明显的变化,并且5 d平均潜伏期改变未达统计学意义,这就提示了HP-CD组大鼠对平台位置不能形成长期记忆或者提取存储的空间记忆受损。10 μg-SB组 5 d的平均潜伏期也是逐渐缩短的,尽管未达统计学意义,提示其改善作用不明显。总体上,HP-CD 5 d的平均潜伏相对正常组是延长的,而药物组可以改善其表现,尤其是20 μg剂量组(P<0.05),提示可能存在剂量依赖性。这与Foley等[11]的结果一致,他们发现SB-271046可以改善大鼠在Morris水迷宫的表现,可改善空间记忆的获得阶段。Morris水迷宫6 d的空间探索实验中,HP-CD组其潜伏期明显延长,穿越平台次数明显减少,在原平台象限停留时间明显减少,表明了其学习记忆提取再现能力的受损,与Inostroza等[2]的结果一致,他们发现LiCl-PILO癫痫模型的大鼠在空间学习记忆的获得和维持能力明显受损。药物组尽管还尚达到统计学意义,但具有明显改善的趋势,提示药物在记忆提取再现阶段的作用不强,与King等[12]结果大体一致。他们发现不论急性还是慢性给药R0-046790还是SB-271046(10 mg/kg)均能改善大鼠的记忆巩固存储阶段,而不作用于记忆编码和提取过程。
5-HT6R拮抗剂改善学习记忆的机制还尚不明确。Mitchell等[13]采用基因转染技术,发现5-HT6R在纹状体过度表达会损害记忆;Marcos等[14]在大鼠水迷宫实验,发现给药SB-271046组的5-HT6R的表达及其mRNA表达均下降;因此推测5-HT6R过表达损害记忆,而5-HT6R拮抗剂可抑制5-HT6R受体的活性,从而改善记忆,并且他们认为5-HT6受体拮抗剂介导的认知增强效应是通过磷酸化细胞外信号调节激酶1/2(pERK1/2)。而且磷酸化的p-ERK1/2通过活化转录因子c-fos在突触重组中发挥重要作用[15]。王亮等[16]发现5-HT6R受体在人及匹罗卡品癫痫模型小鼠的表达上调,5-HT6R受体拮抗剂可以抑制癫痫发作及mTOR的活性,在改善癫痫发作及阻断HTR6/mTOR信号通路具有重要作用。我们课题组林婉挥等[17]发现5-HT6受体通过激活p-ERK1/2及Fyn信号通路从而影响苔藓纤维出芽的形成,而成进一步调节GAP-43的表达,发挥改善学习记忆等作用。
综上,我们的实验结论是5-HT6R拮抗剂SB-27046可以改善癫痫大鼠的学习记忆障碍,尤其是作用于记忆获得巩固阶段,可能具有一定的剂量依赖性,其改善学习记忆的作用机制目前国内外包括我们课题组正在进行研究,如我们正在进一步深入研究5-HTR6受体介导mTOR通路在慢性颞叶癫痫模型的学习记忆等相关方面的分子学机制,为临床上癫痫合并认知功能障碍的患者的治疗提供新思路。
[1]赵 爽,张胜昌. 癫痫伴记忆认知损伤与突触可塑性的关系[J]. 中国老年学,2017,37(15):3885-3887.
[2]Inostroza M,Cid E,Brotons-Mas J,et al. Hippocampal-dependent spatial memory in the water maze is preserved in an experimental model of temporal lobe epilepsy in rats[J]. Plos One,2011,6(7):e22372.
[3]Costa VDS,Duchatelle P,Boulouard M,et al. Selective 5-HT6 receptor blockade improves spatial recognition memory and reverses age-related deficits in spatial recognition memory in the mouse[J]. Neuropsychopharmacology:Official Publication of the American College of Neuropsychopharmacology,2009,34(2):488-500.
[4]Amat-Foraster M,Leiser SC,Herrik KF,et al. The 5-HT6 receptor antagonist idalopirdine potentiates the effects of donepezil on gamma oscillations in the frontal cortex of anesthetized and awake rats without affecting sleep-wake architecture[J]. Neuropharmacology,2016,113(Pt A):45-59.
[5]Calhoun A,Ko J,Grossberg GT. Emerging chemical therapies targeting 5-hydroxytryptamine in the treatment of Alzheimer’s disease[J]. Expert Opin Emerg Drugs,2017,22(1):101-105.
[6]Loiseau F,Dekeyne A,Millan MJ. Pro-cognitive effects of 5-HT6 receptor antagonists in the social recognition procedure in rats:implication of the frontal cortex[J]. Psychopharmacology,2008,196(1):93-104.
[7]Hughes RN. The value of spontaneous alternation behavior (SAB) as a test of retention in pharmacological investigations of memory[J]. Neurosci Biobehav Rev,2004,28(5):497-505.
[8]Dellu F,Contarino A,Simon H,et al. Genetic differences in response to novelty and spatial memory using a two-trial recognition task in mice[J]. Neurobiol Learn Mem,2000,73(1):31-48.
[9]Vorhees CV,Williams MT. Morris water maze:procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc,2006,1(2):848-858.
[10]Cánovas R,León I,Serrano P,et al. Spatial navigation impairment in patients with refractory temporal lobe epilepsy:evidence from a new virtual reality-based task[J]. Epilepsy Behav,2011,22(2):364-369.
[11]Foley AG,Murphy KJ,Hirst WD,et al. The 5-HT(6) receptor antagonist SB-271046 reverses scopolamine-disrupted consolidation of a passive avoidance task and ameliorates spatial task deficits in aged rats[J]. Neuropsychopharmacology:Official Publication of the American College of Neuropsychopharmacology,2004,29(1):93-100.
[12]King MV,Sleight AJ,Woolley ML,et al. 5-HT 6,receptor antagonists reverse delay-dependent deficits in novel object discrimination by enhancing consolidation-an effect sensitive to NMDA receptor antagonism[J]. Neuropharmacology,2004,47(2):195-204.
[13]Mitchell ES,Sexton T,Neumaier JF. Increased Expression of 5-HT6 Receptors in the Rat Dorsomedial Striatum Impairs Instrumental Learning[J]. Neuropsychopharmacology,2007,32(7):1520-1530.
[14]Marcos B,Cabero M,Solas M,et al. Signalling pathways associated with 5-HT6 receptors:relevance for cognitive effects[J]. Int J Neuropsychopharmacol,2010,13(6):775-784.
[15]Xu ZC,Chen YM,Xu P,et al. Epileptiform discharge upregulates p-ERK1/2,growth-associated protein 43 and synaptophysin in cultured rat hippocampal neurons[J]. Seizure,2009,18(10):680-685.
[16]Wang L,Lv Y,Wang X,et al. 5-HT6 receptors recruitment of mTOR modulates sezure activity in epilesy[J]. Mol Neuobiol,2015,51(3):1292-1299.
[17]Lin W,Huang W,Huang H,et al. The role of 5-HT6R in mossy fiber sprouting:activating Fyn and p-ERK1/2 in pilocarpin-induced chronic epileptic rats[J]. Cell Physiol Biochem,2017,42(1):231-241.

