幽门螺杆菌感染和胃泌素与结直肠腺瘤性息肉的相关性研究
刘 浏,贾柳萍,黄 鹤,何 海,梁晓燕,谌黄威,伦伟健,罗夏朋
南方医科大学附属南海医院 1.消化内科; 2.妇产科,广东 佛山 528200
近年来,结直肠癌(colorectal cancer,CRC)的发病率和死亡率在我国呈上升趋势,已成为突出的公共卫生问题[1]。腺瘤性息肉是CRC最重要的癌前病变,对其早期发现并及时切除可明显降低CRC的发生风险[2]。幽门螺杆菌(Helicobacter pylori,H.pylori)是胃癌的一级致癌因子,普通人群的感染率为40%~50%[3-4]。研究[5-6]发现,H.pylori感染可能通过高胃泌素血症机制作用于结直肠息肉及诱导CRC的发生,但仍存在一定争议。本研究拟收集相关临床资料,探讨H.pylori感染和胃泌素与结直肠腺瘤性息肉之间的关系及作用机制,进一步了解CRC发生、发展的可能影响因素。
1 资料与方法
1.1一般资料收集2013年10月至2017年6月在南方医科大学附属南海医院因消化道症状行胃肠镜检查的结直肠腺瘤性息肉患者120例为研究组,另选取120例结肠镜检查无明显异常者为对照组。排除标准:(1)胃镜及病理发现糜烂性胃炎、萎缩性胃炎、消化性溃疡、胃恶性肿瘤者;(2)结肠镜及病理发现非腺瘤性息肉(包括炎症性、增生性、错构瘤样息肉)、家族性腺瘤性息肉病及癌变者;(3)既往有胃切除手术及炎症性肠病病史者;(4)既往曾根除H.pylori或入选前4周内使用过质子泵抑制剂(PPI)、H2受体阻滞剂、抗生素、铋剂者;(5)肠道准备不佳或未能完成全结肠检查者。所有入选者均签署由我院医学伦理委员会制订的患者知情同意书。
1.2方法
1.2.1 胃肠镜检查:所有入选者均予复方聚乙二醇电解质散137.12 g(和爽,深圳万和制药有限公司)行肠道准备,采用Olympus GIF-H260电子胃镜和Olympus CF-H260AI电子结肠镜,肠镜需描述息肉的部位、大小、数目、黏膜情况、山田分型等。
1.2.213C-尿素呼气试验(13C-UBT):患者空腹或禁食2 h以上,对准呼气收集管或集气袋吹气作为基线呼气样本。温开水送服1粒13C-尿素胶囊,再次收集服用胶囊后30 min呼气样本,使用呼气试验测试仪(海得威HCBT-01型)测定服13C-尿素胶囊前后呼气样本。诊断标准:DOB<4为阴性,DOB≥4为阳性。13C-尿素胶囊及呼气试验测试仪由深圳中核海得威生物科技有限公司提供。
1.2.3 病理组织学检查:肠镜下发现息肉即行活检,活检标本均制成组织切片进行常规苏木精-伊红(HE)染色,经我院病理科同一位高年资副主任医师诊断,如多发性息肉选择病理最重者进行分析。腺瘤性息肉病理类型包括:管状腺瘤、绒毛-管状腺瘤和绒毛状腺瘤,伴或不伴异型增生。
1.2.4 胃泌素17(gastrin 17,G17)检测:采用酶联免疫吸附法(ELISA法)测定,所有入选者检测前一天晚上饮食清淡,禁烟酒,于清晨空腹采集肘正中静脉血3 ml,室温静置1 h,3 000 r/min离心10 min,离心半径10 cm,吸取血清分装后采用G17 ELISA双抗体夹心检测试剂盒(芬兰Biohit公司),操作过程严格按照说明书进行。

2 结果
2.1一般资料及H.pylori感染情况研究组为结直肠腺瘤性息肉患者,共120例,男65例,女55例,年龄(56.71±18.42)岁(19~88岁);对照组为结肠镜检查无明显异常者,共120例,男62例,女58例,年龄(50.32±17.26)岁(21~82岁)。二组性别构成比相比,差异无统计学意义(P>0.05);年龄相比,差异有统计学意义(t=2.774,P=0.006),中老年患者比例(≥40岁)、H.pylori阳性率比较,差异均有统计学意义(P<0.05,见表1)。
2.2研究组腺瘤性息肉的临床特征与H.pylori感染情况120例患者共发现219个息肉,其中单发56例,多发64例。对于多发性息肉,以最大息肉所在部位、山田分型及最严重病理改变进行分析。结果显示,左半结肠、多发性和大息肉(≥10 mm)的H.pylori阳性率明显高于右半结肠、单发性和小息肉(<10 mm),差异有统计学意义(P<0.05);而山田分型和病理分型亚组相比,差异无统计学意义(P>0.05)(见表2~3)。
2.3研究组与对照组G17水平比较研究组血清G17水平明显高于对照组,二组中H.pylori阳性者G17水平也分别高于H.pylori阴性者,差异均有统计学意义(P<0.05,见表4)。
表1研究组与对照组一般资料及H.pylori感染率比较
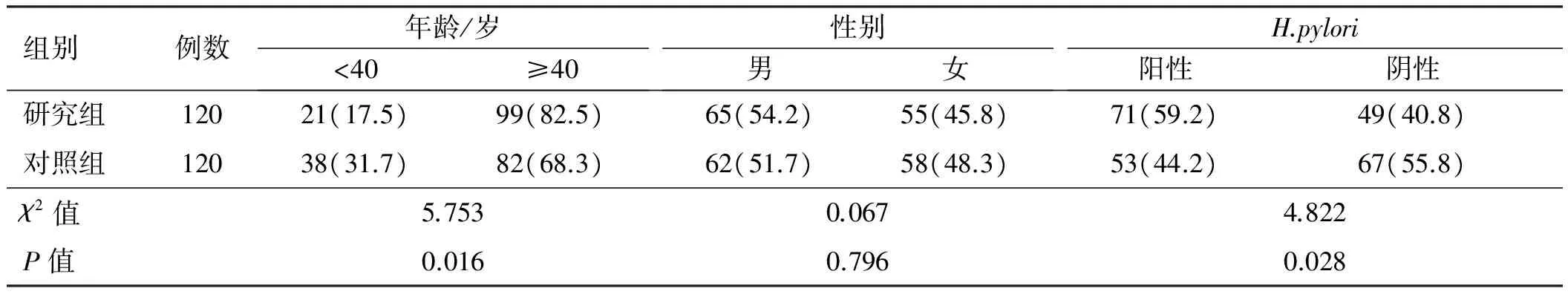
Tab 1 Comparison of the general data and H.pylori infection rate between the study group and control group 比例/%
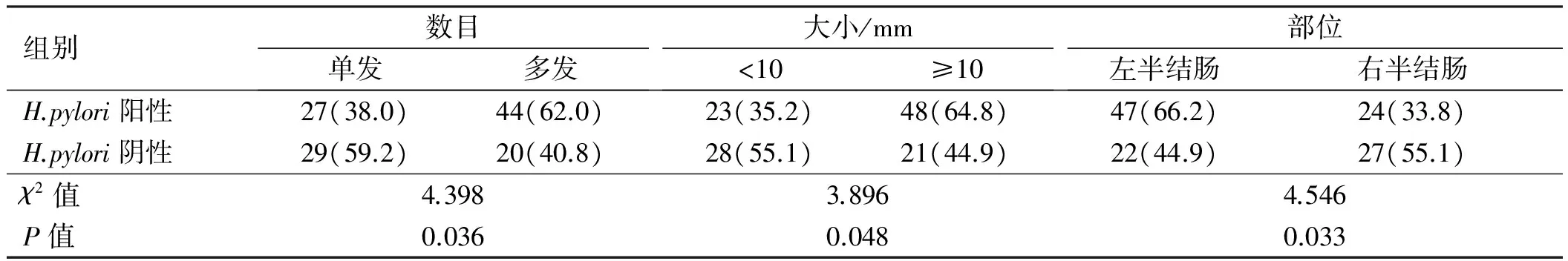
表2 研究组息肉数目、大小、部位与H.pylori感染情况Tab 2 The number, size, location of polyps and H.pylori infection in the study group 比例/%

表3 研究组最大息肉山田分型、病理分型与H.pylori感染情况Tab 3 The largest polyp type, pathological classification and H.pylori infection in the study group 比例/%
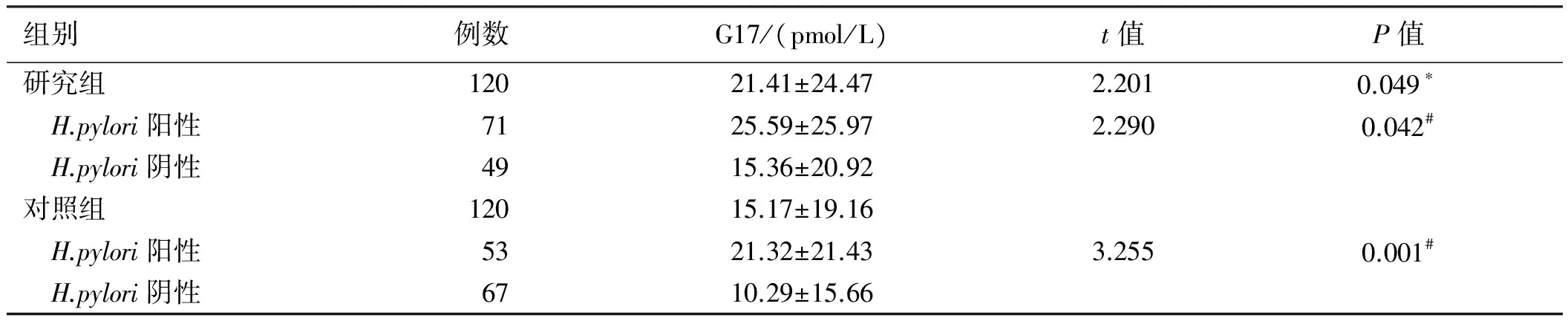
表4 研究组与对照组血清G17水平比较Tab 4 Comparison of G17 levels between the study group and control group
注:*:与对照组比较;#:与本组H.pylori阴性者比较。
3 讨论
近年来,随着我国社会经济发展、居民生活水平提高、生活方式改变及人口老龄化的进程加快,CRC的发病率和死亡率逐步上升,给社会经济造成沉重负担[1]。结直肠息肉特别是腺瘤性息肉和CRC高度相关,尽早发现并及时切除腺瘤性息肉是预防CRC发生、发展的关键[2]。H.pylori是一种微需氧革兰氏阴性杆菌,已被证实与慢性胃炎、消化性溃疡、胃癌及胃黏膜相关性淋巴瘤等多种疾病高度相关,WHO将其列为胃癌的一级致癌因子[3]。
H.pylori感染与结直肠息肉及CRC发病的相关性存在一定争议[5-6]。研究认为,H.pylori阳性比阴性者发生结直肠腺瘤或癌风险增加1.4~1.6倍[5],根除H.pylori或长期使用PPI则可降低大肠息肉发生的风险[7],而通过免疫组化可在结直肠息肉和癌组织中检测到H.pylori[8]。本研究发现,二组患者性别虽无明显差异,但研究组的年龄和中老年患者比例均明显高于对照组;且研究组H.pylori感染率,高于对照组,差异有统计学意义,提示H.pylori感染可能是结直肠腺瘤发生、发展的一个重要危险因素。因此,对于H.pylori阳性尤其中老年患者,建议在积极治疗H.pylori的同时应尽早完善结肠镜检查,排除结直肠肿瘤的可能。
H.pylori感染与结直肠息肉发病部位、数目、大小、病理分型等临床特征的相关性也存在一定争议[5]。H.pylori感染者大肠息肉在左半结肠多见,但也有更多位于近端结肠的报道[9-10]。本研究发现,H.pylori阳性患者左半结肠腺瘤的发生率为66.2%,高于右半结肠的33.8%,差异有统计学意义,这可能与致癌物质较易集中在直肠和乙状结肠有关,也可能由H.pylori感染导致左、右半结肠肿瘤发展过程中的染色体异常表达导致[11]。我们还发现,多发性和大息肉(≥10 mm)H.pylori阳性的比例也明显高于单发性和小息肉(<10 mm),而息肉的山田分型及病理分型各亚组间比较,差异则无统计学意义,这与既往的研究结果一致,推测可能与H.pylori感染后胃泌素及其衍生物逐渐增加并促进结直肠细胞不断增殖有关[12-13]。
目前多数研究[14]认为,H.pylori感染对结直肠息肉和CRC病因的影响是基于高胃泌素血症这一假设基础上的。H.pylori慢性感染可引起胃体黏膜萎缩,由于胃窦G细胞负反馈作用导致血清胃泌素水平升高,胃泌素水平升高与抗凋亡Bcl-2活性相关,增加致癌性和致突变COX-2的水平[15]。胃泌素及其衍生物能刺激生长因子依赖的信号传导通路,通过内分泌和旁分泌作用于大肠癌细胞,同时还具有营养和抗凋亡性能[12]。在体外,高胃泌素水平已被证实与结肠癌细胞的生长和增殖相关,且增加胃泌素水平升高患者(如Zollinger-Ellison综合征)的结直肠癌变的风险和结直肠细胞的增殖[16]。然而,也有研究[17]认为,H.pylori感染,包括CagA基因表达与大肠肿瘤发生、发展的风险增加有关,但H.pylori阳性和阴性患者之间空腹血清胃泌素水平无明显差异,高胃泌素血症并没有增加任何大肠肿瘤的风险。本研究发现,研究组血清G17水平明显高于对照组,并根据有无H.pylori感染亚组分析发现,二组中H.pylori阳性者G17水平也均高于H.pylori阴性者,提示H.pylori感染可能通过刺激人体胃泌素分泌来影响结直肠腺瘤性息肉的发生。但由于本研究样本量较小,可能存在一些难以控制的偏倚因素,因此,H.pylori感染与结直肠肿瘤相关的确切分子机制仍需进一步更为深入的研究予以明确。
总之,H.pylori感染可能通过刺激胃泌素分泌影响结直肠腺瘤性息肉的发生、发展,对于H.pylori阳性尤其中老年患者应尽早完善结肠镜检查,降低CRC的潜在风险,对CRC的早期预防、早期诊治等方面具有重要意义。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI: 10.3322/caac.21338.
[2] LADABAUM U, PATEL A, MANNALITHARA A, et al. Predicting advanced neoplasia at colonoscopy in a diverse population with the National Cancer Institutecolorectal cancer risk-assessment tool [J]. Cancer, 2016, 122(17): 2663-2670. DOI: 10.1002/cncr.30096.
[3] BURUCOA C, AXON A. Epidemiology of Helicobacter pylori infection [J]. Helicobacter, 2017, 22 Suppl 1. DOI: 10.1111/hel.12403.
[4] 王雪, 李异玲, 吕晓辉. 我国幽门螺杆菌感染的现状分析[J]. 胃肠病学和肝病学杂志, 2017, 26(6): 640-643. DOI: 10.3969/j.issn.1006-5709.2017.06.006
WANG X, LI Y L, LYU X H. Analysis of Helicobacter pylori infection in China [J]. Chin J Gastroenterol Hepatol, 2017, 26(6): 640-643. DOI: 10.3969/j.issn.1006-5709.2017.06.006.
[5] WANG F, SUN M Y, SHI S L, et al. Helicobacter pylori infection and normal colorectal mucosa-adenomatous polyp-adenocarcinoma sequence: a meta-analysis of 27 case-control studies [J]. Colorectal Dis, 2014, 16(4): 246-252. DOI: 10.1111/codi.12290.
[6] SIDDHESHWAR R K, MUHAMMAD K B, GRAY J C, et al. Seroprevalence of Helicobacter pylori in patients with colorectal polyps and colorectal carcinoma [J]. Am J Gastroenterol, 2001, 96(1): 84-88. DOI: 10.1111/j.1572-0241.2001.03355.x
[7] ZUNIGA R, BAUTISTA J, SAPRA K, et al. Combination of triple therapy and chronic PPI use may decrease risk of colonic adenomatous polyps in Helicobacter pylori infection [J]. Gastroenterol Res Pract, 2015: 638547. DOI: 10.1155/2015/638547.
[8] SOYLU A, OZKARA S, ALIS H, et al. Immunohistochemical testing for Helicobacter pylori existence in neoplasms of the colon [J]. BMC Gastroenterol, 2008, 8: 35. DOI: 10.1186/1471-230X-8-35.
[9] KOUNTOURAS J, KAPETANAKIS N, ZAVOS C, et al. Impact of Helicobacter pylori infection on normal colorectal mucosa, adenomatous polyps and adenocarcinoma sequence [J]. Colorectal Dis, 2014, 16(5): 390-391. DOI: 10.1111/codi.12356.
[10] INOUE I, MUKOUBAYASHI C, YOSHIMURA N, et al. Elevated risk of colorectal adenoma with Helicobacter pylori-related chronic gastritis: a population-based case-control study [J]. Int J Cancer, 2011, 129(11): 2704-2711. DOI: 10.1002/ijc.25931.
[11] ÜNLER G K, TEKEÖZGÜR G, GOKTÜRK H S, et al. Is there any association between colonic polyps and gastric intestinal metaplasia? [J]. Turk J Gastroenterol, 2016, 27(3): 221-226. DOI: 10.5152/tjg.2016.15212.
[12] NAJIB S, KOWALSKI-CHAUVEL A, DO C, et al. Progastrin a new pro-angiogenic factor in colorectal cancer [J]. Oncogene, 2015, 34(24): 3120-3130. DOI: 10.1038/onc.2014.255.
[13] 陈志涛, 王萍, 孙圣斌, 等. 结直肠腺瘤危险因素及幽门螺杆菌感染与腺瘤特征和血清胃泌素水平的相关性研究[J]. 中国全科医学, 2017, 20(2): 154-158. DOI: 10.3969/j.issn.1007-9572.2017.02.007.
CHEN Z T, WANG P, SUN S B, et al. Risk factors for colorectal adenomas, association of helicobacter pylori infection with features of colorectal adenomas and serum gastrin levels [J]. Chinese General Practice, 2017, 20(2): 154-158. DOI: 10.3969/j.issn.1007-9572.2017.02.007.
[14] ROBERTSON D J, SANDLER R S, AHNEN D J, et al. Gastrin, Helicobacter pylori, and colorectal adenomas [J]. Clin Gastroenterol Hepatol, 2009, 7(2): 163-167. DOI: 10.1016/j.cgh.2008.09.006.
[15] SHAO Y, SUN K, XU W, et al. Helicobacter pylori infection, gastrin and cyclooxygenase-2 in gastric carcinogenesis [J]. World J Gastroenterol, 2014, 20(36): 12860-12873. DOI: 10.3748/wjg.v20.i36.12860.
[16] RENGA M, BRANDI G, PAGANELLI G M, et al. Rectal cell proliferation and colon cancer risk in patients with hypergastrinaemia [J]. Gut, 1997, 41(3): 330-332.doi:10.3969/j.issn.1006-5709.2018.02.008
[17] SELGRAD M, BORNSCHEIN J, KANDULSKI A, et al. Helicobacter pylori but not gastrin is associated with the development of colonic neoplasms [J]. Int J Cancer, 2014, 135(5): 1127-1131.

