miR-622在上皮性卵巢癌组织中表达及与预后的关系
余 俊,刘彤鸥△,李晓兰
1. 湖北中医药大学·湖北省中医院 妇产科(武汉 430061);2. 湖北省宜昌市第二人民医院 妇产科(宜昌 443000)
卵巢癌是女性生殖道较为常见的三大恶性肿瘤之一,其中,上皮性卵巢癌是主要的组织学类型,约占90%[1],由于卵巢解剖位置较为隐蔽,且早期缺乏典型的临床症状,多数患者确诊时已进展为晚期,加之卵巢癌具有侵袭转移力强、复发率高、易耐药等特点,患者预后较差,病死率位居妇科恶性肿瘤首位[2]。微小RNA(micro RNA,miRNA)作为广泛存在于生物体内的高度保守的短链RNA,可通过调控靶mRNA的3' 非翻译区而参与多种生命活动[3]。近年来,研究[4]发现,miRNA与人类多种肿瘤发生、进展过程密切相关,在恶性肿瘤早期诊断、指导治疗及评估预后中发挥重要作用。miR-622作为miRNA重要类型,在胃癌[5]、结直肠癌[6]等多种恶性肿瘤组织中表达异常,且参与了肿瘤细胞侵袭、转移等过程,但miR-622在上皮性卵巢癌发生、进展中的作用鲜有报道。本研究拟检测上皮性卵巢癌组织中miR-622表达,探讨其与患者预后的关系,以期为卵巢癌机制研究及基因治疗提供资料。
1 资料与方法
1.1 临床资料
选取2010年3月至2012年3月在湖北省中医院择期行手术切除的上皮性卵巢癌患者81例,纳入标准:初次手术,术前均未接受放化疗,术后均经病理学检查确诊;排除标准:术前接受过放化疗治疗者。年龄24~73(49.7±9.1)岁;病理学分型:黏液性囊腺癌20例,浆液性囊腺癌61例;根据国际妇产科联盟(FIGO)2006年病理分期标准:Ⅰ~Ⅱ期27例,Ⅲ~Ⅳ期54例;组织学分级:中低分化53例,高分化28例;发生淋巴结转移34例。同期,选取行手术切除治疗的良性上皮性卵巢囊肿患者48例作为对照组,纳入标准:初次手术治疗,术后病理确诊且排除癌变。年龄25~75(48.3±8.7)岁。本研究通过医院伦理委员会批准,所有患者均行知情同意。
1.2 方法
1.2.1 主要试剂 总RNA提取试剂盒(Trizol法)购自上海江莱生物科技公司,反转录试剂盒购自北京优尼康生物公司,PCR试剂盒购自北京嘉美纽诺生物科技公司,miR-622及内参引物均由上海生工生物公司设计合成,实时荧光定量PCR仪购自美国Bio-rad公司。
1.2.2 利用实时荧光定量PCR技术检测不同组织中miR-622表达 两组患者均于术中留取上皮性卵巢癌组织和对照组组织,快速置于液氮中,保存于-70 ℃冰箱。取两组患者组织研磨后,加入细胞裂解液,对组织细胞中总RNA进行提取,并对总RNA纯度进行检测,以A280/A260≥1.80作为合格标准。取总RNA进行逆转录,反应条件:18 ℃ 5 min,40 ℃ 25 min,82 ℃ 10 min。利用PCR扩增试剂盒进行扩增,引物序列:miR-622引物:上游:5'-ATCCCAGGGAGACAGAGATCGAGG-3',下游:5'-CAACCTCCCAAATAACTAAAACTACA-3';U6引物:上游:5'-CGAGCACAGAATCGCTTCA-3',下游:5'-CTCGCTTCGGCAGCACATAT-3'。PCR反应条件:95 ℃ 1 min,92 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,连续进行40次循环,每个样品设3个平行复孔。利用2-△△Ct法计算不同组织中miR-622相对表达量。以上皮性卵巢癌组织中miR-622表达量的P25值为界值[7],将患者分为低表达组(n=21)和高表达组(n=60)。
1.2.3 病例随访 所有上皮性卵巢癌患者均进行术后随访,包括电话、门诊复诊等形式,随访截止日期2017年3月31日。
1.3 统计学方法
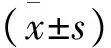
2 结果
2.1 上皮性卵巢癌和对照组组织中miR-622表达比较
上皮性卵巢癌组织中miR-622相对表达量(2.16±0.21),高于对照组(1.59±0.15),差异有统计学意义(t=16.672,P<0.001)。
2.2 上皮性卵巢癌组织中miR-622表达量与临床病理特征相关性
miR-622在上皮性卵巢癌组织中的表达在不同年龄、不同肿瘤直径、不同病理学分型之间差异无统计学意义(P>0.05),而在不同FIGO分期、不同组织学分级和是否发生淋巴结转移中,差异有统计学意义(P<0.05)(表1)。
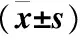
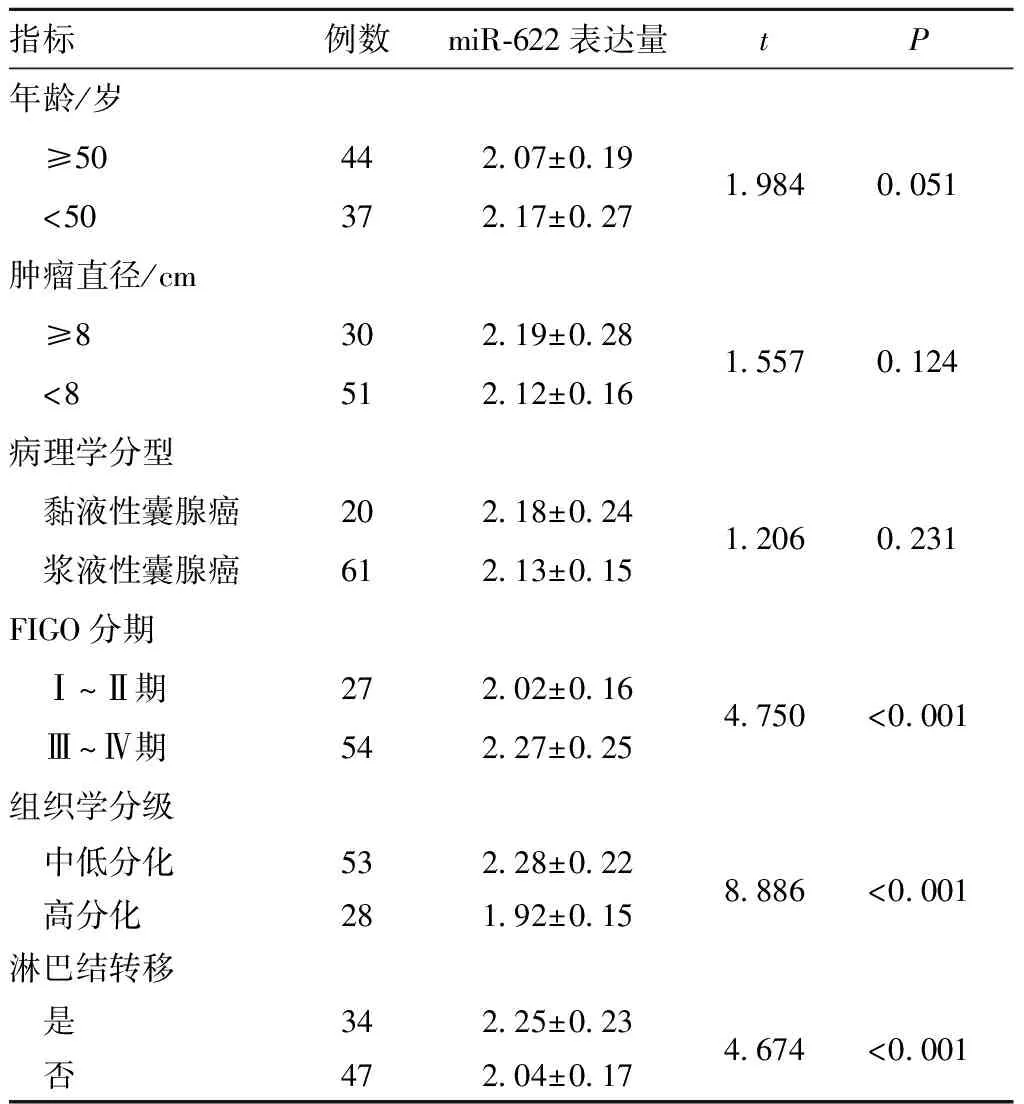
指标例数miR⁃622表达量tP年龄/岁 ≥5044207±01919840051 <5037217±027肿瘤直径/cm ≥830219±02815570124 <851212±016病理学分型 黏液性囊腺癌20218±02412060231 浆液性囊腺癌61213±015FIGO分期 Ⅰ~Ⅱ期27202±0164750<0001 Ⅲ~Ⅳ期54227±025组织学分级 中低分化53228±0228886<0001 高分化28192±015淋巴结转移 是34225±0234674<0001 否47204±017
2.3 上皮性卵巢癌组织中miR-622表达量对患者生存时间的影响
生存分析显示,高表达组患者总体生存率低于低表达组,Log-rank检验显示,差异有统计学意义(2=6.932,P=0.008)(图1)。
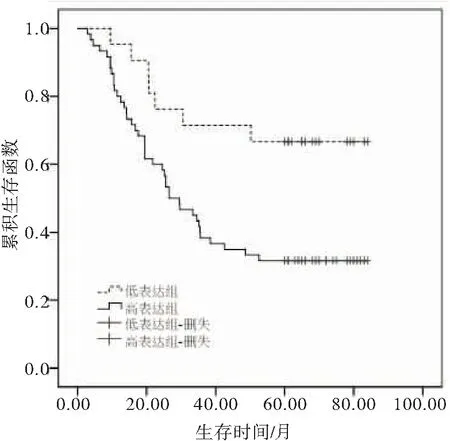
图1 不同上皮性卵巢癌组织中miR-622表达量患者的生存率曲线
2.4 影响上皮性卵巢癌患者生存的多因素分析
Cox比例风险回归分析显示,FIGO分期、组织学分级、淋巴结转移和miR-622表达水平是影响患者生存的独立风险因素(P<0.05)(表2)。
表2影响上皮性卵巢癌患者生存的Cox比例风险回归分析结果
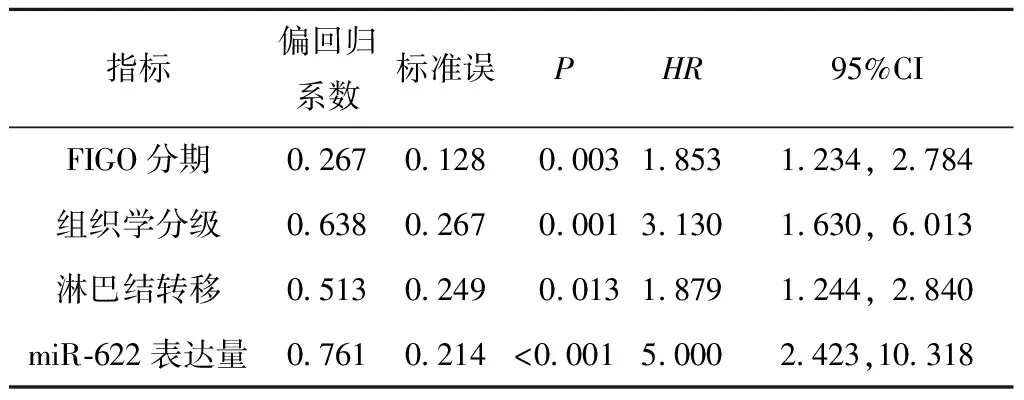
指标偏回归系数标准误PHR95%CIFIGO分期02670128 000318531234,2784组织学分级06380267 000131301630,6013淋巴结转移05130249 001318791244,2840miR⁃622表达量07610214<000150002423,10318
3 讨论
随着诊疗技术的进展,上皮性卵巢癌患者生存时间有了明显改善,但复发、转移仍然是导致患者治疗失败及死亡的主要因素[8],积极探讨影响该病发生、转移的机制以改进治疗,已成为临床研究重点。miRNA作为一种单链非蛋白编码小分子RNA,可通过结合在靶基因mRNA的3' 端非翻译区而抑制蛋白质翻译或诱导靶mRNA降解,从而达到负性调控基因表达的目的,在机体细胞、器官生理功能[9]以及肿瘤发生、进展中发挥重要作用[10]。miR-622作为miRNA重要类型,在肿瘤细胞生长、增殖、侵袭、转移中发挥重要功能[11],有研究[12]指出,k-Ras基因为miR-622的潜在靶基因,而k-Ras基因突变参与了肿瘤发生且对预后产生不利影响。本研究中,miR-622在上皮性卵巢癌组织中相对表达量明显高于对照组,说明miR-622在上皮性卵巢癌组织中呈高表达,提示miR-622可能在上皮性卵巢癌发生中发挥重要作用。
本研究结果显示,miR-622在上皮性卵巢癌组织中表达,在不同FIGO分期、不同组织学分级和是否发生淋巴结转移中,差异有统计学意义(P<0.05),FIGO分期Ⅲ~Ⅳ期、组织学分级中低分化及发生淋巴结转移组织中表达量明显升高,说明miR-622表达量与上皮性卵巢癌恶性程度有关,可能参与了肿瘤病理进展过程。有研究[13]指出,miRNA不仅与恶性肿瘤患者发生、进展有关,而且影响患者预后。Thomas等[14]指出,结直肠癌患者miRNA表达异常与患者预后密切相关,如某些miRNA可预测结直肠癌复发,某些miRNA可影响化疗药物效果等。本研究生存分析显示,高表达组患者总体生存率明显低于低表达组,说明miR-622高表达影响患者生存时间,Cox比例风险回归分析结果显示,影响上皮性卵巢癌患者生存的因素包括miR-622表达量,说明miR-622高表达与患者预后不良有关,提示miR-622有望成为评估上皮性卵巢癌患者预后的生物学标志物。
综上所述,上皮性卵巢癌组织中miR-622呈高表达,且与肿瘤发生、进展密切相关,是患者预后的重要影响因素,可能成为一个新的上皮性卵巢癌患者预后评估指标,但本研究仅探讨了上皮性卵巢癌组织中miR-622表达与临床病理特征和预后的关系,具体作用机制尚待进一步研究明确。
[1]Jessmon P, Boulanger T, Zhou W,etal. Epidemiology and treatment patterns of epithelial ovarian cancer[J]. Expert Rev Anticancer Ther, 2017, 17(5): 427-437.
[2]Heitz F, Hengsbach A, Harter P,etal. Intake of selective beta blockers has no impact on survival in patients with epithelial ovarian cancer[J]. Gynecol Oncol, 2017, 144(1): 181-186.
[3]Provost P. The clinical significance of platelet microparticle-associated microRNAs[J]. Clin Chem Lab Med, 2017, 55(5): 657-666.
[4]Oliveto S, Mancino M, Manfrini N,etal. Role of microRNAs in translation regulation and cancer[J]. World J Biol Chem, 2017, 8(1): 45-56.
[5]Xie J, Chen M, Zhou J,etal. miR-7 inhibits the invasion and metastasis of gastric cancer cells by suppressing epidermal growth factor receptor expression[J]. Oncol Rep, 2014, 31(4): 1715-1722.
[6]Fang Y, Sun B, Li Z,etal. MiR-622 inhibited colorectal cancer occurrence and metastasis by suppressing K-Ras[J]. Mol Carcinog, 2016, 55(9): 1369-1377.
[7]蒋志强, 李亚兰, 韩广森, 等. 微小RNA-101在结肠癌组织的表达及其与患者预后的关系[J]. 中华实验外科杂志, 2016, 33(5): 1354-1356.
[8]Paik E S, Lee Y Y, Shim M,etal. Timing and patterns of recurrence in epithelial ovarian cancer patients with no gross residual disease after primary debulking surgery[J]. Aust N Z J Obstet Gynaecol, 2016, 56(6): 639-647.
[9]李乐, 吴金亮, 徐明, 等. 环状RNA的生物特征及其功能研究进展[J]. 医学研究杂志, 2017, 46(2): 10-13.
[10] Abreu F B, Liu X, Tsongalis G J. miRNA analysis in pancreatic cancer: the Dartmouth experience[J]. Clin Chem Lab Med, 2017, 55(5): 755-762.
[11] Wang X, Xin Z, Xu Y,etal. Upregulated miRNA-622 inhibited cell proliferation, motility, and invasion via repressing Kirsten rat sarcoma in glioblastoma[J]. Tumour Biol, 2016, 37(5): 5963-5970.
[12] 张国院, 祝梅. MiR-622抑制人结直肠腺癌细胞HT-29增殖的研究[J]. 现代医药卫生, 2017, 33(8): 1143-1145,1148.
[13] Mueller A K, Lindner K, Hummel R,etal. MicroRNAs and Their Impact on Radiotherapy for Cancer[J]. Radiat Res, 2016, 185(6): 668-677.
[14] Thomas J, Ohtsuka M, Pichler M,etal. MicroRNAs: Clinical Relevance in Colorectal Cancer[J]. Int J Mol Sci, 2015, 16(12): 28063-28076.