压 应 力 对 人 软 骨 终 板 细 胞MMP-1、3、13和TIMP-1表达的影响研究*
丁亮 唐果 薛锋*肖海军 何志敏 沈玉春
随着我国社会老龄人口的增加,椎间盘退变发病率逐年上升。研究表明软骨终板退变是椎间盘退变的始动因素,而压应力是导致软骨终板退变的重要原因。力学刺激直接影响软骨终板细胞外基质代谢,使得软骨终板细胞基质、离子浓度、pH值、渗透压以及含水量等发生改变[1-4]。软骨细胞外基质 (extracellular m atrix,ECM)与软骨细胞功能密切相关,其合成、降解紊乱是造成软骨变性的重要原因之一,而基质金属蛋白酶 (matrix m etalloproteinase,MMPs)及其抑制因子 (Tissue inhibitor of metalloproteases,TIMP)可能在这一过程中起重要作用。但目前关于压应力对软骨终板MMPs以及 TIMP表达影响的报道不多。本研究通过选择MMP家族中属于胶原酶亚型的MMP-1、MMP-3、MMP-13及其抑制因子TIMP-1,观察压应力作用后其表达变化情况,进一步探讨 MMP-1、MMP-3、MMP-13和 TIMP-1与压应力致软骨终板退变的关系。
1 材料与方法
1.1 研究对象及软骨终板细胞的分离、培养
将6个月意外流产胎儿软骨终板(已获南方医科大学附属奉贤医院伦理委员会批准),进行原代细胞培养。无菌条件下取 L4/5软骨终板,并切取软骨终板,切至1 mm3大小,用含青霉素钠/链霉素双抗液的磷酸缓冲盐溶液 (PBS)液冲洗。以0.25%胰蛋白酶、0.30%胶原酶消化,直到软骨块完全消化、分离成软骨细胞悬液,接种于培养瓶,使用含10%FBS的DMEM培养基中,37℃、5%CO2培养箱中进行常规培养。
1.2 主要试剂及药品
多聚甲醛、乙二胺四乙酸(EDTA)购于国药集团公司;新鲜细胞组织总RNA提取试剂盒,购自上海诺伦生物,批号:LN-0108;由上海诺伦生物公司合成 PCR引物;Realtime PCR扩增试剂盒购自上海诺伦生物公司。MMP-1一抗兔多克隆抗体 (美国 abcam 公司,ab52631);MMP-3一抗兔多克隆抗体 (美国abcam公司,ab52915);MMP-13一抗兔多克隆抗体 (美国 abcam 公司,ab51072);TIMP-1一抗兔多克隆抗体 (美国abcam公司,ab81282);二抗辣根酶标记山羊抗兔IgG(上海晶美生物,进口分装)。
1.3 周期性压应力加载
将培养的第2代软骨终板细胞以1×106/mL的密度种于6孔培养板,37℃、5%CO2、饱和湿度的培养箱静态培养至达90%汇合。用含1%血清的培养基培养24h,使大部分实验细胞均处于G0期,达到实验细胞同步化的目的。目前模拟体外力学环境的实验方法较多[5],我们是通过特定装置进行气体加压构建细胞压应力加载模型:该加载装置由中南大学湘雅二医院成骨细胞压应力课题组提供(细胞压力加载实验系统示意图及产品外观图如下),该装置采用SANTN温控装置控制温度,德国全进口数显压力表,使系统压力和温度监控更精确,再施加周期性压应力。工作原理:将体外培养的NCs细胞种植在培养皿上,再将培养皿放入压力腔中,压力室密封形成密闭腔体,外界供5%CO2的空气混合气,利用气体产生的静压使培养皿内细胞受到相应的压应力作用。实验系统具备稳定的气压源,应力设计范围为 0 Kpa~ 100 Kpa,施加周期性压应力(压力大小 0.8 MPa,频率为0.1 Hz),连续加载9天。根据压应变作用时间分为2 h组、6 h组、12 h组,每天除对照组外,各实验组连续加载2 h、6 h和12 h,对照组采用相同处理方式,不施加压应力。作用结束后,立即用PBS冲洗细胞,在倒置显微镜下拍照,并收集样品。
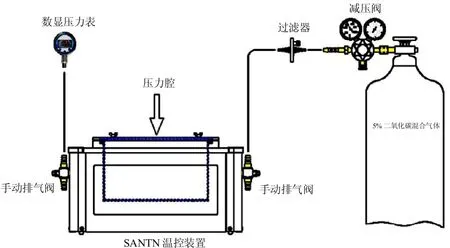
图1,细胞压力加载实验系统示意图

图2,细胞压力加载实验系统产品外观
1.4 总RNA的提取
使用TRIzol法提取RNA,并用RNasey Mini Kit纯化,测量纯化后的RNA浓度以及RNA完整性。
1.5 Real-time PCR分析
按照逆转录-聚合酶链反应试剂盒说明书逆转录合成cDNA。采用PCR试剂盒建立反应体系,将各反应管放入荧光定量PCR仪进行扩增。电泳进一步鉴定产物。
GAPDH作为内参,用LightCycler SoftwareVersion软件分析目的基因相对表达量(见表1)。Real-time PCR反应条件:95℃,1分钟变性;95℃,12秒,62℃,40秒,共40个循环。
1.6 Western blot实验
培养第3天取各组细胞,每种细胞样本加入100 LRIPA裂解液,使细胞完全裂解。裂解物移入离心管中。取5L样本加入5L SDS-PAGE蛋白上样缓冲液(2×),100℃加热处理5min,冰上冷却。离心10min。分离样品后每孔20 L上样。甲醇浸泡PVDF膜后继续Transfer Buffer浸泡10 min。使用Trans-BlotSDCell进行电泳转移完毕后,用丽春红染色液染色并标记蛋白质Marker的条带位置。使用Western封闭液封闭转印膜2h,然后用1×TBST洗涤3次,每次10 min。分别加入1∶1000一抗4℃孵育过夜。1×TBST洗涤3次,每次15 min。加入1∶10000二抗,室温孵育2 h。1×TBST洗涤3次,每次15 min。用超敏ECL化学发光试剂盒进行化学发光检测,并对 X光片曝光。显影定影后,拍照并分析。

表1,各目的基因引物序列
1.7 MTT实验
终板软骨细胞培养至80%~90%时,施加相应时间的压应力后接种96孔板,每组3孔,每日测3孔取平均值,连测9 d。吸出检测孔培养液,加入MTT 20 L/孔,继续培养6 h,每孔使用移液枪加入DMSO 150 L,震荡10 min,酶联检测仪上以570nm波长测吸光度(A)值。绘制生长曲线。
1.8 统计学分析
采用SPSS13.0统计软件包进行实验数据分析,数据分析采用独立样本t检验、方差分析分别进行两组间以及多组间比较,P<0.05有统计学差异。
2 结果
2.1 组织形态学
贴壁后的正常软骨终板细胞成短梭形、三角形以及多边形,呈典型的“铺路石”状;而随着细胞加压时间延长,出现细胞形态改变,长梭形细胞明显增加,细胞去分化现象明显,老化速度加快,坏死细胞明显增多(见图3)。压力大小0.8 Mpa)。

图3,压应力下人软骨终板细胞培养第9天细胞形态(A对照组2h;B对照组6 h;C对照组12 h;D加压2 h;E加压6 h;F加压12 h;
2.2 MTT法测定细胞增殖率结果
通过对软骨终板细胞分别施加0.8Mpa压应力,加压时间分别为2 h、6 h、12 h,MTT法测定A值绘制的生长曲线显示,短时间(2 h)压应力作用促进细胞增殖,长时间(6 h、12h)压应力抑制细胞增殖。压应力作用6 h、12h组分别与对照组比较差异有统计学意义(P<0.05)(见图4)。

图4,压应力(压力大小0.8 Mpa)下人软骨终板细胞MTT折线图
2.3 Real-time PCR和WesternBlot表达结果
压应力(压力大小0.8MPa)下人软骨终板细胞培养第3天 Western Blot、RT-PCR 检测发现 MMP-1、MMP-3、MMP-13表达在压应力作用2h时下降,TIMP-1表达增加;压应力作用6 h组 MMP-1、MMP-3、MMP-13表达增加,TIMP-1表达下降;压应力作用12 h组 MMP-1、MMP-3、MMP-13表达显著增加,TIMP-1表达显著下降。压应力作用12 h组与各组比较,差异有统计学意义(见图5-6)。

图5,压应力(压力大小0.8 MPa)下人软骨终板细胞培养第3天RTPCR结果

图6,压应力(压力大小0.8MPa)下人软骨终板细胞培养第3天Western Blot结果
3 讨论
腰椎间盘退变是骨科常见的慢性病之一,由其引起的一系列症状可严重影响患者的生活质量,甚至造成肢体残疾,丧失劳动能力,耗费大量的医疗费用,给患者和社会带来了沉重的负担。随着我国老龄化社会的到来,椎间盘退变发病率逐年上升,文献报道超过80%的人在其一生中将经历下背部疼痛,同时在60岁以上人群中高达90%的人存在至少一个节段的椎间盘退变[6]。腰椎间盘退变是一种多因素疾病,其具体机制尚不十分明确,研究发现与腰椎异常应力、遗传、增龄、劳动、吸烟等多种生活习惯等有关[7]。有研究发现软骨终板与椎间盘关系密切,软骨终板退变是引起椎间盘营养障碍和退变的始动因素[9,11]。软骨终板为一扁圆盘状半透明结构,它与纤维环一起包绕髓核,起到缓冲外力和传递应力的作用。椎间盘本身是无血供组织,其营养物质的获得和代谢产物的排出通过骨髓腔-血窦-软骨终板界面的扩散作用完成[8]。因此CEP既有屏障功能,又有营养中介作用,椎间盘的退变往往继发于软骨终板的退变,一些研究通过损伤动物软骨终板从而制备动物椎间盘退变模型[10]。
软骨终板在日常生活中由于不同姿势,使其受到力学刺激方式较复杂,通常是压缩、弯曲和扭转的组合,其中以压缩应力最为明显。力学刺激直接影响软骨终板细胞外基质代谢,使得软骨终板细胞基质、离子浓度、pH值、渗透压以及含水量等发生改变[1-4]。研究发现生理范围内的压应力可以促进软骨终板细胞外基质蛋白合成和蛋白多糖分泌,超过生理承受范围的压应力能抑制蛋白多糖的合成,并增加降解酶的合成[4,12]。本研究在压应力下进行人软骨终板细胞培养发现:贴壁后的正常软骨终板细胞外形呈现短梭形、三角形以及多边形,出现典型的“铺路石”状:而随着细胞加压时间延长,出现细胞形态改变,长梭形细胞明显增加,细胞去分化现象明显,老化速度加快,坏死细胞明显增多。同时通过对软骨终板细胞分别施加周期性压应力以及不同加压时间,其 MTT结果显示:短时间压应力作用促进细胞增殖,长时间压应力抑制细胞增殖。这提示长时间压应力可以加速软骨终板细胞老化并抑制细胞增殖从而导致退变。
MMPs是存在于细胞外基质中最主要的酶系统,可以降解各种细胞外基质蛋白[12-14]。MMP-1、MMP-13属于MMPs中的胶原酶亚家族,可直接降解软骨基质中最具特征、含量最多的Ⅱ型胶原。MMP-3是与基质代谢过程密切相关的酶,它可促进纤溶酶介导的蛋白酶水解,并参与间质胶原酶的激活来降解Ⅱ型胶原。朱新辉等[15]通过测定膝关节骨性关节炎患者血液和滑液MMP-3水平,结果发现骨性关节炎患者与对照者相比,MMP-3水平明显升高,且表达水平与病变严重程度呈明显正相关;这提示MMP-3在软骨退变的病理过程中起重要作用,可以作为软骨退变、骨性关节炎严重程度的生物标记。TIMP是MMPs的特异性抑制因子,能调节MMPs的活性。细胞外基质中过量MMPs的表达可引起聚集蛋白聚糖 (aggrecan)降解,蛋白多糖含量下降,组成成分(硫酸软骨素/硫酸角质素比值下降)和胶原类型发生明显改变,可导致软骨终板生物力学功能的减退甚至丧失,从而出现退变[12-14]。在本研究中,我们对软骨终板细胞施加周期性压应力,并通过 Western-Blot、RT-PCR检测压应力下人软骨终板细胞MMP-1、MMP-3、MMP-13表达情况,结果显示:长时间压应力加载使 MMP-1、MMP-3、MMP-13表达显著增加,其表达情况与压应力作用时间呈正相关。
Vo等[16]回顾研究:在人类和动物模型中MMPs基因片段的表达和活性调控,发现 MMP-1、MMP-13表达及酶活性的上调与软骨终板基质破坏明显相关。在 MMPs所有的亚型中,MMP-1、MMP-13属于胶原酶亚族,对基质代谢影响最为显著,直接参与 II型胶原的变性裂解,破坏软骨结构的完整性,对软骨进行重塑,进而影响软骨终板退变[15,16],这些结论解释了MMP家族与软骨终板退变的关系。同时,还有多项研究证实退变软骨细胞中 MMP-1、MMP-3、MMP-13可出现显著升高[17-20]。在本研究中,我们通过对软骨终板细胞施加周期性压应力,成功验证压应力可促使部分MMP表达显著增加,且表达情况与作用时间成正相关,这提示我们:压应力可通过调控MMP表达上调可导致软骨终板发生退变。至于“压应作用”通过何种途径对MMP进行调控,其机制尚未明确。
综上所述,MMP-1、MMP-3、MMP-13及TIMP-1在压应力导致软骨终板退变的发病过程中起重要作用,MMP-1、MMP-3、MMP-13的表达与压应力致软骨终板退变程度相关,但有关调控软骨终板细胞力学信号转导的具体生化过程仍有待进一步研究。
[1] Emanuel KS,Vergroesen PP,Peeters M,et al.Poroelastic behaviour of the degenerating human intervertebral disc:a ten-day study in a loaded disc culture system[J].Eur Cell Mater,2015,29:330-340.
[2]Wang S,Park W M,Kim Y H,et al.In vivo loads in the lumbar L3-4disc during a weight lifting extension[J].Clinical Biomechanics,2014,29(2):155-160.
[3] Zehra U,Robson-Brown K,AdamsMA,et al.Porosity and Thickness of the Vertebral Endplate Depend on Local Mechanical Loading[J].Spine(PhilaPa1976),2015,40(15):1173-1180.
[4] Neidlinger-WilkeC,Mietsch A,Rinkler C,etal.Interactions of environmental conditions and mechanical loads have influence on matrix turnover by nucleus pulposus cells[J].J Orthop Res,2012,30(1):112-121.
[5]OgawaR,MizunoS,MurphyGF,etal.The effect of hydrostaticpressureonthree-dimensionalchondroinductionofhumanadipose-deriv-ed stemcells[J].Tissue Eng Part A,2009,15(10):2937-2945.
[6] Martirosyan NL,Patel AA,Carotenuto A,et al.Genetic Alterations in Intervertebral Disc Disease[J].Front Surg,2016,3:59.
[7] 黄宇峰,雍之瑶,刘晓明,等.尼古丁在人椎间盘髓核细胞退变中的作用[J].生物骨科材料与临床研究,2017,14(01):16-19.
[8] Wu Y,Cisewski SE,Wegner N,et al.Region and strain-dependent diffusivities of glucose and lactate in healthy human cartilage endplate[J].J Biomech,2016,49(13):2756-2762.
[9] Yuan W,Che W,Jiang YQ,et al.Establishment of intervertebral disc degeneration model induced by ischemic sub-endplate in rat tail[J].Spine J,2015,15(5):1050-1059.
[10]杨大志,韩晶,易伟宏.兔椎间盘退变与修复模型的研究现状[J].生物骨科材料与临床研究,2015,12(02):64-68.
[11]Gawri R,Moir J,Ouellet J,et al.Physiological loading can restore the proteoglycan content in a model of early IVD degeneration[J].PLoS One,2014,9(7):e101233.
[12]Arpino V,Brock M,Gill SE.The role of TIMPs in regulation of extracellular matrix proteolysis[J].Matrix Biol,2015,44-46:247-254.
[13]Gruber HE,Ingram JA,Cox MD,et al.Matrix metalloproteinase-12 immunolocalization in the degenerating human intervertebral disc and sand rat spine:Biologic implications[J].Exp Mol Pathol,2014,97(1):1-5.
[14]Yuan W,Zhao MD,Yuan FL,et al.Association of endothelin-1 expression and cartilaginous endplate degeneration in humans[J].PLoS One,2013,8(4):e60062.
[15]朱新辉,徐大伟,黄巍,等.膝关节骨性关节炎血液和滑液MMP-3水平与其病变程度的相关性[J].中国骨质疏松杂志,2013,19(3):203-206.
[16]Vo NV,Hartman RA,Yurube T,et al.Expression and regulation of metalloproteinases and their inhibitors in intervertebral disc aging and degeneration[J].Spine J,2013,3(3):331-341.
[17]Chijimatsu R,Kunugiza Y,Taniyama Y,et al.Expression and pathological effects of periostin in human osteoarthritis cartilage[J].BMC Musculoskelet Disord,2015,16:215.
[18]Lee DG,Park SY,Chung WS,et al.Fucoidan Prevents the Progression of Osteoarthritis in Rats[J].J Med Food,2015,18(9):1032-1041.
[19]Haller JM,Swearingen CA,Partridge D,et al.Intraarticular Matrix Metalloproteinases and Aggrecan Degradation Are Elevated After ArticularFracture[J].ClinOrthopRelatRes,2015,473(10):3280-3288.
[20]Huang W,Ao P,Li J,et al.Autophagy Protects Advanced Glycation End Product-Induced Apoptosis and Expression of-MMP-3and MMP-13 in Rat Chondrocytes[J].Biomed Res Int,2017,2017:6341919.

