二苯乙烯苷通过抑制NF-κB信号通路减轻TNF-α诱导的人脑微血管内皮细胞损伤
何邵波,蒋传命,杨 秦,张彩平,龙石银
(1.南华大学 药学与生命科学院生物化学与分子生物学教研室,湖南 衡阳,421001;2.邵阳学院 医学检验学院,湖南 邵阳,422000)
脑卒中(Cerebral stroke)又称“中风”,是一种由于脑部血管突然破裂或血管阻塞导致血液不能流入大脑而引起的一系列脑组织损伤,包括缺血性和出血性卒中。据调查显示,目前脑卒中已成为我国死亡率最高的疾病,同时也是中国成年人残疾的首要原因[1]。脑卒中具有发病率高、死亡率高和致残率高等特点[1]。有研究发现,TNF-α诱导的内皮细胞损伤会引起血脑屏障受损,进而影响脑缺血的再灌注并对患者造成不可逆的损伤[2]。但如何保护TNF-α诱导的内皮细胞损伤导致的血脑屏障受损等方面的研究较少,因此,开展此方面的研究不仅有助于寻求有效的治疗药物,同时对该病的治疗也具有重要的临床指导意义。
二苯乙烯苷(2,3,5,4′-Tetrahydroxystilbene-2-O-β-D-glucoside,TSG)是蓼科蓼族植物何首乌的主要成分之一,是一种天然植物性抗毒素,其在抗氧化应激以及抗炎症等过程中均具有较好的疗效[3]。虽然已有研究证明TSG的抗炎、抗氧化功能,但是其能否保护由TNF-α诱导的内皮细胞损伤以及其保护机制仍有待进一步探讨。本研究拟观察TSG对TNF-α诱导的人脑微血管内皮细胞损伤的保护作用,并通过检测NF-κB信号通路进一步研究TSG如何保护由TNF-α诱导的人脑微血管内皮细胞损伤,为脑卒中的预防和治疗提供理论依据。
1 材料方法
1.1 实验材料
人脑微血管内皮细胞系购自ATCC(编号:CRL-1730);DMEM细胞培养基购自Invitrogen公司;Western-blot试剂购自上海碧云天生物技术有限公司;CCK-8试剂盒购自上海生物工程有限公司;兔抗caspase-3抗体、β-actin抗体、p65抗体购自美国Cell Signaling Technology公司。
1.2 人脑微血管内皮细胞的培养
先对人脑微血管内皮细胞系进行复苏,待其细胞密度足够大时进行传代培养,具体操作如下:先取出细胞培养瓶,加入一定浓度的胰蛋白酶消化至细胞变圆,然后加入 DMEM 培养基停止消化,并用吹打管将细胞吹散后移至离心管,1000rpm 离心5min,加入含10%胎牛血清的DMEM培养基并分装至两个细胞瓶中,于5% CO2、37℃下环境下进行培养。
1.3 CCK-8法检测细胞活性
将长势良好的细胞均匀接种至96孔板,每孔含100μL细胞培养液,边缘孔用150μLPBS填满后置培养箱中培养。待细胞生长至16~18 h时,用TSG(2.5、5.0、10.0、20.0μmol/L)或PTHC(20、40、80、160μmol/L)对细胞进行预处理,随后用60 ng/mL的TNF-α刺激细胞。刺激24h后取出96孔板,弃上清,每孔加入150μLCCK-8,孵育2 h后用酶标仪检测OD值并计算细胞活力。细胞活力(%)=[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。(实验组:TSG处理组;对照组:TNF-α刺激组;空白组:加入PBS溶液)[4]。
1.4 Western-blot
用Sample buffer收集处理过的细胞,经超声波破碎后离心取上清,100℃煮沸5min使蛋白充分变性。粗蛋白经SDS-PAGE胶分离后将其转印到PVDF膜上,用5%的脱脂牛奶室温封闭2h。封闭完毕后取出膜,用TBST洗两次,每次5min,然后孵育一抗,4℃过夜。一抗孵育完毕后,用TBST洗膜4次,每次10min。二抗孵育以及清洗方法同一抗。孵好的膜用ECL发光液浸泡1min后即可进行曝光[5]。
1.4 统计学方法
实验数据采用SPSS 17.0 统计软件进行分析,多组间比较采用单因素方差分析(Oneway-ANOVA),P<0.05表示有统计学差异。
2 结果
2.1 TSG对TNF-α诱导的HBMECs活力的影响
为了探讨TSG是否会影响经TNF-α诱导的HBMECs的活力,我们用CCK-8法测试了经过处理的HBMECs的活力。从图1可以看出,TNF-α刺激组细胞活性较对照组(未用TNF-α刺激)明显降低;而TSG处理组细胞活性随TSG浓度增加而增强并表现出剂量依赖性。当TSG浓度为10μmol/L时,细胞活力达到最高水平。由于TSG浓度10μmol/L和20μmol/L间无统计学差异,因此可选10μmol/L为最佳处理浓度,见图1。 结果说明,TSG能够抑制TNF-α诱导的HBMECs细胞活力降低。
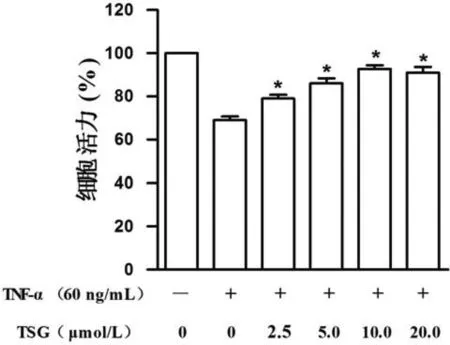
图1 TSG对TNF-α诱导HBMECs活力的影响与TNF-α刺激组相比*表示p<0.05Fig.1 The effect of TSG on the activity of HBMECs induced by TNF-α compared with the group induced by TNF-α *p<0.05
2.2 TSG对TNF-α诱导的HBMECs的NF-κBp65、caspase-3蛋白表达的影响
前面已有实验证实TNF-α能诱导NF-κB p65、caspase-3等信号通路表达并导致细胞损伤[2],为进一步研究为什么TSG能够抑制TNF-α诱导的HBMECs细胞活力降低,我们用Western-blot对NF-κB p65、caspase-3等信号通路进行了检测。Western-blot结果显示,经TNF-α处理过的HBMECs中NF-κB p65、caspase-3的蛋白表达明显上升,这和以前报道的结果类似[2],说明我们的实验处理是成功的。相反,经TSG处理后的HBMECs中p65、caspase-3蛋白的水平则明显降低,说明TNF-α能刺激NF-κB p65、caspase-3的表达,而TSG则能抑制NF-κB p65、caspase-3的表达。接下来我们又检测了用TSG处理过的经过TNF-α诱导HBMECs细胞中p65和caspase-3的表达水平。结果发现,与TNF-α单独处理组相比,用TSG和TNF-α同时处理的细胞中p65和caspase-3的表达水平明显降低,表明TSG对TNF-α诱导的HBMECs损伤有保护作用,见图2。
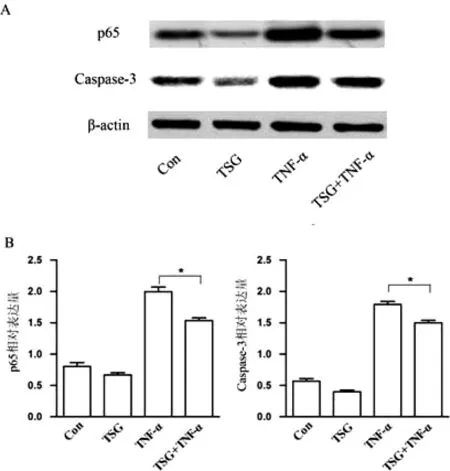
图2 TSG对TNF-α诱导的HBMECs p65、caspase-3蛋白表达的影响.*表示P<0.05Fig.2 The effect of TSG on the protein expression of p65 and caspase-3 in HBMECs induced by TNF-α *p<0.05
2.3 NF-κB抑制剂PDTC能够减轻TNF-α引起的HBMECs损伤
接下来,为进一步验证上述结果,我们用不同浓度的NF-κB抑制剂PDTC对TNF-α诱导的HBMECs细胞进行了处理,并检测了其细胞活力。如图3所示,相较于对照组(0μmol/L PDTC)而言,80以及160μmol/L的PDTC能够显著提升细胞存活率,说明PDTC能够减轻TNF-α引起的HBMECs损伤,同时也进一步说明TSG对TNF-α诱导的HBMECs损伤保护与NF-κB通路密切相关。
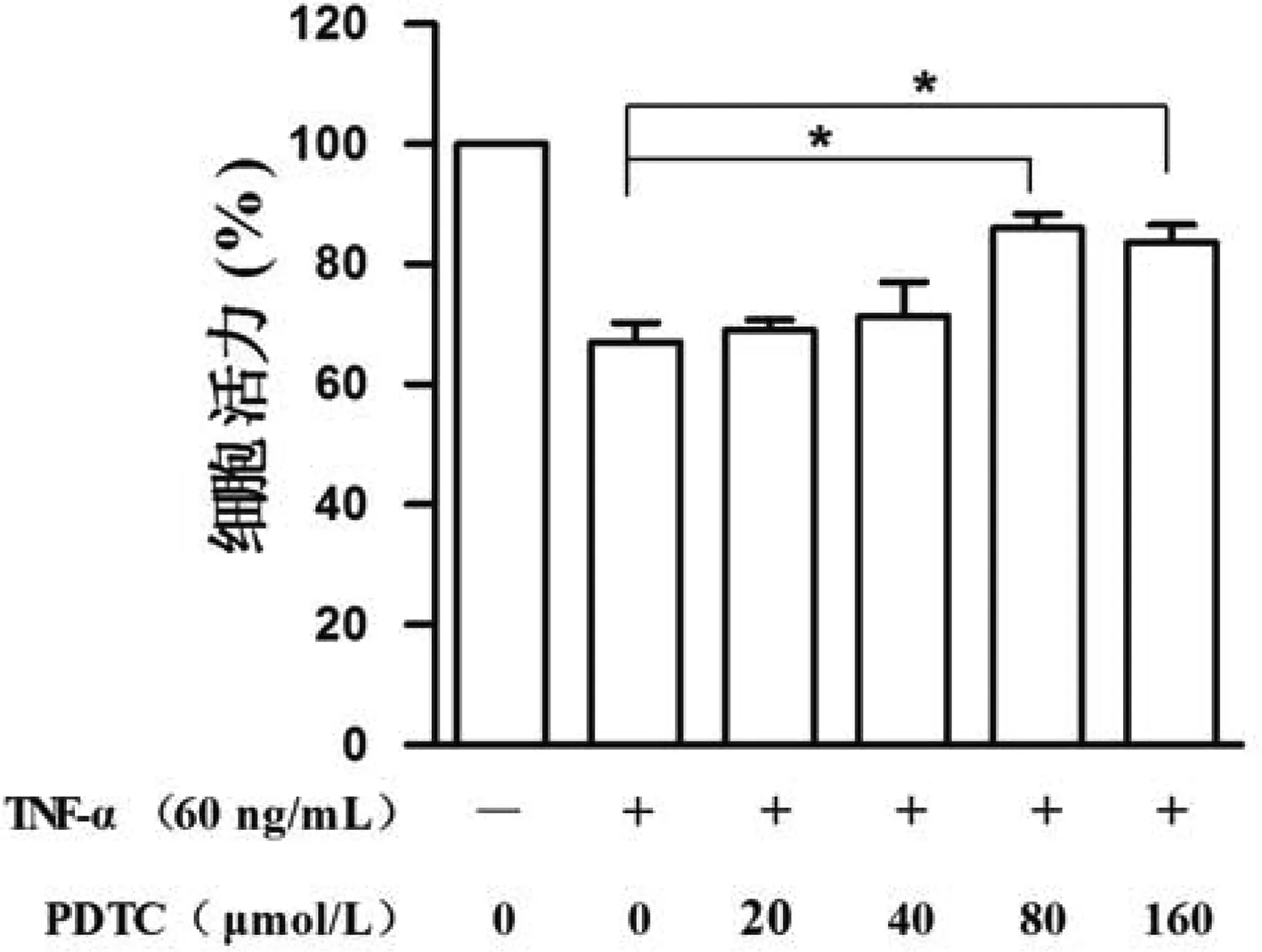
图3 NF-κB抑制剂PDTC减轻TNF-α引起的HBMECs损伤;*表示P<0.05Fig.3 NF-κB inhibitor PDTC alleviates HBMECs damage caused by TNF-α *p<0.05
3 讨论
随着人们生活水平的不断提高,脑卒中的发病率也呈逐年上升之势。吸烟、不健康的饮食以及高血压均是脑卒中发生的高危因素[6]。脑卒中症状主要表现为一侧脸部、手臂或腿部突然感到无力,猝然昏倒并不省人事等,如不及时采取治疗措施可危及生命。研究表明,脑卒中会刺激机体发生炎症反应,进而产生炎性因子破坏血脑屏障,进一步诱发水肿和出血[4]。本研究发现,二苯乙烯苷能有效抑制TNF-α诱导的人脑微血管内皮细胞损伤,其对预防和治疗脑卒中的发生具有重要的临床意义。此外,TSG主要是通过抑制NF-κB信号通路来减轻TNF-α诱导的人脑微血管内皮细胞损伤。
二苯乙烯苷又称芪多酚,属多羟基芪类化合物(polyhydrostilbenes),广泛存在于藓类和高级植物中。TSG 是一种植物抗毒素,由植物在真菌感染、紫外线照射、机械损伤等不利条件下刺激产生。研究发现,二苯乙烯苷具有多种生理活性与药用价值,已在降血脂、抗衰老、抑制肿瘤等方面显示出功能,这在当今日趋老龄化的社会中凸现其重要的研究和开发价值[7]。最新研究表明,TSG可以作用于神经元细胞并显著降低其活性氧水平,从而发挥相应的保护作用[8]。此外,TSG还能通过抑制NF-κB的磷酸化达到抗神经炎症的作用[9]。本研究中,我们发现TSG同样可作用于人脑微血管内皮细胞,并有效抑制TNF-α引起的损伤,这对保护血脑屏障、减少中风损伤有着重要意义。
NF-κB是一个转录因子蛋白家族,其中包括p65亚单位。作为早期转录因子,NF-κB的激活不需要新翻译出的蛋白进行调控。大多数的细菌可以结合细胞膜表面的受体,从而激活NF-κB信号通路影响相关基因的表达[10]。不少研究已经表明广泛存在于革兰氏阴性菌表面的LPS可以通过TLR4激活下游NF-κB信号通路[11]。Caspase-3是一种细胞凋亡过程中最主要的终末剪切酶,同时也是CTL细胞杀伤机制的重要组成部分,它与细胞凋亡的发生密切相关[12]。本研究结果显示,TNF-α刺激HBMECs后,能够使NF-κB p65、caspase-3的蛋白表达明显上升,这与之前报道相符。而经TSG处理后HBMECs中p65、caspase-3蛋白的水平则明显降低,说明TSG对TNF-α诱导HBMECs损伤的保护作用可能与NF-κB信号通路有关。
综上所述,二苯乙烯苷能够通过调节NF-κB信号通路来减轻TNF-α引起的人脑微血管内皮细胞损伤,这对脑卒中患者的治疗以及保护血脑屏障有着重要的临床意义。
[1]黄震华.缺血性脑卒中治疗进展[J].中国新药与临床杂志,2009,28(01):62-65.
[2]罗心静,莫选荣,周玲玲.TNF-α诱导类风湿关节炎滑膜细胞NF-κB信号通路活化的探讨[J].免疫学杂志,2012,28(04):321-323,332.
[3]李彩蓉,甘受益,黄红霞,等.二苯乙烯苷对糖尿病大鼠心肌损伤的保护作用[J].中国药理学通报,2016,32(03):410-415.
[4]刘爱旗,夏璐.CCK-8法与MTT法检测兔成纤维细胞活性的比较研究[J].中国医学创新,2013,10(02):12-13.
[5]蒋鸿涛,吴涛,章运生,等.盐霉素及mTOR信号通路对前列腺癌DU145干细胞的影响[J].实用医学杂志,2017,13(13):2092-2096.
[6]王雅婵,张博爱.脑卒中复发的相关危险因素分析[J].河南医学研究,2017,26(20):3685-3686.
[7]马剑波,孙恺,马冲,等.青年脑卒中研究进展[J].中华神经创伤外科电子杂志,2016,2(01):45-50.
[8]张又枝,黄琦,闵清,等.二苯乙烯苷对载脂蛋白E基因敲除小鼠动脉粥样硬化的防治作用[J].医药导报,2017,36(01):13-16.
[9]王佳妮,李小静,李涛,等.TSG-6促进瘢痕疙瘩成纤维细胞凋亡及其NF-κB信号通路影响的实验研究[J].安徽医科大学学报,2017,52(09):1266-1270.
[10]李亦晗,王跃飞,朱彦.何首乌二苯乙烯苷抗衰老研究进展[J].中国中药杂志,2016,41(02):182-185.
[11]侯林,薛海南,于峰,等.特润舒都乐水母液浸膏对LPS诱导RAW264.7细胞TLR4/NF-κB信号通路及TNF-α表达的影响[J].包头医学院学报,2017,33(08):75-77,101.
[12]ZHU Baosong,XING Chungen,LIN Fang,et al.Blocking NF-kB nuclear translocation leads to p53-related autophagy activation and cell apoptosis[J].World Journal of Gastroenterology,2011,17(04):478-487.

