MRI鉴别诊断原发性中枢神经系统淋巴瘤与高级别胶质瘤深部病灶
耿 磊,孙 毅,孙志先,汪秀玲,徐 凯
(1.连云港市第二人民医院医学影像科,江苏 连云港 222000;2.徐州医科大学附属医院医学影像科,江苏 徐州 221002)
原发性中枢神经系统淋巴瘤(primary central nervous system 1ymphoma, PCNSL)是一种较少见的中枢神经系统肿瘤,占颅内肿瘤的3%~5%[1],近年发病率明显增加[2]。位于颅底区或距皮质深度超过25 mm的病灶定义为脑深部病灶。化疗是治疗脑深部PCNSL的主要方法,可显著提高患者生存率,甚至部分病灶可完全消失[3]。脑深部高级别胶质瘤(high grade glioma, HGG)的治疗方法以手术为主。PCNSL与HGG单发病灶的临床表现无明显差异,细针穿刺活检确诊率不足30%[4]。术前采用无创方式鉴别诊断PCNSL与HGG对选择临床治疗方式,尤其减少不必要的开颅率至关重要[5]。本研究旨在探讨MRI鉴别诊断PCNSL与HGG的价值。
1 资料与方法
1.1 一般资料 收集2010年1月—2017年1月徐州医科大学附属医院经临床及病理确诊的脑深部PCNSL患者28例(PCNSL组),其中男18例,女10例,年龄15~73岁,平均(58.9±10.3)岁。临床表现为头痛、头晕、恶心、视物模糊、言语不清、肢体无力及精神行为异常等。患者均无器官移植史、免疫功能缺陷病史,并经影像及其他检查排除系统性淋巴瘤。另选择同期经本院确诊的脑深部HGG患者(WHO分级为Ⅲ~Ⅳ级)30例(HGG组),其中男18例,女12例,年龄16~72岁,平均(49.9±11.3)岁。
1.2 仪器与方法 采用GE Signal 3.0T MR扫描仪。患者均接受MR平扫+增强及DWI。扫描序列包括SE T1W(TR 200 ms,TE 15 ms)、T2W(TR 4 300 ms,TE 120 ms)、FLAIR(TR 8 000 ms,TE 150 ms)及SE-EPI DWI(TR 4 00 ms,TE 100 ms),层厚6 mm,间隔1.5 mm。增强扫描时经肘静脉注射对比剂Gd-DTPA,剂量0.20 mmol/kg体质量,观察肿瘤部位、形态、有无囊变坏死或出血,占位程度,瘤周水肿程度,强化方式,增强形态。肿瘤占位和瘤周水肿程度参照文献[6]标准分为无或轻度、中度、重度。在肿瘤强化明显的实质区勾画30~40 mm2的ROI,并测量表观扩散系数(apparent diffusion coefficient, ADC)值3次,取平均值;同时选取对侧正常脑白质相同面积ROI作为对照,测量ADC值3次,取平均值;最后获得相对ADC(relative ADC, rADC)值。
1.3 统计学分析 采用SPSS 17.0统计分析软件。计量资料以x±s表示,采用χ2检验比较2组患者MR征象的差异;采用两独立样本t检验比较2组患者的ADC及rADC值的差异;采用配对t检验比较2组患者肿瘤与对照侧脑白质ADC值的差异。绘制ROC曲线,分析ADC、rADC值鉴别诊断PCNSL与HGG的效能。P<0.05为差异有统计学意义。
2 结果
2.1 MRI表现 PCNSL:病灶均为单发,位于幕上深部脑组织22例、脑干脑桥区1例、深部小脑半球3例、鞍区1例、3脑室1例。病灶长径1.1~5.5 cm。MR平扫示肿瘤实质部分呈T1WI低信号、T2WI稍高信号,6例有囊变、坏死、出血。23例病灶邻近或累及中线结构或脑室。肿瘤占位程度:轻度20例、中度7例、重度1例。瘤周水肿程度:轻度18例,中度5例,重度5例。增强示26例病灶呈团块状或结节状明显均匀强化,其中“缺口征”和/或“尖角征”样强化13例(图1A),类圆形强化13例;2例呈环形强化。
HGG:病灶均为单发,位于幕上深部脑组织28例、桥脑小脑角2例。平扫示肿瘤实性部分呈T1WI低信号、T2WI高信号,28例合并囊变坏死或出血。肿瘤占位程度:轻度18例、中度10例、重度2例。瘤周水肿程度:轻度11例、中度12例、重度7例。增强示20例呈环形不均匀强化(图2A),8例呈团块状或结节状强化,2例呈“尖角征”样强化。
脑深部PCNSL与HGG在囊变、坏死、出血发生率(χ2=27.977,P<0.001)及增强形态上(χ2=27.242,P<0.001)差异有统计学意义,在肿瘤占位程度(χ2=0.908,P=0.635)和瘤周水肿程度(χ2=4.842,P=0.089)上差异无统计学意义。
2.2 DWI表现 28例PCNSL中,24例肿瘤实质呈高或稍高信号(图1B),ADC伪彩图呈低或稍低信号(图1C);4例肿瘤实质呈等信号,ADC伪彩图呈等信号。30例HGG中,13例肿瘤实性呈高或稍高信号(图2B),ADC伪彩图呈高或稍高信号(图2C);13例呈肿瘤实质等信号,ADC伪彩图呈等信号;4例肿瘤实质呈低信号,ADC图呈等或稍高信号。PCNSL与HGG患者的DWI信号强度差异有统计学意义(χ2=13.813,P=0.001)。PCNSL与HGG组病灶ADC值、rADC值差异有统计学意义(P<0.001),对侧脑白质ADC值差异无统计学意义(表1)。PCNSL组病灶ADC值显著低于对侧脑白质(t=-6.108,P<0.001)、HGG组病灶实质ADC值明显高于对侧脑白质(t=5.747,P<0.001)。以ADC=0.86×10-3mm2/s为界值,其鉴别诊断PCNSL与HGG的敏感度、特异度和准确率分别为92.9%、80.0%和86.2%,曲线下面积为0.946(P<0.001);以rADC=1.02为界值,其鉴别诊断PCNSL与HGG的敏感度92.9%,特异度86.7%,准确率89.7%,曲线下面积为0.957(P<0.001;表2,图3)。
表1 两组病灶ADC值、对侧ADC值及rADC值比较(±s)
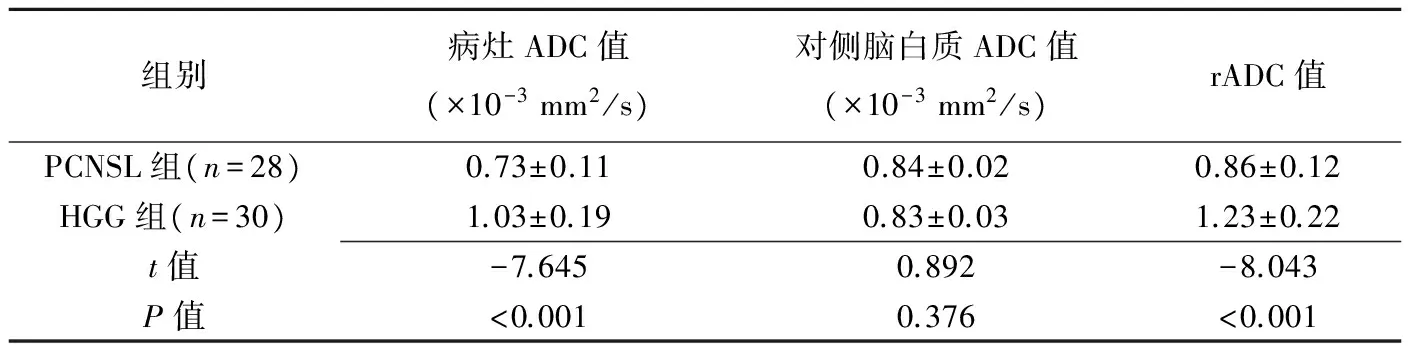
表1 两组病灶ADC值、对侧ADC值及rADC值比较(±s)
组别病灶ADC值(×10-3mm2/s)对侧脑白质ADC值(×10-3mm2/s)rADC值PCNSL组(n=28)0.73±0.110.84±0.020.86±0.12HGG组(n=30)1.03±0.190.83±0.031.23±0.22t值-7.6450.892-8.043P值<0.0010.376<0.001
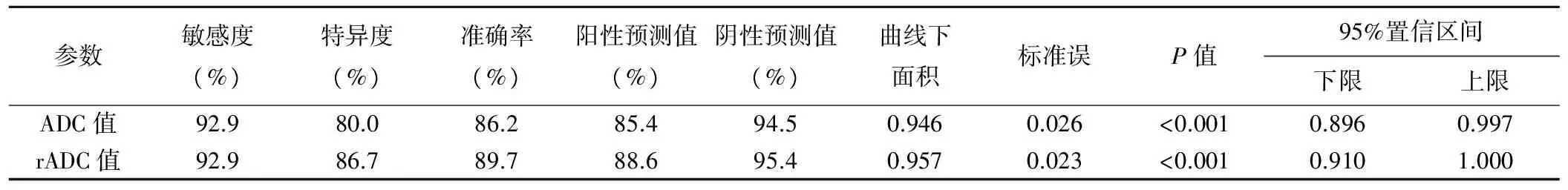
表2 ADC、rADC值鉴别诊断PCNSL与HGG的效能
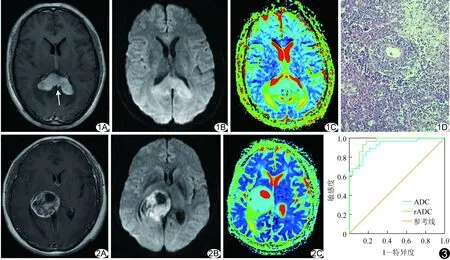
图1 患者男,42岁,胼胝体PCNSL A.增强T1WI示病灶呈明显欠均匀强化,侵及邻近室管膜,见“尖角征”样改变(箭); B.DWI示病灶呈基本均匀高信号; C.ADC伪彩图示病灶为低信号,ADC值为0.66×10-3 mm2/s、rADC值为0.78; D.病理图示肿瘤细胞密集,核浆比高,呈弥漫浸润性生长,在血管壁周围间隙聚集,形成“袖套状”结构(HE,×200) 图2 患者女,47岁,右侧丘脑HGG A.增强T1WI示病灶呈不均匀环形强化,边界不清; B.DWI示病灶呈不均高信号; C.ADC伪彩图示病灶呈等高信号,ADC值为1.03×10-3 mm2/s、rADC值为1.21 图3 ADC值、rADC值鉴别诊断PCNSL与HGG的ROC曲线
2.3 病理表现 根据2008年WHO分类标准,PCNSL组中,弥漫大B细胞淋巴瘤27例,NK/T淋巴细胞瘤1例;镜下示肿瘤细胞密集,呈弥漫浸润性生长,在血管壁周围间隙聚集,形成“袖套状”结构(图1D)。HGG组中,WHO分级为Ⅲ级12例,Ⅳ级18例。
3 讨论
PCNSL可发生于颅内任何部位,好发于邻近中线结构的深部脑实质,以血管周围间隙为中心向外浸润性生长,故肿瘤多靠近或累及中线结构和/或脑室。PCNSL囊变、坏死、出血少见,增强后呈明显均匀强化,典型者可出现“缺口征”、“尖角征”等征象,可能与PCNSL乏血供、肿瘤破坏血脑屏障使对比剂外溢所致的均匀强化方式、肿瘤生长速度不均衡及肿瘤生长过程中受血管阻挡等有关[5,7]。
本组PCNSL患者中,6例出现囊变坏死,2例呈环形强化,提示PCNSL可能存在富血供以及伴发的囊变坏死等与HGG表现相似,此时鉴别诊断较困难。DWI是无创性检测活体组织内水分子扩散运动的方法,可弥补常规MRI的不足。因PCNSL肿瘤细胞多而密实,其细胞外间隙相对较少,同时细胞内水分子黏滞度高,肿瘤组织内水分子扩散受限,故肿瘤实质DWI多呈高信号,ADC值降低[8]。本组PCNSL在DWI上表现为高或稍高信号,而HGG信号变化相对繁多。此外,本研究还发现部分HGG(13/30)患者表现为ADC值升高但DWI呈高信号的矛盾现象,Guo等[9]认为这并非是组织真实的弥散受限,而是由T2穿透效应导致;ADC值可消除T2穿透效应、各向异性以及弥散敏感梯度等影响,反映肿瘤组织真实的弥散情况[8]。近年研究[10-14]认为PCNSL的ADC值为(0.57±0.14)×10-3mm2/s~(1.01±0.16)×10-3mm2/s,HGG的ADC值为(0.91±0.16)×10-3mm2/s~(1.37±0.54)×10-3mm2/s,DWI表现及ADC值对PCNSL的诊断具有重要意义。本研究PCNSL组中病灶ADC及rADC值分别为(0.73±0.11)×10-3mm2/s和0.86±0.12,均低于HGG组[(1.03±0.19)×10-3mm2/s、1.23±0.22],差异有统计学意义(P均<0.001),提示PCNSL的肿瘤弥散受限程度高于HGG。以ADC值=0.86×10-3mm2/s和rADC=1.02为界值时鉴别诊断PCNSL与HGG的价值较高,与Ahn等[15]报道类似。Choi等[12]指出单独使用ADC鉴别诊断PCNSL与HGG的效能相对较低(AUC=0.744),而ADC值联合动态增强MRI可显著提高诊断效能(AUC=0.886)。本研究引入rADC值,消除微循环灌注、脉搏搏动、白质纤维弥散各项异性等因素对ADC值的影响,可改善系统误差,增加个体间的可比性,更有利于测量指标的量化。
此外,本研究PCNSL和HGG的ADC值、rADC值与既往研究[10-14]存在一定差异,笔者分析原因为:①研究主体不一致,本研究仅局限于脑深部单发PCNSL与HGG;②肿瘤异质性产生测量结果的不一致;③ROI的面积和数量不同。本研究的局限性为研究样本量有限,存在抽样误差。
总之,MRI可为PCNSL与HGG的诊断与鉴别提供丰富的参考信息,为临床制定治疗方案及评估预后提供可靠的依据。
[1] Gallop-Evans E. Primary central nervous system lymphoma. Clin Oncol, 2012,24(5):329-338.
[2] Novakovic BJ. Treatment outcomes and survival in patients with primary central nervous system lymphomas treated between 1995 and 2010—a single centre report. Radiol Oncol, 2012,46(4):346-353.
[3] Hoang-Xuan K, Bessell E, Bromberg J, et al. Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients: Guidelines from the European Association for Neuro-Oncology. Lancet Oncol, 2015,16(7):e322-e332.
[4] 李秀梅,曹代荣,李银官,等.颅脑原发性恶性淋巴瘤的CT和MRI征象分析.中国CT和MRI杂志,2008,6(1):59-63.
[5] 陈其钻,王守森,刘峥,等.原发性中枢神经系统淋巴瘤的影像学研究.中华神经外科杂志,2017,33(2):173-177.
[6] 王莹,张波,骆继业,等.原发性中枢神经系统淋巴瘤常规及功能磁共振成像特点.中国介入影像与治疗学,2017,14(10):618-622.
[7] Malikova H, Koubska E, Weichet J, et al. Can morphological MRI differentiate between primary central nervous system lymphoma and glioblastoma. Cancer Imaging, 2016,16(1):40.
[8] Koubska E, Weichet J, Malikova H, et al. Central nervous system lymphoma: A morphological MRI study. Neuro Endocrinol Lett, 2016,37(4):318-324.
[9] Guo AC, Cummings TJ, Dash RC, et al. Lymphomas and high-grade astrocytomas: Comparison of water diffusibility and histologic characteristics. Radiology, 2002,224(1):177-183.
[10] 马新星,陈铟铟,王中领,等.原发性中枢神经系统淋巴瘤与胶质瘤的DWI对比研究.放射学实践,2012,27(5):493-497.
[11] 耿磊,汪秀玲,徐凯.原发性中枢神经系统淋巴瘤MRI表现及ADC值、rADC值与Ki-67、bcl-2表达的相关性研究.临床放射学杂志,2016,35(12):1790-1795.
[12] Choi YS, Lee HJ, Ahn SS, et al. Primary central nervous system lymphoma and atypical glioblastoma:Differentiation using the initial area under the curve derived from dynamic contrast-enhanced MR and the apparent diffusion coefficient. Eur Radiol, 2017,27(4):1344-1351.
[13] Gadda D, Mazzoni LN, Pasquini L, et al. Relationship between apparent diffusion coefficients and MR spectroscopy findings in high-grade gliomas. J Neuroimaging, 2017,27(1):128-134.
[14] 王玉亮,赵静,李欣蓓,等.扩散峰度成像在胶质瘤分级和预测细胞增殖中的诊断效能.中国医学影像技术,2017,33(2):177-182.
[15] Ahn SJ, Shin HJ, Chang JH, et al. Differentiation between primary cerebral lymphoma and glioblastoma using the apparent diffusion coefficient: Comparison of three different ROI methods. PLoS One, 2014,9(11):e112948.

