纳米银抗菌产品体外细胞毒性测定
张昦昉,王璐茜,卢海霞,姚春涛,王钧
(吉林省药品检验所,吉林 长春 130033)
引言
纳米银抗菌机制尚不明确,有研究表明:纳米银能够使酶失活,干扰呼吸代谢;能够增加细胞膜的通透性[1];可损伤细菌的DNA[2]。细胞毒性试验是利用体外细胞培养方法来评价生物材料和医疗器械或浸提液潜在的细胞毒性,细胞毒性试验是生物安全评价体系中重要的检测指标之一。本研究采用MTT 法考察样品的体外细胞毒性,为纳米银抗菌产品的体外安全性评价和标准的制定提供参考。
1 材料与仪器
1.1 材料 L929 细胞,购自中国科学院上海细胞生物研究所;DMEM 高糖培养基,HyClone 公司;胎牛血清,GIBCO;MTT,北京鼎国昌盛生物技术有限责任公司。
1.2 仪器 超净工作台,苏净安泰;二氧化碳培养箱,Thermo;酶标仪,BIO-RAD。
2 实验方法
2.1 细胞株及培养基 L929 细胞,采用含10%胎牛血清的DMEM 完全培养基培养。
2.2 样品配制 采用1 号、2 号、3 号、4 号、6 号样品,其中1 号、4 号、6 号样品为液体,2 号、3 号样品为浸膏。1 号、4 号、6 号样品的配制:取1 号、4 号、6 号样品,0.25μm 滤膜过滤除菌,即得原液。取适量原液,加入含10%胎牛血清的DMEM 完全培养基,稀释至1/5原液、1/10 原液、1/30 原液、1/100 原液、1/300 原液、1/1000 原液。2 号、3 号样品的配制:称取适量2 号、3号样品,加入含10%胎牛血清的DMEM 完全培养基,制得浓度为0.2 mg/ml 的原液,0.25μm 滤膜过滤除菌。取适量原液,加入含10%胎牛血清的DMEM 完全培养基,稀释至1/5 原液、1/10 原液、1/30 原液、1/100 原液、1/300 原液、1/1000 原液。
表1 受试物对体外细胞相对增值率和细胞毒性评级的影响(,d)
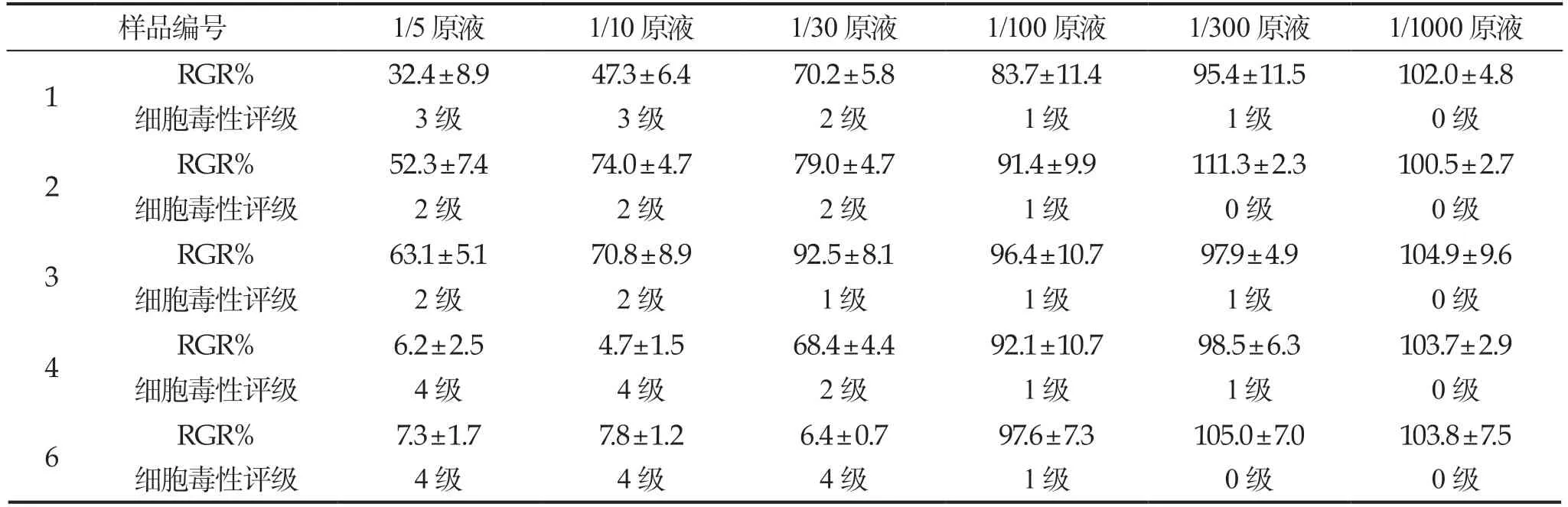
表1 受试物对体外细胞相对增值率和细胞毒性评级的影响(,d)
2.3 MTT 试验 取生长状态良好的L929 细胞,消化,调整细胞密度,均匀接种到96 孔板内。24 h 后,倒置显微镜下观察细胞形态,吸弃培养液,加入受试物100μl,阴性对照组加入完全培养基100μl,继续培养48 h。48 h 后,每孔加入20μl MTT(5 mg/ml),继续培养4 h 后,吸弃孔内液,加入DMSO150μl,震荡10 min,500 nm处测定吸光度值。
3 评价标准
采用细胞相对增值率(relative growth rate,RGR)评价细胞毒性:
0 级为RGR ≥100%,1 级为80%-99%,2 级为50%-79%,3 级为30%-49%,4 级为0-29%
4 结果
4.1 对细胞形态的影响 在倒置显微镜下放大200 倍观察可见,阴性对照孔内细胞形态多成梭形或多边形,疏松贴壁,无胞浆内颗粒。在不同的受试物中,细胞毒性分为2 级的孔内细胞多数呈梭形或多边形,部分细胞呈圆形,无胞浆内颗粒,明显可见细胞溶解和细胞间空区;细胞毒性分级为3 级的孔内细胞多数变圆漂浮、脆核固缩、胞内形成许多空泡,细胞溶解;细胞毒性分级为4 级的孔内细胞大多数呈圆形或溶解,细胞层几乎完全破坏。
4.2 受试物对体外细胞相对增值率和细胞毒性评级的影响5 种受试物的体外细胞相对增值率和细胞毒性评级结果见表1。结果表明,受试物不同浓度对细胞相对增值率差异较大,当稀释比为1:100 时,细胞毒性均显著降低。
5 结论
纳米银具有较广的抗菌谱,对大肠杆菌、淋球菌、沙眼衣原体等均都有抑制和杀灭作用,且不易产生耐药性。纳米银的抗菌特点被广泛应用,但其安全性有待于深入研究[3]。本研究表明,受试物不同浓度对细胞相对增值率差异较大,当稀释比为1:100 时,细胞毒性均显著降低。

