重症监护室低心排出量综合征患者采取亚低温处理联合血液净化治疗的临床效果研究
邱合信,邢疆波
(河南省省立医院 重症医学科,河南 郑州 450000)
低心排出量综合征(low cardiac output syndrome, LCOS)是重症加强护理病房(intensive care unit, ICU)心脏手术患者常见且严重的并发症,临床发生率约20%[1],LCOS也是导致患者死亡的高危因素,术后及时纠正氧供失衡,并采取血液净化清除炎性递质和毒性物质是降低患者死亡率的关键措施。本次研究基于以上背景,对亚低温联合血液净化治疗LCOS的效果进行了探讨,现报道如下。
1 资料与方法
1.1 一般资料
选取本院2012年3月‐2017年4月收治的138例低心排出量综合征患者为研究对象,以简单随机法将其分为对照组和联合组,每组患者各69 例。对照组患者,男37例,女32例;年龄31~76岁,中位年龄52.17岁。联合组患者,男38 例,女31例;年龄32~77岁,中位年龄53.21岁。本院医学伦理委员会对此研究已认证通过;两组患者基线资料比较差异无统计学意义(P>0.05),具有可比性。
纳入和排除标准:①入选患者均符合《心脏外科手术技巧》[2]中所述的全身麻醉体外循环下心脏手术适应证,均为心脏瓣膜病患者,符合LCOS指征,且体温调节功能正常;②排除合并冠状动脉粥样硬化性心脏病和体温调节机制异常者;③ 入选患者治疗前均与本院签署《疗效研究观察知情同意书》。
1.2 方法
两组患者均采取德国贝朗血液净化系统进行治疗,治疗模式为连续静脉-静脉血液滤过(continuous veno-venous hemofiltration, CVVH),置换液采用改良Port配方,前稀释无抗凝和生理盐水冲管法,置换液量控制在35~45 ml/(kg·h),血流量180~220 ml/min,持续24 h。对照组患者在CVVH过程中对血滤机进行加温,保持患者肛温在36.0~37.3℃;联合组患者采取血滤机亚低温处理,分为诱导期、维持期和复温期3个阶段,诱导期输注4℃的0.9%氯化钠溶液,30 ml/kg,降温速度0.5~1.0℃/h,5 h内将肛温降至33℃;维持期以冰毯降低体温,肛温维持33℃,持续24 h;复温期停用冰毯,自然复温。
1.3 观察指标
血液净化72 h后观察如下指标:①急性生理与慢性健康评分(acute physiology and chronic health evaluation II, APACHE II)[3],理论总分 71 分,分值越高表示病死风险越高;②多器官功能不全评分(multiple organ dysfunction syndrome, MODS)[4],理论总分20分,分值越高表示死亡风险越高;③ 心指数(cardiac index, CI);④氧摄取率(oxygen extraction ratio, ERO2);⑤患者留置ICU时间;⑥ 并发症发生情况和死亡情况。
1.4 统计学方法
应用SPSS 19.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;中位年龄采用非参数秩和检验;计数资料以百分比(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者 APACHE II、MODS、CI、ERO2和留置ICU时间比较
联合组患者APACHE II、MODS和留置ICU时间均低于对照组患者(P<0.05);联合组患者心指数(CI)、氧摄取率(ERO2)均高于对照组患者(P<0.05)。见表 1。
2.2 两组患者并发症发生情况和死亡情况比较
联合组患者并发症发生率、死亡率分别为14.49%(10/69)、2.90%(2/69),均低于对照组患者的43.48%(30/69)、13.04%(9/69);两组患者并发症发生率、死亡率比较差异均有统计学意义(P<0.05),见表 2。
表1 两组患者APACHE II、MODS、CI、ERO2和留置ICU时间比较 (±s)
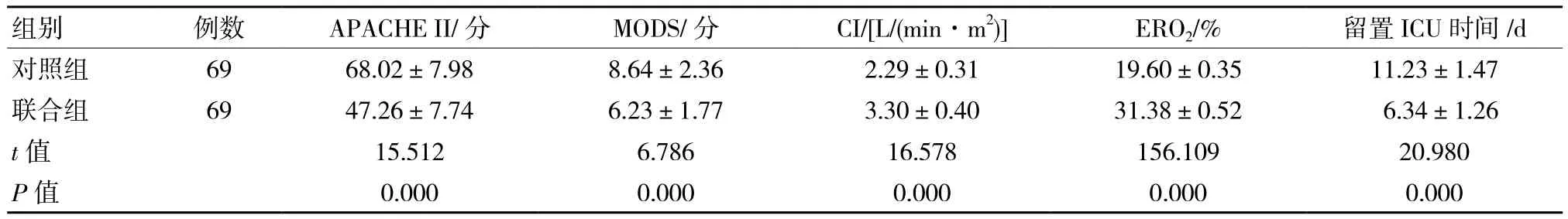
表1 两组患者APACHE II、MODS、CI、ERO2和留置ICU时间比较 (±s)
组别 例数 APACHE II/分 MODS/分 CI/[L/(min·m2)]ERO2/% 留置ICU时间/d对照组 69 68.02±7.98 8.64±2.36 2.29±0.31 19.60±0.35 11.23±1.47联合组 69 47.26±7.74 6.23±1.77 3.30±0.40 31.38±0.52 6.34±1.26 t值 15.512 6.786 16.578 156.109 20.980 P值 0.000 0.000 0.000 0.000 0.000
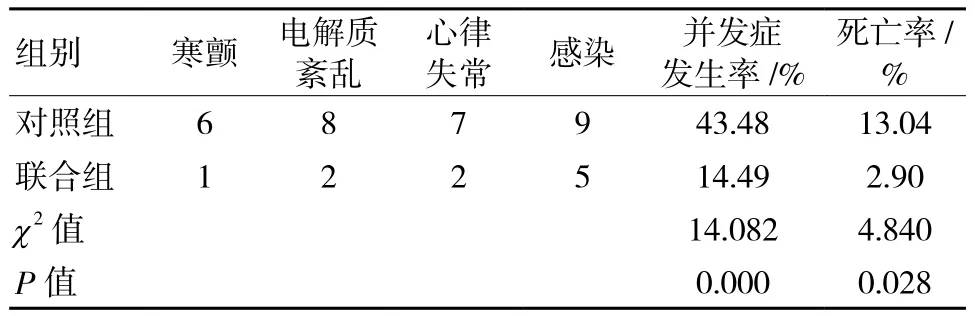
表2 两组患者并发症发生情况和死亡情况比较 例
3 讨论
临床认为LCOS病发机制不仅与炎性递质的超量分泌表达有关,而且与宿主抗炎递质和内源性抑制因子表达异常有关[5]。患者因机体全身缺血导致多脏器功能损伤,或因缺血再灌注时导致脏器受损,进而出现一系列病理生理病变[6]。临床通常采取血液净化治疗,具有改善氧合和保护心肌的效果,可通过滤除过多水分减少心脏前负荷,并清除心脏抑制因子和炎性递质,纠正LCOS内环境紊乱状态[7]。
传统血液净化主要采取肛门常温治疗,但在患者氧供严重降低、氧供需求失衡的状态下,常温处理对心脏做功和基础代谢量的降低效果不明显,仍然会导致LCOS病情进展,延长患者ICU留置时间;陈志刚等[8]认为,人体体温与基础代谢有显著相关性,体温每降低1℃,基础代谢可减少约13%,在LCOS治疗期间,中心血温从37.5℃降至34℃后可让机体代谢减少约45%,因此采取亚低温治疗可让LCOS患者获益。本次研究认为,亚低温处理可有效减少心肌耗氧量,抑制患者心肌缺血状态下腺苷三磷酸(adenosine triphosphate,ATP)消耗速度和乳酸堆积,缓解低灌注导致的心肌损伤和破坏性强的过氧化损伤,改善氧合作用,减少心肌做功,并提高患者对机体缺血缺氧的耐受性,从而提高CI和ERO2,有效降低APACHE II和MODS评分,对寒颤、心律失常、感染和电解质紊乱等急慢性生理指征和多器官衰竭前兆有显著的预防作用,有利于患者心功能恢复和临床转 归。
综上所述,在血液净化治疗的基础上采取亚低温处理有利于维持LCOS患者器官功能正常,值得临床应用。
[1]任安立, 陈新涛, 范艳芳. 亚低温血液净化在心脏瓣膜病术后低心排血量综合征治疗中的应用效果分析[J]. 中华临床医师杂志(电子版), 2015, 9(5): 755-758.
[2]王春生. 心脏外科手术技巧(精)[M]. 第2版. 上海: 上海科学技术出版社, 2014: 89-90.
[3]南玲, 刘丁, 方清永, 等. 重症监护病房患者APACHE II评分与医院感染相关性分析[J].实用预防医学, 2015, 22(12):1465- 1566.
[4]魏亮, 王琦, 杨成, 等. 亚低温治疗对脑出血所致MODS的影响[J]. 昆明医科大学学报, 2016, 37(12): 57-61.
[5]Hazrati E, Rafii MR, Kazemihaki B, et al. The effect of selenase on the disease process of patients with septic shock admitted to the intensive care unit: a clinical trial in Tehran[J]. Jornal Brasileiro De Pneumologia, 2015, 32(1): 29-34.
[6]Avilaalvarez A, Mj DCM, Bautistahernandez V. Pulmonary vasodilators in the management of low cardiac output syndrome after pediatric cardiac surgery[J]. Current Vascular Pharmacology,2016, 14(1): 37.
[7]赵晓琪, 谷天祥, 喻磊, 等. 亚低温联合持续肾脏替代治疗对心脏外科术后重症心力衰竭的效果研究[J]. 中国胸心血管外科临床杂志, 2016, 23(2): 205-207.
[8]陈志刚, 刘长, 易欣, 等. 早期采用亚低温配合参附注射液治疗心脏骤停后综合征的临床效果[J]. 安徽医药, 2016, 20(12):2339-2343.

