海参铜锌超氧化物歧化酶原核表达载体的构建、表达及活性鉴定
车 明 月, 穆 贤, 李 学 一, 张 齐, 丛 丽 娜, 牛 庆 昌, 李 成
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
自由基是机体正常代谢的产物,参与生物体的多种生化过程,如胞内信号转导、细胞生长、免疫、防御等[1-3]。过多的自由基可造成生物膜脂质过氧化损伤,DNA/RNA/氨基酸氧化交联,从而破坏其具有的结构或功能[7]。直接补充外源性抗氧化酶(SOD、CAT)能有效帮助机体清除过多的活性氧,减轻或阻止氧化损伤[8-10]。
海参能很好地抵御氧化胁迫型环境带来的氧化损伤,其超氧化物歧化酶(SOD1)是机体自身抗氧化损伤的重要组成部分[9-11]。研究海参种属SOD1具有很高的开发前景和应用价值;同时,作为辽宁省重要的海产养殖经济物种,研究开发海参SOD1,可以很好地提高其经济附加值。实验利用体外重组表达的Aj-SOD1,并检验其活性,以期为深入研究Aj-SOD1性质提供理论基础。
1 材料和方法
1.1 材 料
1.1.1 海参来源及处理
海参采购于大连新长兴海参市场。在实验室条件下,对海参进行饥饿处理3~5 d,清空肠组织。
1.1.2 菌种与试剂
大肠杆菌DH5α、BL21(DE3),本实验室保存。质粒提取试剂盒,北京天根生化科技有限公司;Protein markers,大连宝生物有限公司;Ni2+-NTA 亲和层析填料,GE healthcare公司;其他试剂均为国产分析纯。
1.2 方 法
1.2.1 提取海参肠组织总RNA
采用Trizol法提取海参肠组织的总RNA。1.5%的琼脂糖凝胶电泳验证RNA提取情况。
1.2.2 反转录cDNA第一链
参照反转录试剂盒使用说明,以海参肠组织总RNA为模板,反转录获得cDNA第一链。
以反转录产物为模板,采用Aj-β-actin 特异性引物:P1-AGTATTTCCTCTCTCTGGTGGAGCG和P2-TCATCACCATTGGCAACGAAAGGT扩增海参β-actin基因片段(278 bp),琼脂糖凝胶电泳验证后,检测反转录后的结果。PCR扩增条件:94 ℃,5 min;94 ℃,30 s;55 ℃,30 s;72 ℃,30 s,扩增30 cycles。
1.2.3 扩增海参SOD1全长cDNA序列
以反转录获得的cDNA为模板,通过引物P3-ATGCTCTACAAGCCGTTTGCGTTT和P4-TTAGACCTGTTTGATACCAATGA,扩增海参SOD1蛋白的全长编码序列(459 bp)。PCR条件:94 ℃,5 min;94 ℃,30 s;55 ℃,30 s;72 ℃,30 s,扩增30 cycles。1.5%琼脂糖凝胶电泳验证结果。通过TA克隆构建克隆质粒pMD18-Aj-SOD1,测序验证。
1.2.4 构建海参SOD1重组表达载体
以pMD18-Aj-SOD1为模板,通过引物P5-CATATGATGCTCTACAAGCCGTTTGCGTTT (NdeⅠ)和P6-CTCGAGTTAGACCTGTTTGATACCAATGA (XhoⅠ),扩增带有酶切位点的SOD1基因片段,构建克隆载体pMD18-Aj-SOD1 (XhoⅠ/NdeⅠ)。分别对其和表达载体pET30a进行双酶切,构建重组表达载体pET30a-Aj-SOD1,并转化大肠杆菌DH5α感受态细胞。菌落PCR检测阳性转化子,并测序验证。
1.2.5 海参SOD1蛋白的诱导表达
将重组表达质粒pET30a-Aj-SOD1转化到大肠杆菌表达宿主BL21(DE3)中,37 ℃、180 r/min过夜活化。按1%的接种量放大培养。当菌液OD600在0.6~0.8,加入0.1 mmol IPTG、100 μmol/mL 的CuSO4和ZnCl2。诱导表达8 h后,SDS-PAGE电泳检测海参SOD1蛋白的表达情况。
1.2.6 邻苯三酚自氧化法检测海参SOD1活性
以BL21(DE3)/pET30a空载体为阴性对照,根据吸光度的变化,利用紫外分光光度计在320 nm 处测定SOD1活性[12],检测条件见表1。
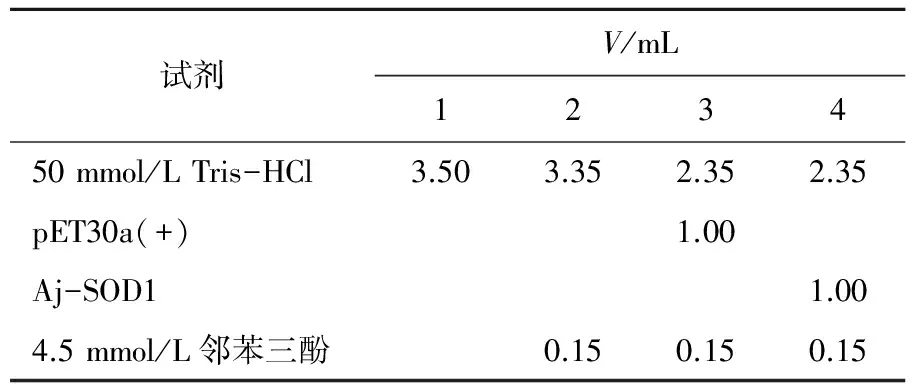
表1 海参SOD1活性的检测条件
2 结果与讨论
2.1 海参肠组织总RNA的提取及反转录
利用Trizol法提取海参肠组织的总RNA,琼脂糖凝胶电泳检测结果如图1所示。结果表明,成功地从海参肠组织提取了总RNA,且其纯度较高,无明显降解和污染,完全符合后续实验要求。
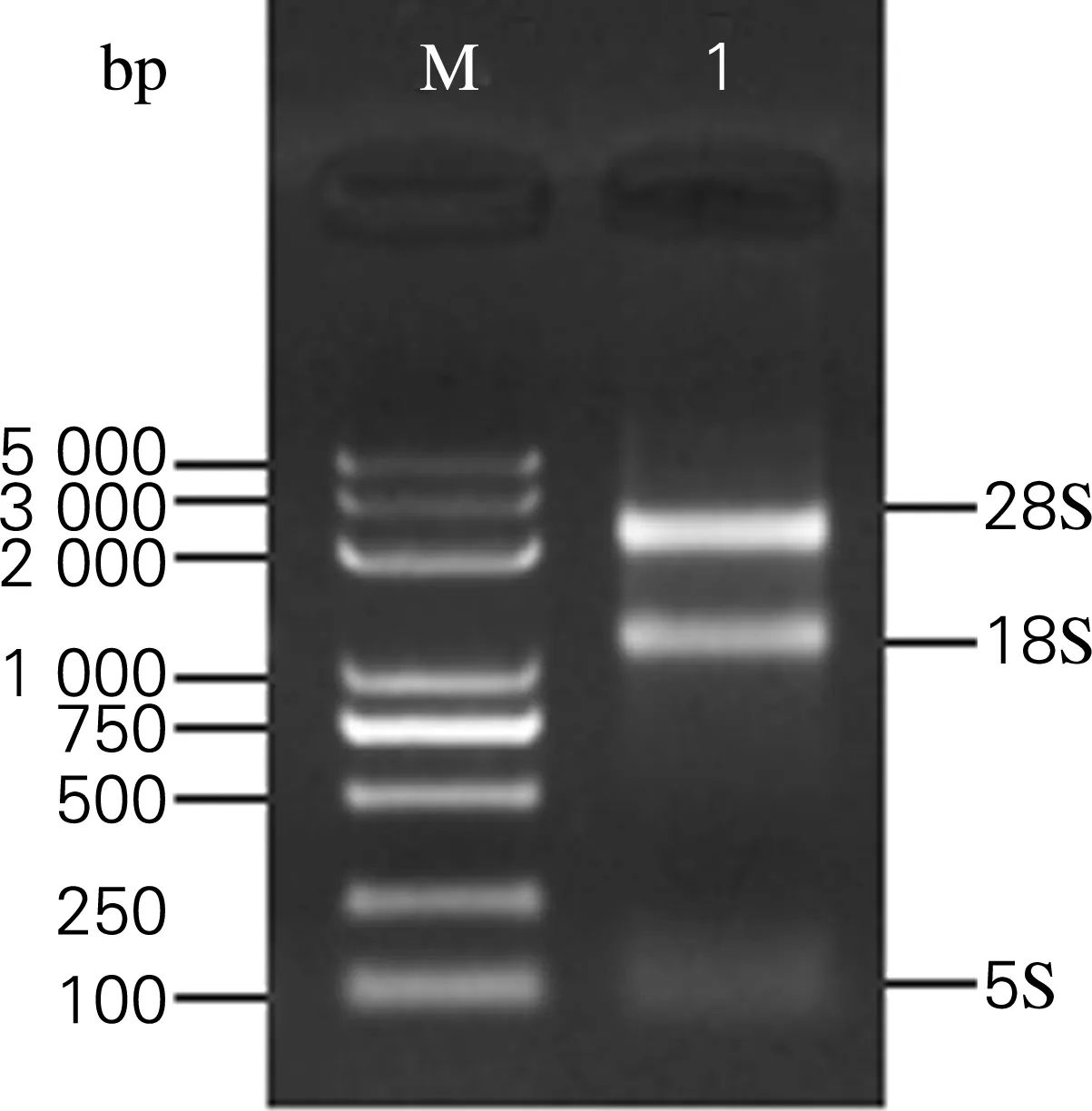
图1 海参肠总RNA的提取
Fig.1 Extraction of total RNA from intestinal tissue ofApostichopusjaponicusdetected by agarose gel electrophoresis
以海参肌动蛋白(β-actin)为内参基因,通过引物P1/P2,检测反转录情况。结果表明,mRNA成功地反转录成cDNA。
2.2 Aj-SOD1的扩增及克隆载体的构建
按照图2中的方案,以cDNA为模板,根据Aj-SOD1上下游引物P3/P4,扩增其全长CDS编码序列。鉴定结果如图3所示,在400~500 bp有一条明亮的单一条带,为459 bp,通过TA连接构建到克隆载体pMD18-T上,并转化到大肠杆菌。挑取的阳性转化子经过测序比对与NCBI数据库上Aj-SOD1基因序列完全一致。结果表明,实验成功地获得了Aj-SOD1的全长编码基因,并构建了含有Aj-SOD1基因的克隆载体pMD18-Aj-SOD1。
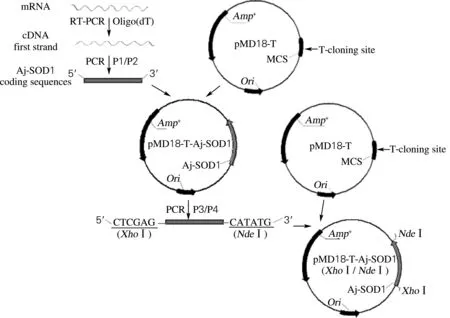
图2 克隆载体pMD18-Aj-SOD1的构建
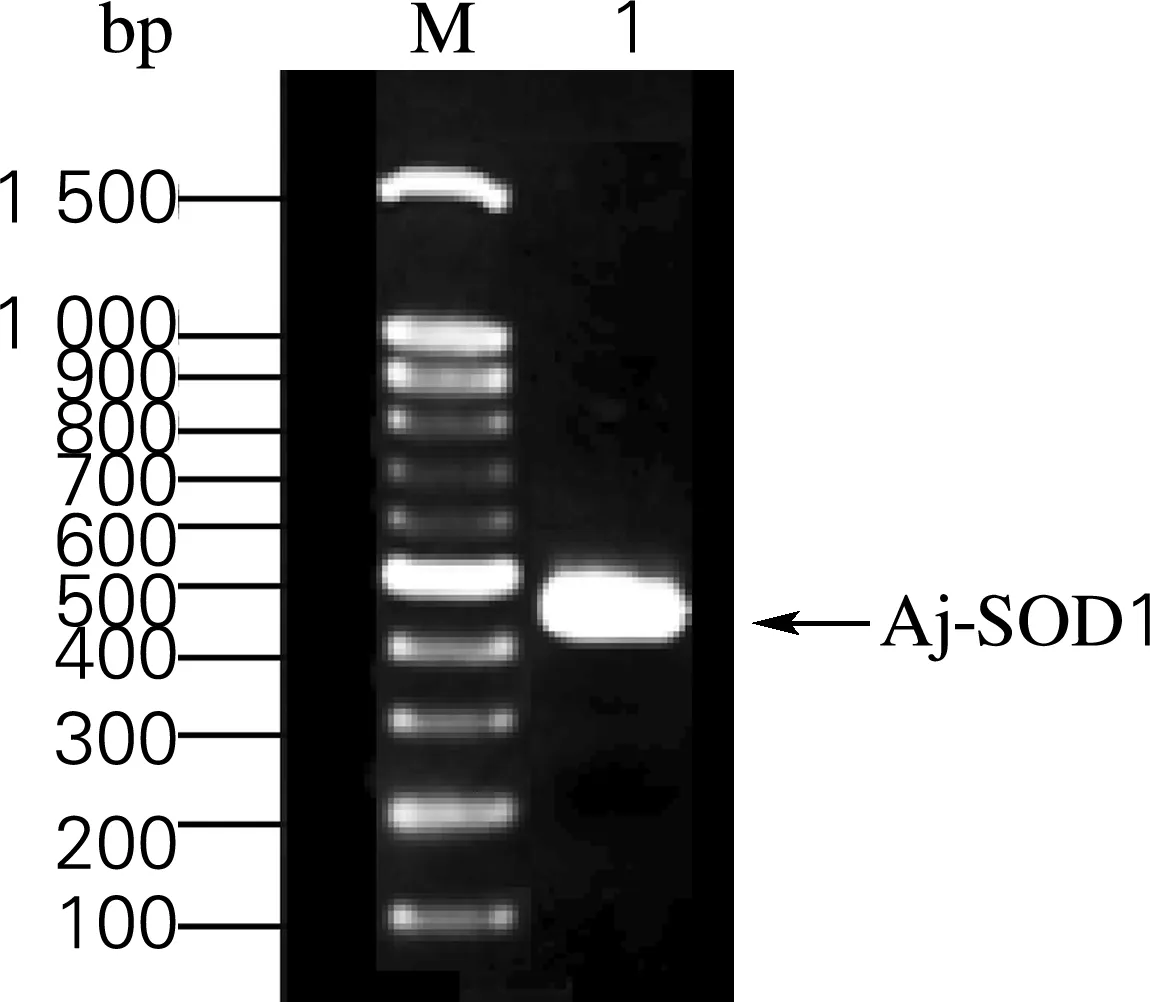
图3 凝胶电泳检测Aj-SOD1基因扩增
2.3 Aj-SOD1表达载体的构建及转化、筛选
根据方法“1.2.4”,在克隆载体pMD18-SOD1目的基因序列上下游引入NdeⅠ和XhoⅠ酶切位点,获得新的克隆载体pMD18-Aj-SOD1,方案如图4所示。分别对克隆载体pMD18-Aj-SOD1和表达载体pET-30a(+)进行双酶切,获得线性表达载体大片段和Aj-SOD1目的基因小片段,结果如图5所示。
将获得的基因片段和表达载体进行T4连接,构建重组表达载体pET30a-Aj-SOD1。对阳性转化子进行菌落PCR检测,结果如图6所示,在分子质量约400~500 bp处出现明显条带。测序结果表明,实验成功构建海参超氧化物歧化酶重组表达质粒pET30a-Aj-SOD1。
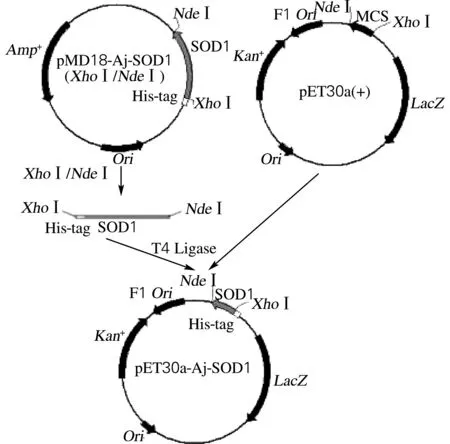
图4 表达载体pET30a-Aj-SOD1构建方案
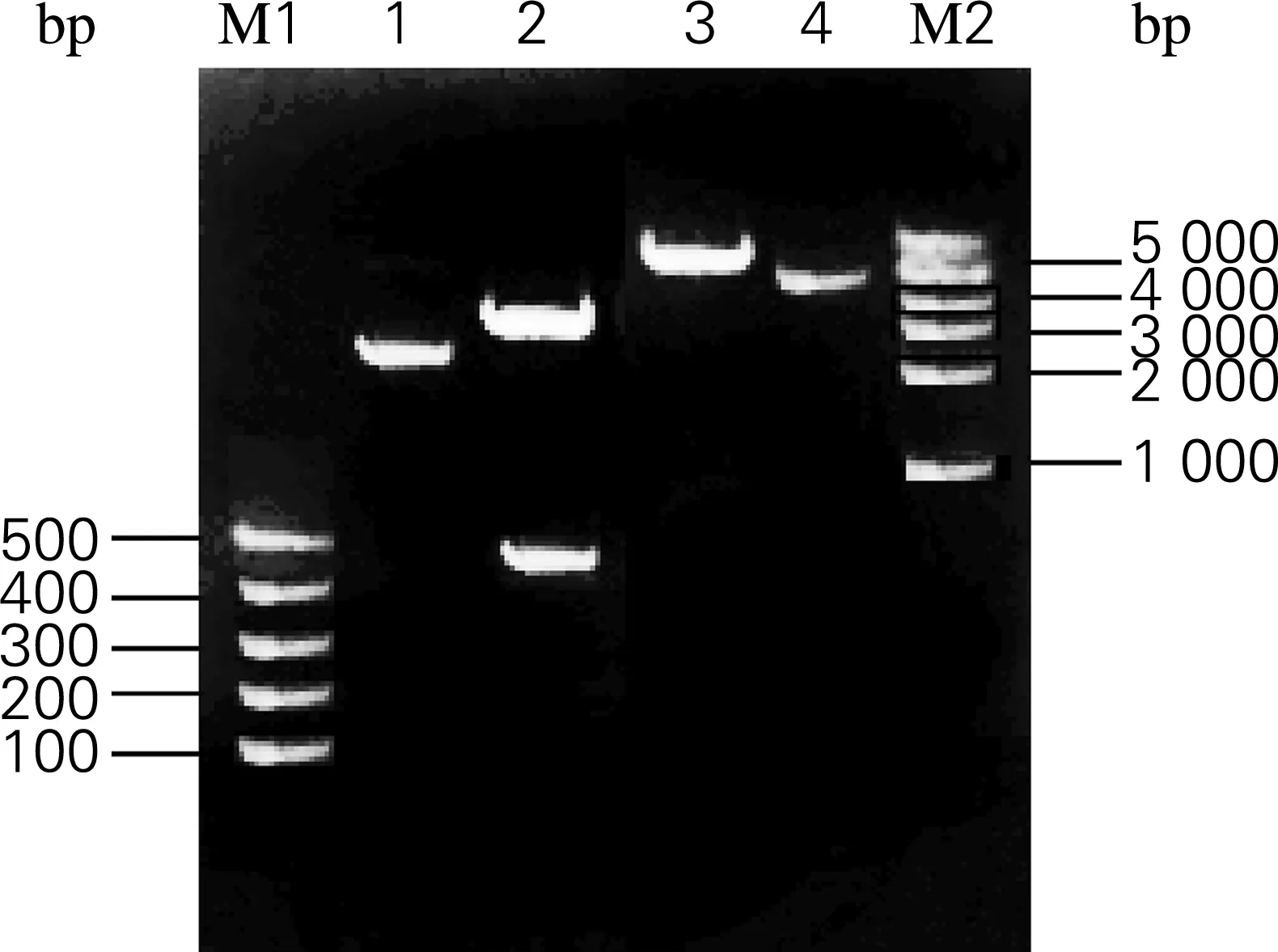
M1,100 bp DNA marker;M2,1 kb DNA marker;1,pMD18-Aj-SOD1酶切前;2,pMD18-Aj-SOD1酶切后;3,pET30a(+)酶切前;4,pET30a(+)酶切后
图5 pMD18-Aj-SOD1和pET30a(+)双酶切结果
Fig.5 Double enzyme digestion of pMD18-Aj-SOD1 and pET30a(+) detected by gel electrophoresis
2.4 Aj-SOD1蛋白表达及诱导条件
构建海参超氧化物歧化酶的原核表达系统BL21(DE3)/pET30a-Aj-SOD1。对其进行IPTG诱导,表达海参超氧化物歧化酶目的蛋白。检测结果如图7所示,空载体无论是上清还是沉淀几乎没有Aj-SOD1蛋白表达,而基因工程菌BL21(DE3)/pET30a-Aj-SOD1上清与沉淀相比明显在上清中的表达量更高,杂带较少。与阴性对照菌株比较,经IPTG诱导后,在15 ku附近出现一条明显的蛋白条带,与预测的Aj-SOD1的分子质量为14.956 ku基本相符。
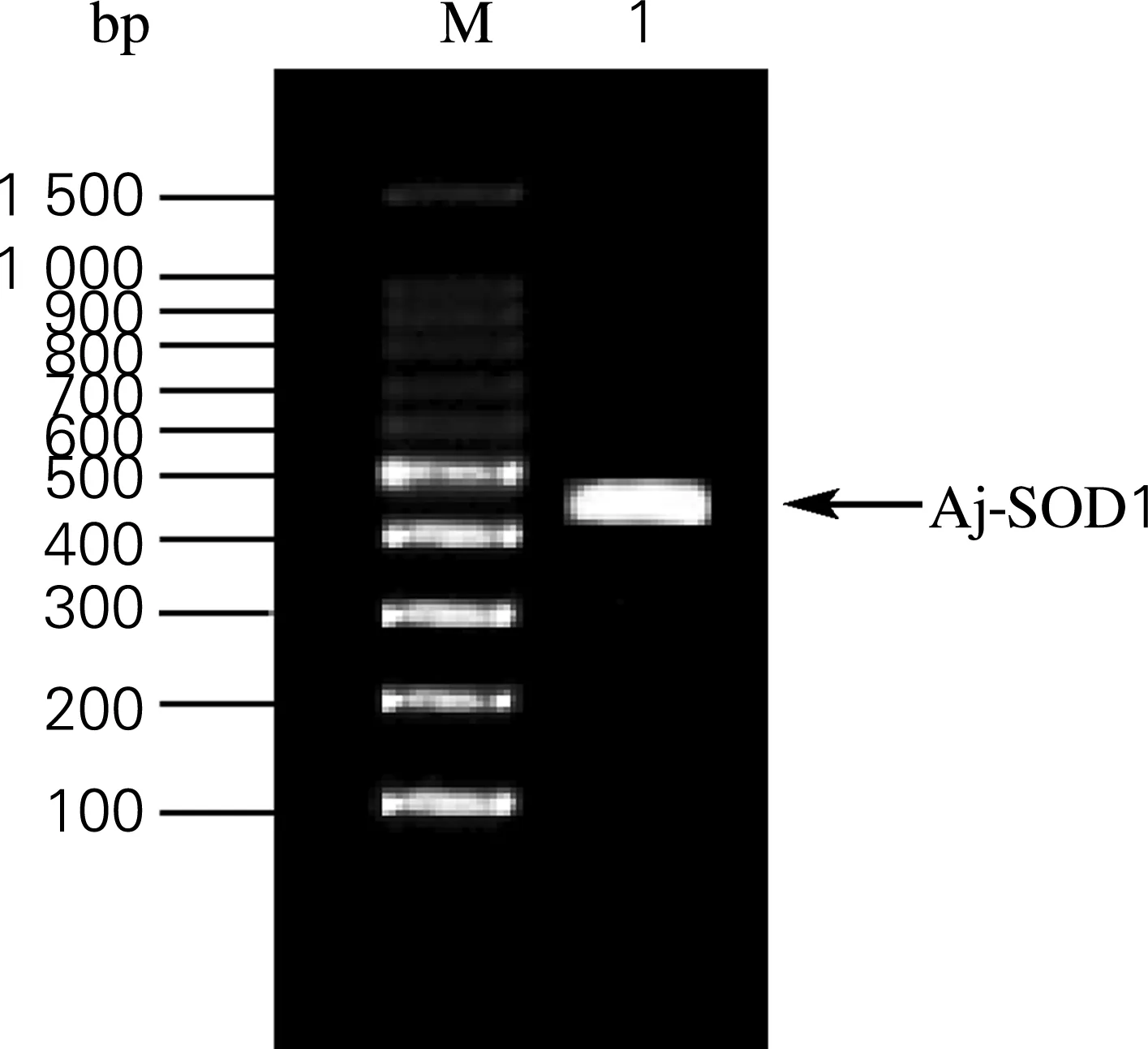
图6 Aj-SOD1基因扩增的结果检测
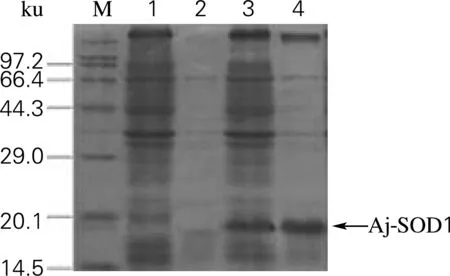
M,标准蛋白marker;1,空载BL21(DE3)/pET30a诱导8 h 后的破菌沉淀;2,空载BL21(DE3)/pET30a诱导8 h后的破菌上清;3,BL21(DE3)/pET30a-Aj-SOD1诱导8 h后的破菌沉淀;4,BL21(DE3)/pET30a-Aj-SOD1诱导8 h后的破菌上清
图7 SDS-PAGE凝胶电泳检测Aj-SOD1蛋白的表达
Fig.7 Aj-SOD1 expression result detected by SDS-PAGE
实验结果表明,基因工程菌成功表达了可溶的仿刺参超氧化物歧化酶蛋白。蛋白表达条件为0.1 mmol/L IPTG、37 ℃、180 r/min条件下诱导8 h,体外成功获得高表达、可溶性的海参蛋白SOD1。
2.5 海参SOD1抗氧化活性
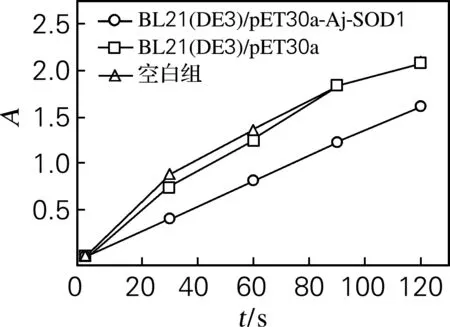
图8 邻苯三酚法检测海参SOD1蛋白的抗氧化性
Fig.8 Antioxidant activity of Aj-SOD1 protein determined by pyrogallol oxidation method
3 结 论
通过反转录体外获得海参SOD1蛋白的基因编码序列,经酶切、连接成功构建目的基因表达载体pET30a-Aj-SOD1。借助原核表达宿主BL21(DE3),体外成功诱导表达了具有抗氧化活性的海参超氧化物歧化酶蛋白。
[1] 张俊艳,贺阳.超氧化物歧化酶研究与应用[J].食品工业,2012,33(3):119-122.
[2] 张笑天,郑晓瑛.氧化自由基清除剂超氧化物歧化酶与疾病[J].中国公共卫生,2014,33(10):1349-1352.
[3] 张秀娟,黄勋,刘亚伟,等.人铜锌超氧化物歧化酶基因启动子驱动的红色荧光蛋白报告基因载体的构建及表达[J].解放军医学杂志2009,34(1):76-79.
[4] FELICITY J, CECILIA G. Superoxide dismutases and their impact upon human health[J]. Molecular Aspects of Medicine, 2005, 26: 340-352.
[5] 宋凯,宋继梅.人SOD基因的克隆与原核表达[J].动物医学进展,2006,27(12):91-94.
[6] LI J H, TANG C H, SONG C Y, et al. A simple, rapid and effective method for total RNA extraction fromLentinulaedodes[J]. Biotechnology Letters, 2006, 28(15): 1193-1197.
[7] SAH S K, KAUR G, KAUR A. Rapid and reliable method of high-quality RNA extraction from diverse plants[J]. American Journal of Pants Sciences, 2014, 21(5): 3129-3139.
[8] FAN M H, SUN X, XU N J, et al. cDNA cloning, characterization and expression analysis of manganese superoxide dismutase inUlvaprolifera[J]. Journal of Applied Phycology, 2016, 28(2): 1391-1401.
[9] 吴雄辉,孙虹,邢晓为,等.SOD1真核表达载体的构建及表达[J].细胞与分子免疫学杂志, 2010,26(10):962-965.
[10] YI J F, LI Y M, LIU T, et al. Mn-SOD and CuZn-SOD polymorphisms and interactions with risk factors in gastric cancer[J]. World Journal of Gastroenterology, 2010, 16(37): 4738-4746.
[11] PARK K Y, KIM E Y, LEE W, et al. Expression, subcellular localization, and enzyme activity of a recombinant human extra-cellular superoxide dismutase in tobacco (NicotianabenthamianaL.)[J]. Protein Expression and Purification, 2016, 119: 69-74.
[12] 张宏,谭竹钧.四种邻苯三酚自氧化法测定超氧化物歧化酶的方法的比较[J].内蒙古大学学报,2008,50(5):677-681.
[13] 张中林,孙宏伟,郑建玲,等.邻苯三酚法测3种食用菌超氧化物歧化酶(SOD1)活性[J].辽宁中医药大学学报,2009,11(5):185-186.
[14] 程德竹,杜爱玲,李成帅,等.生姜提取物对邻苯三酚自氧化生成超氧自由基的清除[J].中国调味品,2014,25(11):35-39.

