银杏内生菌Endo Gin Ya6胞外多糖的抗氧化性
韦 琮 智, 王 璐, 丛 新 奇, 叶 淑 红
( 大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
银杏多糖是银杏中一种生物活性丰富的重要组成成分[1],研究表明,它具有免疫调节、抗炎、抗衰老、抗肿瘤、降血糖等多种活性作用[2],而这些活性作用与银杏多糖的抗氧化性有着密切的联系[3]。
某些植物内生菌能够产生和宿主植株相同或相近生物活性的物质,利用这一特点,可以从植物中筛选出特定的内生菌,并通过发酵得到大量目的产物[4]。从健康的银杏器官组织中可以筛选出产生与银杏叶多糖结构和功能相似的胞外多糖的内生菌,通过发酵培养从而实现银杏多糖的工业化大规模生产[5],不仅避免了直接提取造成的银杏植株资源枯竭,而且可以不受地理位置和季节气候的限制进行生产[6]。
本实验所用菌种EndoGinYa6是从银杏叶芽中分离,并经过初步筛选后得到的,经鉴定确认其为球形赖氨酸芽孢杆菌,GenBank编号为KY565423.1。王爽[5]已对其胞外多糖发酵条件进行了优化,马志扬[6]对其胞外多糖活性进行了研究。本实验通过研究其胞外多糖的抗氧化性,确定其抗氧化能力,以期为开发和利用天然抗氧化剂在医药和食品等领域中的应用提供理论依据。
1 材料与方法
1.1 材 料
银杏内生菌EndoGinYa6,分离自大连工业大学校园内银杏树,本实验室保藏。培养基:蔗糖12%,酵母浸粉0.8%,氯化钠0.5%,磷酸氢二钾0.1%,氯化钾0.1%,初始pH 7.5。
1.2 方 法
1.2.1 胞外多糖的提取
银杏内生菌EndoGinYa6经发酵后于4 000 r/min 离心15 min去除菌体,取上清液浓缩至原体积的1/4,加入4倍体积的95%乙醇醇沉,冷冻干燥后,制成粗多糖备用。
1.2.2 胞外多糖的纯化
1.2.2.1 脱蛋白及透析
粗多糖溶液用Sevage法脱蛋白,后经透析袋(截留分子质量为5 ku)自来水流水、蒸馏水分别透析48 h,离心去除不溶物,冷冻干燥。
1.2.2.2 DEAE-52纤维素柱层析
胞外多糖配制成30 mg/mL的溶液,上样量3 mL,于DEAE-52离子交换柱(2.2 cm×25 cm),0~0.5 mol/L NaCl梯度洗脱,体积流量1 mL/min,用苯酚-硫酸法测定总糖。单一峰组分经浓缩、透析、冷冻干燥。
1.2.2.3 Sephadex G-100凝胶柱层析
胞外多糖用洗脱缓冲液配制成10 mg/mL的溶液,上样量2 mL,于Sephadex G-100凝胶柱(1.6 cm×50 cm),0.05 mol/L pH 7.6 Tris-HCl缓冲液洗脱。合并单一峰组分,浓缩、透析、冷冻干燥。
1.2.3 多糖抗氧化性测定
1.2.3.1 还原力的测定
取多糖样液1.0 mL,加入0.2 mol/L、pH 6.6的磷酸盐缓冲液2.5 mL,1%铁氰化钾溶液2.5 mL,混匀后置于50 ℃保温20 min,冷却后加入10% TCA。摇匀后离心,取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1%的三氯化铁溶液,摇匀,静置10 min,于700 nm处测定吸光度[7]。以同浓度抗坏血酸作为阳性对照。
1.2.3.2 对DPPH·自由基的清除作用
取多糖样液2.0 mL,加入0.04 mg/mL的DPPH·乙醇溶液2.0 mL,混匀后室温下避光静置30 min,于517 nm处测定吸光度(A)。无水乙醇代替样品溶液的吸光度为空白(A0),无水乙醇代替DPPH·溶液的吸光度为对照(A′),以同浓度的抗坏血酸作为阳性对照[8]。样品对DPPH自由基的清除率按照下式计算:
清除率=[1-(A-A′)/A0]×100%
取50 mmol/L、pH 8.2的Tris-HCl缓冲液4.5 mL,于25 ℃水浴中预热20 min,加入0.1 mL 不同浓度的多糖溶液或抗坏血酸溶液,再加入25 ℃预温的7 mmol/L邻苯三酚溶液0.4 mL,混匀后于25 ℃水浴中反应4 min,加入浓盐酸终止反应,于320 nm处测定吸光度(A1)。蒸馏水代替样品溶液的吸光度为空白(A′0),蒸馏水代替邻苯三酚溶液的吸光度为对照(A′1),以同浓度的抗坏血酸作为阳性对照[9]。样品对超氧阴离子自由基的清除率按照下式计算:
清除率=[1-(A1-A′1)/A′0]×100%
1.2.3.4 对羟自由基(·OH)的清除作用
取多糖样液1.0 mL,加入9 mmol/L FeSO4溶液1.0 mL,9 mmol/L水杨酸-乙醇溶液1.0 mL,8.8 mmol/L的H2O2反应,混匀后于37 ℃ 水浴中反应30 min,于510 nm处测定吸光度(A2)。蒸馏水代替样品溶液的吸光度为空白(A″0),蒸馏水代替过氧化氢溶液的吸光度为对照(A′2),以同浓度的抗坏血酸作为阳性对照[10]。样品对羟自由基的清除率按照下式计算:
清除率=[1-(A2-A′2)/A″0]×100%
2 结果与讨论
2.1 多糖的纯化
2.1.1 脱蛋白及透析
粗多糖经过脱蛋白、透析和乙醇沉淀等处理后,可以脱除大部分的蛋白质、色素和其他小分子杂质,但仍然会有少量的杂蛋白,且多糖组分可能是分子质量大小不同、所带电荷不同的多糖组分混合物,还需要进一步分离纯化处理,得到纯度较高的单一组分多糖。
2.1.2 DEAE-52纤维素柱层析
透析后的多糖经过阴离子交换剂DEAE-52纤维素柱层析,其洗脱曲线如图1所示。胞外多糖被分离成4个峰,表明其至少含有4种多糖组分。首先被蒸馏水洗脱出来为中性多糖,NaCl溶液中的Cl-可以将与离子交换剂结合的多糖组分置换出来,不同离子强度的NaCl溶液可以将带不同电荷数的多糖组分洗脱下来,该组分即为酸性多糖。由图1可知,EPS1为中性多糖,EPS2、EPS3、EPS4为酸性多糖,且EPS2为酸性多糖的主要组分,因此收集EPS1和EPS2备用。

图1 胞外多糖纤维素柱层析洗脱曲线
2.1.3 Sephadex G-100凝胶柱层析
EPS1和EPS2经过Sephadex G-100凝胶柱层析,其洗脱曲线如图2所示。凝胶柱层析可以将相对分子质量不同或者聚合体不等的组分分离。由图2可知,EPS1在洗脱体积为40~120 mL

(a) EPS1
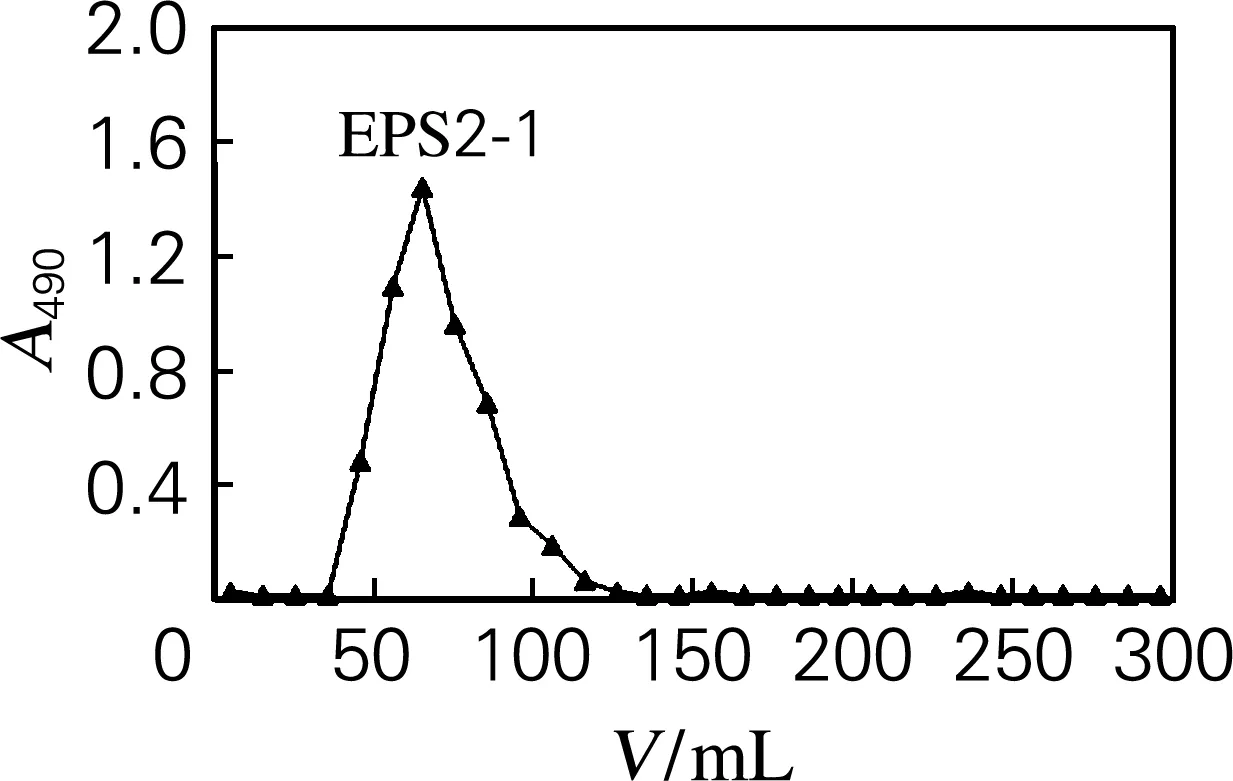
(b) EPS2
图2 EPS1和EPS2在Sephadex G-100凝胶柱的洗脱曲线
Fig.2 Purification of EPS1 and EPS2 by Sephadex G-100
出现单一的对称峰EPS1-1,EPS2在洗脱体积为35~115 mL出现单一的对称峰EPS2-1,这表明EPS1-1为相对分子质量均一的中性多糖,EPS2-1为相对分子质量均一的酸性多糖,经苯酚-硫酸法测定,EPS1-1和EPS2-1的总糖质量分数分别为82.36%和78.23%,分别收集两种组分备用。
2.2 多糖的抗氧化性
2.2.1 多糖总还原力测定
还原力是判断物质抗氧化性强弱的一个重要指标,两种多糖还原力的对比结果如表1所示。由表1可知,多糖质量浓度对其还原力有较显著的影响,还原力的大小随着质量浓度的增大而增大,而EPS2-1的还原力要高于EPS1-1,但总体来说两种多糖与VC相比还原力一般。

表1 EPS和VC的还原力对比
2.2.2 对DPPH·自由基的清除效果
两种多糖对DPPH·清除作用的结果如表2所示。两种多糖对DPPH·的清除能力随着质量浓度的增加而增加,当多糖质量浓度达到0.1 mg/mL 时,EPS1-1和EPS2-1对DPPH·的清除率分别达到34%和48%。当清除率达到50%时,所需的EPS1-1、EPS2-1和VC质量浓度分别为0.139、0.107和0.024 mg/mL,可见两种多糖对DPPH·党政不分清除能力,且EPS2-1的清除能力要高于EPS1-1,但均弱于VC。

表2 EPS和VC对DPPH·的清除率对比
2.2.3 对超氧阴离子自由基的清除效果

表3 EPS和VC对的清除率对比
2.2.4 对羟自由基的清除效果
两种多糖对羟自由基清除作用的结果如表4所示。两种多糖对羟自由基清除能力相仿,在0~1.5 mg/mL范围内,EPS1-1的清除能力略高于EPS2-1,当质量浓度高于1.5 mg/mL时,EPS2-1的清除能力超过了EPS1-1,但相差不大。当清除率达到50%时所需的EPS1-1、EPS2-1和VC质量浓度分别为5.679、4.667和0.283 mg/mL,可见两种多糖对羟自由基的清除能力均弱于VC。

表4 EPS和VC对·OH的清除率对比
两种多糖的抗氧化性强弱顺序为EPS2-1、EPS1-1,这可能是由于酸性多糖EPS2-1分子中含有的酸性基团种类和数量比中性多糖EPS1-1多,而酸性基团和中性基团在自由基清除过程中得失电子的能力不同,从而导致其抗氧化性的差异;也有可能是由于两种多糖的相对分子质量大小存在差异,其大小会影响多糖的分子体积、溶解性和黏度等性质,进一步影响其活性位点,从而导致其抗氧化性的差异。确切的原因还需要进一步对多糖的分子质量、单糖组成及含量、官能团及空间结构进行进一步的研究。
3 结 论
本研究对从银杏中筛选出来的内生菌EndoGinYa6发酵产生的胞外多糖进行了提取和纯化,得到了分子质量单一的中性多糖EPS1-1和酸性多糖EPS2-1,并对其进行了抗氧化性研究。结果表明,两种多糖均有一定的还原力和清除自由基的能力,其中对DPPH·自由基的清除能力较强;与VC相比,3种物质抗氧化能力强弱顺序为VC、EPS2-1、EPS1-1。由许春雨等[10]的研究可知,与其他中药叶类相比,银杏叶多糖具有较好的抗氧化性。而本研究就是选择能够产生胞外多糖的银杏内生菌EndoGinYa6作为发酵菌种,通过研究其胞外多糖的抗氧化性,确定其抗氧化能力,为其替代银杏叶多糖作为天然抗氧化剂在医药和食品等领域中的应用提供了理论依据。
[1] 孙芳,王璐,闫滨,等.银杏叶提取物活性成分及其药理作用[J].山东中医杂志,2014,33(3):221-223.
[2] 张丽娇,费瑞,高立宏,等.银杏多糖的生物活性研究进展[J].安徽农业科学,2009,37(32):16185-16186.
[3] 吴巧攀,乔洪翔,何厚洪,等.银杏叶渣中多糖的提取及其抗氧化活性研究[J].中国现代应用药学,2014,31(1):9-13.
[4] WANG L W, XU B G, WANG J Y, et al. Bioactive metabolites fromPhomaspecies, an endophytic fungus from the Chinese medicinal plantArisaemaerubescens[J]. Applied Microbiology and Biotechnology, 2012, 93(3): 1231-1239.
[5] 王爽.银杏内生菌EndoGinYa6的鉴定及其胞外多糖发酵条件的优化[D].大连:大连工业大学,2015.
[6] 马志扬.银杏内生菌的筛选及其胞外多糖活性的研究[D].大连:大连工业大学,2015.
[7] 陈义勇,冯燕红.微波辅助提取银杏叶多糖工艺及其体外抗氧化活性研究[J].食品科学,2012,33(6):24-28.
[8] HUA D, ZHANG D, HUANG B, et al. Structural characterization and DPPH· radical scavenging activity of a polysaccharide from Guara fruits[J]. Carbohydrate Polymers, 2014, 103: 143-147.
[9] 杨强,李新华,王琳,等.银杏果多糖的物化性质及抗氧化活性研究[J].现代食品科技,2013,29(10):2395-2400.
[10] 许春雨,王爽,王璐,等.银杏叶多糖的制备及其抗氧化性[J].大连工业大学学报,2016,35(4):235-238.

