河蚬多肽螯合亚铁的制备工艺研究
刘晶晶,徐蕴桃,周 蓉,程润青,孙媛媛,王 娟,杜瑜欣
(常熟理工学院生物与食品工程学院,江苏常熟 215500)
河蚬(Corbiculafluminea),又称黄蚬、金蚶、扁螺等,是双壳类软体动物,是我国重要的经济贝类之一。研究表明,河蚬肉中含有大量的蛋白质(干样中粗蛋白含量达66%以上)[1]、多糖等多种营养物质,利用酶水解河蚬蛋白质,可制备低分子肽和氨基酸。由于微量元素与具有特殊生物活性的短肽螯合后,提高了微量元素的吸收率,而且螯合物的抗氧化和抗菌功能也增强。因此,利用短肽与人体所需微量元素制备螯合物受到越来越多学者们的关注。曹银娣等[2]对米蛋白肽螯合铁的条件进行了优化,确定了最佳螯合工艺条件,发现螯合产物的抗氧化和抗菌功能特性提高了;张亚丽等[3]以豆粕酶解液为原料,对多肽络合亚铁的合成工艺条件进行了初步研究;邓尚贵等[4]研究了低值鱼蛋白多肽-铁螯合物,研究发现,多肽亚铁作为一种有机铁,相对于无机盐形式的铁元素更容易被动物体吸收。郑炯等[5]分别将血红蛋白源多肽螯合铁、葡萄糖酸亚铁、氯化亚铁以相同剂量灌输给几组缺铁的白鼠,研究发现,补充血红蛋白源多肽螯合铁组的小鼠血液中血红细胞和铁含量最高。Mimura等[6]进行了甘氨酸亚铁螯合对缺铁病人的治疗效果。Maria等[7]报道了肉类水解物中的肽类能使亚铁离子的可溶性、吸收率提高。
目前补钙、补铁和补锌剂的研究现状,急需研究开发新一代吸收效率高、无毒副作用的微量元素补充剂。本文以河蚬肉为研究对象,利用蛋白酶进行水解得到多肽,再研究河蚬多肽与亚铁离子螯合的最佳工艺条件,为开发新型的微量元素补充剂提供理论依据,同时拓宽河蚬的深加工途径、提高河蚬产品的品质和附加值,实现河蚬的高值化利用。
1 材料与方法
1.1 材料与仪器
河蚬肉 江苏省宿迁市楠景水产食品生产公司;中性蛋白酶(U≥60000 U/g);无水乙醇、双硫腙、盐酸、硫酸亚铁、二甲酚橙、EDTA-2Na、溴化钾 均为分析纯。
HH.S11-2-S型恒温电热水浴锅 上海市新苗医疗设备公司;BCD-216TDXZA型超低温冰箱 青岛海尔股份有限公司;ALPHA1-4型冷冻干燥机 德国MARTIN CHRIST公司;EL104型分析天平 梅特勒-托利多仪器有限公司;722可见分光光度计 上海市菁华科技仪器设备制造有限公司;DL-5-B型离心机 上海市安亨科学仪器制造有限公司;DF-101S型集热式恒温磁力搅拌器 常州市万合仪器制造有限公司;高速组织捣碎机 上海市比朗仪器制造有限公司;pHS-2F型数字pH计 上海市精密科学仪器制造有限责任公司; NICOLET 380型傅立叶变换红外光谱仪 美国Thermo公司。
1.2 实验方法
1.2.1 河蚬多肽的制备 按照参考文献[8]的方法制备,速冻河蚬肉于常温的流水下解冻,添加2倍的纯净水在12000 r/min的高速组织捣碎机中进行匀浆,在匀浆液中加入河蚬肉质量3.76%的中性蛋白酶,于55.36 ℃的水浴中酶解4 h,酶解完成后煮沸20 min,冷却后以4000 r/min的转速进行离心30 min,上清液在-20 ℃温度下进行冷冻干燥10 h,即得河蚬多肽,冷藏待用。
1.2.2 河蚬多肽亚铁螯合的单因素实验 准确称取1.2.1制备的河蚬多肽,配制浓度为10 mg/mL,河蚬多肽溶液与一定量的硫酸亚铁在不同的pH和温度条件下螯合,用磁力搅拌的方式构建螯合环境,螯合结束后,在4000 r/min的条件下离心20 min,加入无水乙醇洗涤直至双硫腙检测上清液不变色(4~5次左右),分别测定螯合率,考察各因素对螯合率的影响。
1.2.2.1 pH对螯合反应的影响 河蚬多肽浓度为10 mg/mL,选定多肽与亚铁离子质量比为2∶1,在30 ℃下螯合45 min,改变多肽溶液pH分别为4.0、5.0、6.0、7.0、8.0,螯合结束后,测定其螯合率,从而筛选最合适的pH。
1.2.2.2 多肽与亚铁离子的质量比对螯合反应的影响 河蚬多肽浓度为10 mg/mL,选定pH为6.0、螯合时间45 min及螯合温度30 ℃,改变多肽与亚铁离子的质量比分别为1∶1、1.5∶1、2∶1、2.5∶1、3∶1,螯合结束后,测定其螯合率,从而筛选最合适的质量比。
1.2.2.3 时间对螯合反应的影响 河蚬多肽浓度为10 mg/mL,选定pH为6.0、多肽与亚铁质量比2∶1及30 ℃螯合温度条件下,改变螯合时间,设定为15、30、45、60、75 min,螯合结束后,测定其螯合率,从而筛选最合适的螯合时间。
1.2.2.4 温度对螯合反应的影响 河蚬多肽浓度为10 mg/mL,在pH为6.0、多肽与亚铁离子质量比2∶1及螯合时间45 min条件下,改变螯合温度为15、30、45、60、75 ℃,螯合结束后,在4000 r/min的条件下离心20 min,测定其螯合率,从而筛选最合适的螯合温度。
1.2.3 响应面实验优化河蚬多肽-亚铁的螯合工艺条件 根据单因素实验结果,以pH(A)、多肽与亚铁离子质量比(B)、时间(C)和温度(D)为自变量,螯合率为响应值(Y),运用Box-Behnken实验的设计原理,设计多肽-Fe2+螯合的响应面分析实验,其编码水平和因素见表1。

表1 响应面实验因素与水平Table 1 Factors and level of experiment by response surface
1.2.4 傅立叶红外光谱分析 分别取适量固体样品河蚬多肽和多肽亚铁螯合物1~1.5 mg,加入干燥好的KBr做稀释剂,样品与溴化钾的比为1∶200,放进玛瑙研钵中,在玛瑙研钵里进行研磨,直至样品粒子成细小而均匀状态,再压至透明薄片,将薄片放入样品架,用傅立叶变换红外光谱仪在4000~400 cm-1光谱范围进行扫描,得到两组光谱,进行定性分析。
1.2.5 螯合率的测定 游离亚铁离子采用邻二氮菲法[9]测定。螯合率按式(1)进行计算:
螯合率(%)=(亚铁离子总量-游离亚铁离子含量)/亚铁离子总量×100
式(1)
1.3 数据处理
所有实验均3次重复,用 Microsoft Excel进行数据整理。
2 结果与分析
2.1 单因素实验
2.1.1 pH对螯合反应的影响 从图1可看出pH过高或者过低均不利于螯合反应。当pH4.0~6.0时,反应螯合率逐渐升高,当pH为6.0时,反应中的螯合率最大,为80.81%,而pH为 7.0时螯合率却骤然下降,只有71.85%。主要由于反应体系中若pH过低时,溶液中氢离子与供电子基团结合而不与金属离子结合,使螯合率较小[10];但若反应体系中的pH过高,溶液呈碱性,螯合体系中存在较多的氢氧根离子,Fe(OH)2极易与Fe(OH)3发生转变,生成不溶性沉淀。因此,选择pH6.0为螯合反应的较适pH。
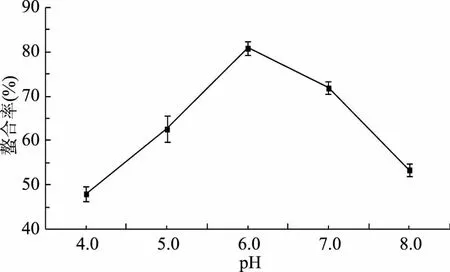
图1 pH对螯合率的影响Fig.1 Effect of pH on ability of chelation
2.1.2 多肽与亚铁离子的质量比对螯合反应的影响 由图2可知,螯合率随着质量比的增加先升高后逐渐趋于稳定。当质量比为2∶1时,螯合率最大值达83.43%;而当质量比继续增大,螯合率增加缓慢,没有显著性差异。主要是由于质量比过小时,河蚬多肽的量不足,与亚铁离子不容易形成环状配合物;而质量比过大时,可供螯合的亚铁离子量不足而河蚬多肽剩余量增多,螯合达到饱和,螯合率趋于平稳。因此,选择多肽与亚铁离子质量比为2∶1。

图2 多肽与亚铁离子质量比对螯合率的影响Fig.2 Effect of peptide/ferrous ions ratio on ability of chelation
2.1.3 时间对螯合反应的影响 由图3可知,在15~45 min内,螯合率随时间的增加而增大。当时间为45 min时,螯合率最高,为82.45%。继续延长时间,螯合率呈缓慢下降趋势。这与邱冬玲等[11]的研究报道是一致的,蛋白肽与微量元素螯合的反应速度都比较快,一般45 min内可以完成。因此,选定为45 min为河蚬多肽与亚铁离子螯合的较适时间。
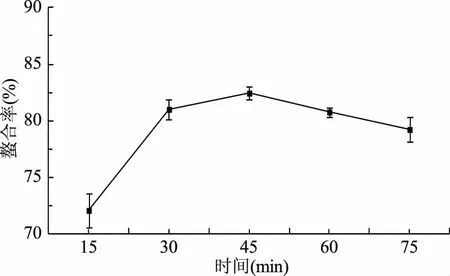
图3 螯合时间对螯合率的影响Fig.3 Effect of time on ability of chelation
2.1.4 温度对螯合反应的影响 从图4可以看出,温度从15 ℃增加到30 ℃时,螯合率从66.67%迅速上升至83.04%;在30~75 ℃之间,螯合率呈下降趋势。由此看出适宜的温度能够提高螯合率,这是因为螯合过程是放热过程[12],偏高或者过低的温度都不会有利于螯合反应。因此,本实验的螯合温度控制在30 ℃为宜。

图4 螯合温度对螯合率的影响Fig.4 Effect of temperature on ability of chelation
2.2 响应面优化实验
使用响应面软件对pH、质量比、时间和温度设计4因素3水平实验,共进行29组实验,实验方案及结果见表2。对29个实验点的响应值进行回归分析,反应中pH、质量比、时间和温度对河蚬多肽亚铁离子螯合影响的显著性检验及方差分析的结果见表3。
表2中的实验数据利用Design Expert 8.05b软件进行处理,得到河蚬多肽-Fe2+螯合物得率(Y)对pH(A)、质量比(B)、时间(C)和温度(D)的二次回归模型方程如下:Y=+85.56-0.18A-4.94B+3.94C-2.90D+3.96AB+1.56AC+6.02AD+5.94BC-2.05BD-13.05CD-16.95A2-5.54B2-8.56C2-23.06D2

表2 响应面实验结果Table 2 Experimental results of response surface

表3 回归方程的显著性检验及方差分析Table 3 Analysis of variance and significance test of regression equation
注:表3中“E”为科学计数法,例:3.100E-003=3.10×10-3;p<0.001,极其显著,用“**” 表示;p<0.05,显著,用“*” 表示。
表3中失拟项p>0.05,不显著,在模型中的p<0.05,方程的相关系数R2=0.9247,说明拟合程度较好,因此模型可用于分析河蚬多肽与Fe2+螯合工艺。因此模型中的回归方程对河蚬多肽亚铁的螯合率具有显著性,四个因素对螯合率大小的影响顺序为:质量比>时间>温度>pH,其中交互因素中螯合时间(C)和螯合温度(D)的交互作用对螯合率的影响是显著的(p<0.05),其响应面和等高线图见图5。
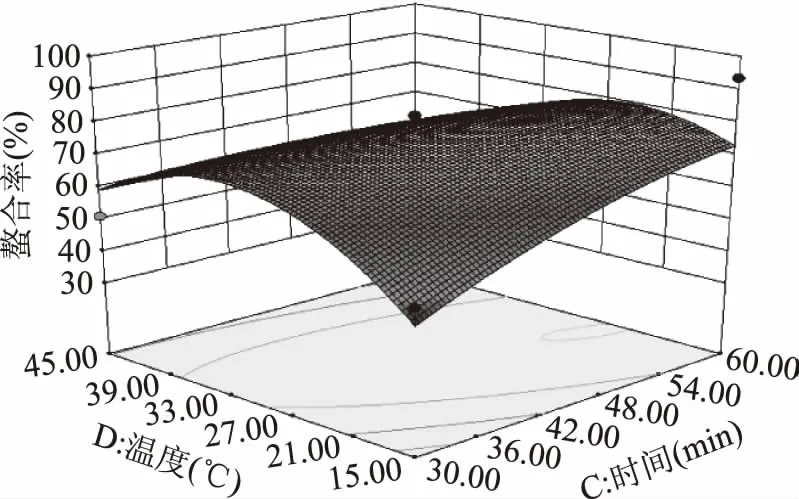
图5 螯合温度与反应时间及其相互作用 对螯合率影响的响应曲面和等高线Fig.5 Response surface and contour plots showing the effect of temperature and time and their mutual interaction on ability of chelation
图5反映出了两因素间的交互作用对螯合率的影响情况,显示反应时间越长螯合率越高,当反应时间为46 min,螯合温度为27~33 ℃内时出现峰值,整个图形呈现上升趋势并且其坡度较为陡峭,表明螯合温度与反应时间的相互作用能显著影响螯合率,所以控制一定的螯合温度与反应时间可以达到较理想的螯合率。通过Design Expert8.05b软件对数据进行处理后,得出的最优条件为pH5.84,质量比为1.5∶1,螯合时间为41.24 min,螯合温度为30.57 ℃,响应面模型预测出螯合率为82.40%。
2.3 验证实验
根据方案实施的可操作性,并综合考虑以上各种因素之间的相互作用,将最优方案工艺参数修正为pH6.0,质量比为1.5∶1,时间为41 min,温度为31 ℃,以此条件再进行三次平行实验,测得的螯合率为81.63%±0.43%,与预测值相比误差为0.77%。因此,利用响应曲面法预测得到的优化工艺比较合理。
2.4 红外光谱分析
分别对河蚬多肽与河蚬多肽-亚铁螯合物两种物质用傅立叶红外光谱仪进行红外光谱分析,得出红外光谱图,如图6、图7所示。

图6 河蚬多肽的红外光谱图Fig.6 IR spectra of Corbicula fluminea peptides

图7 河蚬多肽亚铁螯合物的红外光谱图Fig.7 IR spectra of Corbicula fluminea peptides chelated ferrous ions
由图6和图7可以看出,河蚬多肽与亚铁离子形成螯合物后,一些吸收峰的位置变化较为明显。在特征区,河蚬多肽在3419.32 cm-1处的吸收峰是由于N-H的伸缩振动引起的,与Fe2+螯合后则移至3416.27 cm-1,向短波位移动,且吸收峰加强,因此可以判断河蚬多肽中的氨基参与了亚铁的螯合[13]。多肽亚铁螯合物的红外光谱图中的C=O吸收峰由1657.63 cm-1位移至1647.13 cm-1,吸收强度也随之发生了明显的变化,这可能是河蚬多肽螯合亚铁离子后,伸缩振动和变角振动等受到了遏制[14];而且,河蚬多肽红外光谱图中的C=O反对称振动峰在1400.88 cm-1处,而河蚬多肽螯合亚铁的C=O面内摇摆吸收峰消失,说明Fe2+与羧基进行了结合[15]。由此可以说明河蚬多肽中的氨基和羧基参与了螯合反应,进一步说明河蚬多肽和亚铁离子螯合生成河蚬多肽-Fe2+螯合物。
3 结论
本实验以河蚬肉作为研究对象,将制备的河蚬多肽与亚铁离子螯合,在单因素实验基础之上,采用响应面分析软件获得河蚬多肽-Fe2+螯合物的最佳螯合工艺条件为:pH6.0,多肽与Fe2+质量比为1.5∶1,反应时间为41 min,温度为31 ℃,测得螯合率为81.63%,与预测值相比误差为0.77%。利用响应曲面法预测得到的优化工艺参数比较合理,具有实用价值。通过对比分析河蚬多肽和多肽亚铁螯合物的红外光谱图,发现河蚬多肽的氨基和羧基均发生了配位反应,确定多肽和亚铁离子间进行了螯合。
[1]刘晶晶,徐云婕,韩曜平,等.洪泽湖野生河蚬营养成分的分析与评价[J].食品工业科技,2014,35(15):360-364.
[2]曹银娣,陈巧云,熊华,等.米蛋白肽铁的螯合条件优化 [J]. 食品与发酵工业,2007,33(4):61-64.
[3]张亚丽,徐忠.多肽微量元素络合物食品添加剂的制备工艺研究[J].化学与粘合,2004(3):130-133.
[4]邓尚贵,杨桑,秦小明.低值鱼蛋白多肽-铁(Ⅱ)螯合物的酶解制备及其抗氧化、抗菌活性[J].食品科学,2006,26(4):54-58.
[5]郑炯,汪学荣,阚建全. 血红蛋白多肽螯合铁的抗贫血功能研究[J]. 食品工业科技,2009,30(10):312-313,304.
[6]Mimura E C,Breganó J W,Dichi J B,et al. Comparison of ferrous sulfate and ferrous glycinate chelate for the treatment of iron deficiency anemia in gastrectomized patients[J]. Nutrition,2008,24(7-8):663-668.
[7]Maria Kapsokefalou,Dennis D Miller. Iron speciation in intestinal contents of rats fed meals composed of meat and nonmeat sources of protein and fat[J]. Food Chemistry,1995,52(1):47-56.
[8]刘晶晶,汤会芳,郭芝琳,等. 河蚬肉抗氧化肽的分离及活性研究[J]. 食品工业科技,2016,37(4):169-172.
[9]宁正祥. 食品成分分析手册[M].北京:中国轻工业出版社,1998.
[10]高素蕴,潘思轶,郭康权. 大豆分离蛋白水解物螯合锌(II)的合成与制备[J]. 食品科学,2003,24(10):117-120.
[11]邱冬玲,胡长利,崔建云. 丝素肽与锌螯合工艺条件的研究[J]. 食品研究与开发,2008,29(7):38-42.
[12]陆剑锋,孟昌伟,李进,等. 斑点叉尾鮰鱼骨胶原多肽螯合钙的制备及其特征[J]. 水产学报,2012,36(2):314-319.
[13]付文雯,马美湖,蔡朝霞. 牛骨蛋白酶解制取肽钙的研究进展[J]. 食品与发酵科技,2009,45(1):1-5.
[14]夏光华,申铉日,酒志强. 罗非鱼皮胶原蛋白小肽螯合钙的制备、鉴定及抗氧化研究[J]. 食品科技,2013,38(6):242-246.
[15]杨燊,邓尚贵,秦小明. 低值鱼蛋白多肽-钙螯合物的制备和抗氧化、抗菌活性研究[J]. 食品科学,2008,29(1):202-206.

