不同血供类型肝血管瘤的介入治疗效果长期随访评价
贾科峰 于长路 孙诚 高忠嵩 宋德钊 王森
肝海绵状血管瘤(cavernous hemangioma of the liver,CHL)是最常见的肝脏良性肿瘤,占所有肝脏良性肿瘤的73%。成人患病率约为0.4%~7.3%,尸检发现率为3%~20%,好发人群为成年女性[1]。小的血管瘤多无临床症状,巨大血管瘤可以引起腹痛、饱腹感、慢性恶心、呕吐、食欲不振、消化不良等常见症状,少见的还包括胆汁淤积(或黄疸)、腹水、胆道出血和Kasabach-Merritt综合征等严重表现。肝动脉栓塞术也就是常说的介入治疗目前已是公认的治疗肝血管瘤的方法[2]。
常用的栓塞剂为平阳霉素碘油混合剂(pingyangmycin-lipiodol emulsion,PLE)和/或明胶海绵,疗效可靠。但笔者在对我科行肝血管瘤介入治疗的患者随访过程中发现效果不一,考虑其原因可能与肝血管瘤本身的血供类型有很大的关系,因此本研究将CHL患者按血管瘤的血供类型进行分类,研究不同血供类型患者行介入治疗的疗效差异。
对象与方法
一、研究对象
我院2008年1月—2013年12月经临床、影像证实并且随访时间超过3年的CHL患者324例,按血供类型分为富血供型组128例,中等血供型组104例,乏血供型组90例,门静脉型2例,因为门静脉型例数较少,本次统计不予以比较,其他3组的年龄和性别构成差异无统计学意义,见表1。

表1 3组的一般资料比较
二、方法
局麻下经皮股动脉穿刺,将4F RH导管穿至腹腔动脉和/或肠系膜上动脉主干,造影了解CHL的数目、大小、血供等情况,根据造影表现,将微导管超选择至肿瘤的供血动脉内。缓慢注入PLE,待肿瘤栓塞满意后,根据情况可对肿瘤供血血管行明胶海绵栓塞。一般平阳霉素的用量为8~24 mg,碘化油的用量为5~10 ml。如患者疼痛可在术中注入2%的利多卡因1~2 ml,术后常规给予抗感染、护肝和对症治疗[3]。
三、血供分型标准
采用李彦豪、欧阳墉等[4-5]人的分型标准:(1)富血供型:供血动脉轻-中度增粗,动脉期可见异常血窦显影,实质期显影的血窦充盈瘤体大部分区域,见图1;(2)中等血供型:供血动脉轻度增粗,动脉期可见异常的血窦显影,实质期显影的血窦充盈瘤体部分区域,见图2;(3)乏血供型:供血动脉无增粗,动脉期可见少许异常血窦显影,实质期血窦充盈瘤体小部分区域,见图3;(4)门静脉型:动脉期及实质期无异常血窦显影,直接或间接门静脉造影显示异常血窦,见图4。

图1 富血供型肝血管瘤

图2 中等血供型肝血管瘤

图3 乏血供型肝血管瘤
四、疗效评价标准[4]
显效:各种症状体征消失,经CT等影像学检查示瘤体缩小50%以上;有效:各种症状体征消失,经CT等影像学检查示瘤体有所缩小,但缩小体积小于50%;无效:各种症状体征均未消失,经CT等影像学检查示瘤体无变化或进一步增大。
五、统计学方法
采用SPSS17.0统计学软件进行统计处理与分析,计量资料以均数±标准差表示,多组比较采用F检验,进一步两两比较采用q检验,同组资料前后比较采用配对t检验。计数资料比较采用χ2检验,3组间进行χ2检验时α=0.05,进一步两两组间分别进行χ2检验时α'=0.05/3。
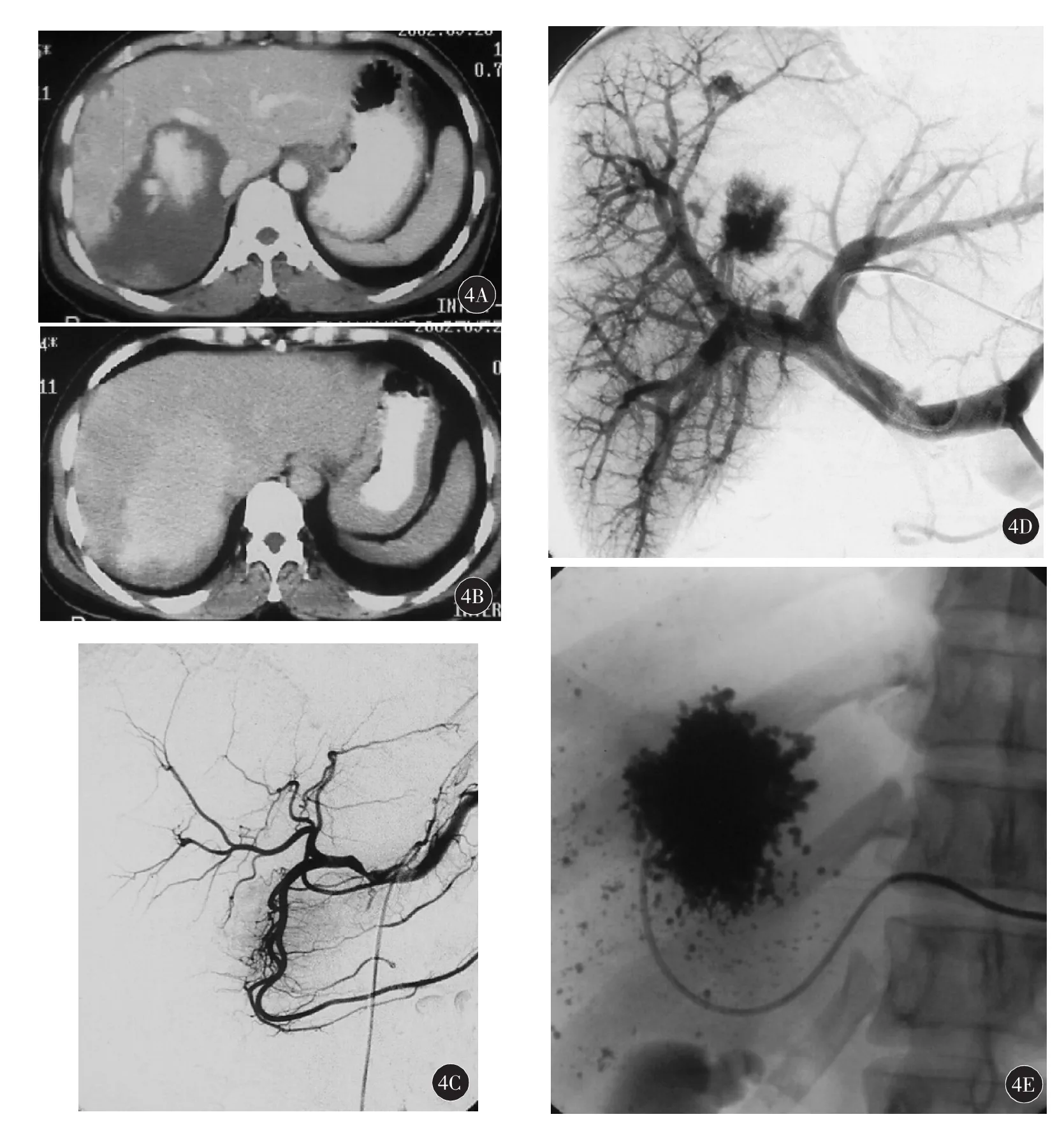
图4 为一例门静脉型血管瘤的CT图像,呈“快进慢出”表现(4A、4B),肝动脉造影时未见瘤体显影(4C);后经皮穿刺门静脉造影,见瘤体显影(4D);经导管注入PLE后,碘油沉积较好(4E)
结 果
一、治疗效果评价
2例门静脉供血型血管瘤,在肝动脉插管造影时,未见瘤体染色,随后行超声引导下门静脉穿刺插管治疗,4组技术成功率均为100%。3组间的有效率差异无统计学意义,富血供型的显效率高于乏血供型,乏血供型的无效率最高,富血供型和中等血供型的无效率差异无统计学意义。血管瘤术中栓塞剂的用量:富血供型最大,中等血供型其次,乏血供型用量最少,差异均有统计学意义(表2)。

表2 3年治疗效果评价
二、术前术后肝血管瘤直径比较
术前,3组的肝血管瘤直径差异无统计学意义;术后3个月~3年,3组的肝血管瘤直径差异均有统计学意义,均是乏血供型大于富血供型和中等血供型,差异有统计学意义,而富血供型与中等血供型间差异无统计学意义,见表3。
表3 3组肝血管瘤术前术后直径对比 (mm±s)

表3 3组肝血管瘤术前术后直径对比 (mm±s)
注:a与富血供型比较,P<0.05;b与中等血供型比较,P<0.05
组别 术前 术后富血供型组中等血供型组乏血供型组F值P值9.6±2.4 9.2±3.7 8.9±2.8 0.041 0.224 3~6个月4.7±2.4 5.8±2.1 8.2±2.6ab 17.489<0.001 6~12个月2.8±1.6 3.1±1.8 6.7±2.9ab 13.483<0.001 1年~2年2.0±0.8 2.2±1.2 6.1±2.4ab 20.571<0.001 2年~3年1.4±0.6 1.6±1.1 4.5±1.8ab 68.169<0.001
三、术后并发症
主要包括疼痛、发烧、恶心、呕吐等消化道症状。大部分患者有不同程度的发烧,对症处理后症状缓解。术后3 d,部分患者发生谷丙转氨酶及谷草转氨酶轻度升高等肝功能轻度异常,经对症处理7~10 d后恢复正常。
讨 论
CHL的发病率高,病因不明,诊断多采用CT、MRI或者超声造影,多不存在困难,但在一些较小病灶(直径小于3 cm)可能会存在一定困难,需要结合实验室检查及临床进行鉴别诊断[6]。
目前临床上对CHL的主要治疗方法有外科切除、介入治疗及射频消融。外科切除包括血管瘤剥除术和肝切除术,至于选择何种术式需要根据肿瘤的大小、位置以及外科医生的技术特长来决定[7],肝血管瘤的手术适应证也经历了一系列演变,过去认为不管有无症状,只要是直径大于4 cm或5 cm就应手术切除。而现在则认为,瘤体大小不应成为手术与否的选择理由,而明确源自血管瘤的症状及其严重的并发症是绝对的手术适应证;此外,肿瘤增长迅速,不能除外恶性,也是手术的适应证[8]。外科切除的好处在于治疗彻底,但与介入及射频相比,外科切除的创伤较大、出血较多,且还有麻醉风险[9]。
射频消融与介入是目前应用最广泛的两种微创治疗方法,与介入治疗相比,射频消融的优点是治疗彻底、创伤小,但缺点是会受病灶位置影响,还存在严重并发症的可能,如大出血、血栓形成、急性肝功能衰竭、急性肾功能衰竭及胆漏等[10]。经导管介入治疗的并发症主要是误栓,但随着介入器材的不断更新发展,尤其是微导管的普遍使用,微导管的直径一般不超过1 mm,可以直接超选择至肿瘤的供血血管内,发生误栓的几率已越来越小了[3,11-13]。
血管瘤体由大小不一的血窦组成,介入治疗通过注入的栓塞剂进入并停留在这些血窦中,使血管瘤血窦内皮细胞破坏、血栓形成、血窦永久性闭塞,瘤体缩小或消失,但不会破裂出血,以达到治疗作用[13]。
PLE应用于肝血管瘤的治疗已有近30年的历史,疗效确切,通过肝动脉注入PLE治疗肝血管瘤的安全性及疗效已得到广泛的认可。但很少有研究对不同血供类型血管瘤的介入疗效进行对比分析,笔者在对本院的肝血管瘤介入术后患者随访过程中发现,肿瘤缩小程度与肝血管瘤本身的血供类型有很大的关系,通过分析发现,富血供型肝血管瘤在介入术后6个月内效果最为明显,与其他几组有显著性差异,1年内富血供型与中等血供型肿瘤缩小程度无显著性差异,其3年的治疗效果评价,显效+有效率达100%。而对于乏血供型,各个随访时间段肿瘤缩小程度显著低于前两组,且3年治疗效果也较前两组差。富血供型行PLE栓塞时病灶内可形成PLE的高浓度及高密度聚集,甚至可以使血窦血管床达到硬化性栓塞,故可以获得较好的瘤体缩小率。同理,相比富血供型栓塞效果,中等血供型及乏血供型效果就会差些。这提示我们在对于乏血供型血管瘤的治疗时可选择其他方法,如外科切除、射频消融等[14]。
国内外许多文献报道,肝血管瘤的血供全部由肝动脉供血,与门静脉无关[15-17],并以此作为肝动脉栓塞治疗肝血管瘤的理论基础,但从我们所收集的病例来看,门静脉供血型血管瘤虽然临床上比较罕见,但确实存在。也证明血管瘤的血供并不全是由肝动脉供血。欧阳墉等[5]认为肝血管的血供可在肝动脉及门静脉之间进行转换。肝动脉或门静脉供血与否决定于两者之间的异常血窦大小。异常血窦直径小(30~50 μm),供血以动脉为主,动脉造影即可使多数异常血窦充盈。相反,异常血窦直径大(500~600 μm)时,供血方式则变更为门静脉供血,此时动脉造影时仅有少量或无异常血窦充盈。总之,通过对不同血供类型肝血管瘤介入疗效分析,可为肝血管瘤采取最合适的治疗方法提供参考。
[1] Li M,Zhang C,Zhang T,et al.Outcome using selective hemihepatic vascular occlusion and Pringle maneuver for hepatic resection of liver cavernous hemangioma[J].World J Surg Oncol,2015,13:267.doi:10.1186/s12957-015-0680-9.
[2] 李旭彤,吴宝音,李伟男,等.介入栓塞治疗不同体积肝血管瘤的临床疗效及血流动力学特征 [J].肝脏,2016,21(6):485-488.doi:10.3969/j.issn.1008-1704.2016.06.018
[3] 王宝堂,刘芝艳,张建明.介入栓塞治疗肝血管瘤[J].中国医学影像技术,2014,30(4):549-551.
[4] 曾庆乐,陈勇,李彦豪,等.肝海绵状血管瘤的动脉造影分型及介入治疗 [J].中国医学影像学杂志,2009,17(5):379-380.doi:10.3969/j.issn.1005-5185.2009.05.019.
[5] 欧阳墉,欧阳雪晖,顾苏宾.成人肝海绵状血管瘤并发动静脉短路的 DSA检查和诊断 [J].中华放射学杂志,2000,34(8):523-523.
[6] 言伟强,邹立秋,赵艳,等.小肝细胞癌与小肝血管瘤螺旋CT三期扫描的鉴别诊断 [J].中华肿瘤杂志,2005,27(11):691-694.doi:10.3760/j.issn:0253-3766.2005.11.014.
[7] Zhang W,Huang ZY,Ke CS,et al.Surgical treatment of giant liver hemangioma larger than 10 cm:A single center's experience with 86 patients[J].Medicine(Baltimore),2015,94(34):e1420.
[8]Miura JT,Amini A,Schmocker R,et al.Surgical management of hepatic hemangiomas:a multi-institutiona experience [J].HPB(Oxford),2014,16(10):924-928.
[9] 戴朝六.肝海绵状血管瘤的诊治现状[J].中国普外基础与临床杂志,2016,23(2):129-133.
[10]李威,杨坡,满文玲,等.肝血管瘤射频消融和介入栓塞治疗的比较[J].影像介入,2016,22(5):6-8.
[11]张福君,吴沛宏,赵明,等.肝动脉栓塞化疗后射频消融联合酒精消融对原发性肝癌的疗效评价 [J].中华肿瘤杂志,2005,27(4):248-250.
[12]Jin S,Shi XJ,Sun XD,et al.Sclerosing cholangitis secondary to bleomycin-iodinated embolization for liver hemangioma[J].World J Gastroenterol,2014,20(46):17680-17685.
[13]于长路,贾科峰,王森,等.不同栓塞剂治疗肝巨大海绵状血管瘤的疗效[J].介入放射学杂志,2014,23(6):525-527.
[14]李雪松,夏锋.肝血管瘤治疗选择 [J].肝胆外科杂志,2015,23(1):7-9.
[15]李亮,陈广颖.选择性肝动脉栓塞治疗肝血管瘤[J].肝胆外科杂志,2014,22(5):358-359.
[16]Sun JH,Nie CH,Zhang YL,et al.Transcatheter Arterial Embolization Alone for Giant Hepatic Hemangioma[J].PLoS One,2015,10:e0135158.
[17]Kueht M,Masand P,Rana A, et al.Concurrent hepatic hemangioma and solitary fibrous tumor:diagnosis and management[J].J Surg Case Rep,2015,2015 (7):rjv089.doi:10.1093/jscr/rjv089.

