CCL3促进人骨髓间充质干细胞增殖并抑制其外泌体的分泌*
段锋祺, 陈丽璇, 周 兆, 高 扬, 刘革修, 韩 娜, 肖 扬
(1南方医科大学, 广东 广州 510515; 2广州中医药大学, 广东 广州510405; 3暨南大学基础医学院, 广东 广州 510632; 4广州军区广州总医院, 广东 广州 510010; 5广东省赛莱拉干细胞研究院, 广东 广州 510320)
外泌体(exosomes)最初发现于绵羊网织红细胞[1],是来源于细胞的粒径在30~100 nm的膜性小泡,最初被认为是一种“细胞垃圾”[2]。近年来研究发现,外泌体中含有RNA和微小RNA(microRNA, miRNA),并且能转导入受体细胞而调节蛋白表达,证明外泌体不仅是一种细胞信息传递分子,更是一种遗传物质传递载体[3],是细胞间信息交流的枢纽[4]。
研究发现,间充质干细胞(mesenchymal stem cells,MSCs)是产生外泌体能力最强的细胞,并且间充质干细胞源性外泌体(MSC-exosomes)具有多种与MSCs相似的生物学功能[5-7]。有研究发现, MSCs的旁分泌调节作用主要通过细胞分泌的外泌体来实现[8]。因此, MSCs旁分泌调节作用的强弱与外泌体分泌量有直接关系。
研究显示,在炎症病理环境下MSCs外泌体分泌呈活跃状态[9]。有学者利用干扰素γ模拟炎症环境,证实在此炎症环境下, MSCs外泌体分泌量会增加[10]。研究表明, 在不同的炎症病理环境下均能检测到趋化因子CCL3高表达[11-13]。CCL3是经脂多糖(lipopolysaccharides, LPS)诱导后在巨噬细胞上清液中发现的相对分子量约为8 kD的2个肽链组成的细胞因子。 多种细胞具有分泌CCL3的能力,其作用无种属特异性。 CCL3的受体有CCR1、CCR5和CCR9,均属于G蛋白偶联受体,CCL3与相应受体特异性结合后产生瀑布样细胞活化作用[14]。目前尚无文献报道CCL3与人骨髓MSCs(human bone marrow MSCs, hBMSCs)的相互作用关系,本研究拟探讨炎症因子CCL3对hBMSCs外泌体分泌的调节作用,以进一步了解CCL3对MSCs生物学活性的调节作用。
材 料 和 方 法
1材料与试剂
实验所用间充质干细胞均由广州军区总医院细胞生物治疗中心以及广东省赛莱拉干细胞研究院提供。胎牛血清和低糖DMEM培养基购于Gibco;0.25%胰酶、青霉素和链霉素购于Sigma-Aldrich;外泌体提取试剂盒购于System Biosciences;CCK-8试剂购于日本同仁;鼠抗人CD9抗体及辣根过氧化物酶标记的羊抗鼠IgG购于Abcam;Dynabeads购于Invitrogen。鼠抗人CD191(CCR1)、CD195(CCR5)和CD199(CCR9)单抗以及CCL3均购于PeproTech。15 cm培养皿和T25培养瓶购于Corning。
2主要方法
2.1hBMSCs的体外分离培养和鉴定 经患者知情同意,采集健康供者额骨内骨髓20 mL,肝素钠抗凝后加等量生理盐水, Percoll细胞分离液(1.073×10-3g/L)密度梯度离心,取中间单核细胞层以低糖DMEM培养基清洗2次,接种入15 cm 培养皿中,加入含10% FBS的DMEM/F12培养基后, 置于5% CO2培养箱中培养。24 h后换液,弃未贴壁的细胞。以后每2~3 d换液,待细胞生长至90%汇合后胰蛋白酶消化传代培养,记为P1。使用P3~P5细胞用于实验,P5细胞进行表面抗原及成骨和成脂诱导鉴定。
2.2CCK-8法检测细胞活力 取P3~P5 hBMSCs制备细胞悬液,细胞计数,取8×104个细胞接种于96孔板,每孔3 000个。实验分为4个组,每组设4个复孔,同时设置不加细胞和药物的培养基为空白对照(blank conrtol, control)组。各组对应加入CCL3,使孔中CCL3终浓度分别为 0 μg/L、 5 μg/L、 10 μg/L和20 μg/L。于37 ℃、5% CO2培养箱中培养24 h后,每孔加入CCK8试剂8 μL,混匀后继续孵育3 h。在酶标仪上测定 450 nm 波长处的各孔吸光度(A)并计算细胞活力。
2.3活细胞计数检测细胞增殖 将P3~P5 hBMSCs接种于T25的培养瓶中。CCL3加入各组细胞培养瓶中,使培养瓶中CCL3终浓度分别为0 μg/L、5 μg/L 、10 μg/L和20 μg/L。在37 ℃、5% CO2且饱和湿度的细胞培养箱中培养24 h后,收集所有hBMSCs,并计数各组细胞。以上实验重复3次。
2.4流式细胞术检测细胞表面受体 将P3~P5 hBMSCs接种于T25的培养瓶中。CCL3加入各组细胞培养瓶中,使培养瓶中CCL3终浓度分别为0和10 μg/L。在37 ℃、5% CO2、 饱和湿度的细胞培养箱中培养24 h后,收集所有hBMSCs, PBS洗1遍,分别以5 μL抗CCR1、CCR5和CCR9单抗重悬,室温避光反应30 min。离心取细胞沉淀后用1 mL PBS洗涤,收集细胞沉淀用100 μL PBS重悬后进行流式细胞术检测。以上实验重复3次。
2.5外泌体分离提纯 取P3~P5 hBMSCs,培养至达到80%融合时,更换无血清低糖DMEM培养基,饥饿处理24 h后收集上清,按照ExoQuickTM试剂盒(SBI)操作说明提取外泌体,将提取的外泌体加入100 μL PBS重悬,-80 ℃冻存用于后续实验。
2.6电镜鉴定外泌体形态 取上述分离纯化外泌体悬液10 μL,加入等体积平衡盐PBS溶液稀释,滴加于直径2 mm的载样铜网上,于室温静置1分钟后, 用滤纸将多余液体轻轻吸去;用3%磷钨酸钠溶液(pH 6.8)室温复染5 min,用双蒸水轻轻洗一遍后室温晾干2 min;于透射电镜观察并照相。各视野区随机选取20个外泌体测量其直径。
2.7纳米颗粒跟踪分析(nanoparticle tracking analysis, NTA) 取各组分离纯化外泌体悬液1 μL,加入等体积平衡盐PBS溶液稀释至NTA软件画面中粒子束不超过100个。根据Nanosight-NS500记录的颗粒数,按照仪器使用说明书上机进行纳米粒子特性分析,待仪器测量结束后,收集并分析报告。
2.8外泌体流式细胞术 BCA法对分离纯化的外泌体进行蛋白定量,取各组外泌体30 μg分别与0.5 μL Dynabeads混匀,室温旋转孵育15 min,加入1 mL PBS,4 ℃ 旋转孵育过夜;孵育完毕后加入100 mmol/L 甘氨酸和2%BSA以终止反应,室温旋转孵育30 min,14 800×g离心1 min后用2% BSA洗涤1次;用3% BSA封闭,室温旋转孵育30 min,14 800×g离心1 min后2%BSA洗涤1次;加入鼠源CD9抗体(1∶2 000),4 ℃旋转孵育30 min,14 800×g离心1 min;再次用2% BSA洗涤 1 次;加入鼠源488抗体(1∶2 000),4 ℃旋转孵育30 min;上流式细胞仪进行检测。
3统计学处理
本研究所有实验均重复3次,实验数据均以均数±标准差(mean±SD)表示。用SPSS 22.0 进行数据的统计学分析,GraphPad Prism 7.0进行统计绘图。两组间的比较采用t检验;多组间的比较采用单因素方差分析,均数间的多重比较采用Bonferroni 法。以P<0.05为差异有统计学意义。
结 果
1hBMSCs表面抗原流式细胞术鉴定
经过流式细胞术检测,可见细胞强阳性表达CD73(100%)、CD90(99.5%)和CD105(99.7%),弱阳性表达CD34(0.2%)、CD45(0.1%)和CD19(0.1%),见图1。
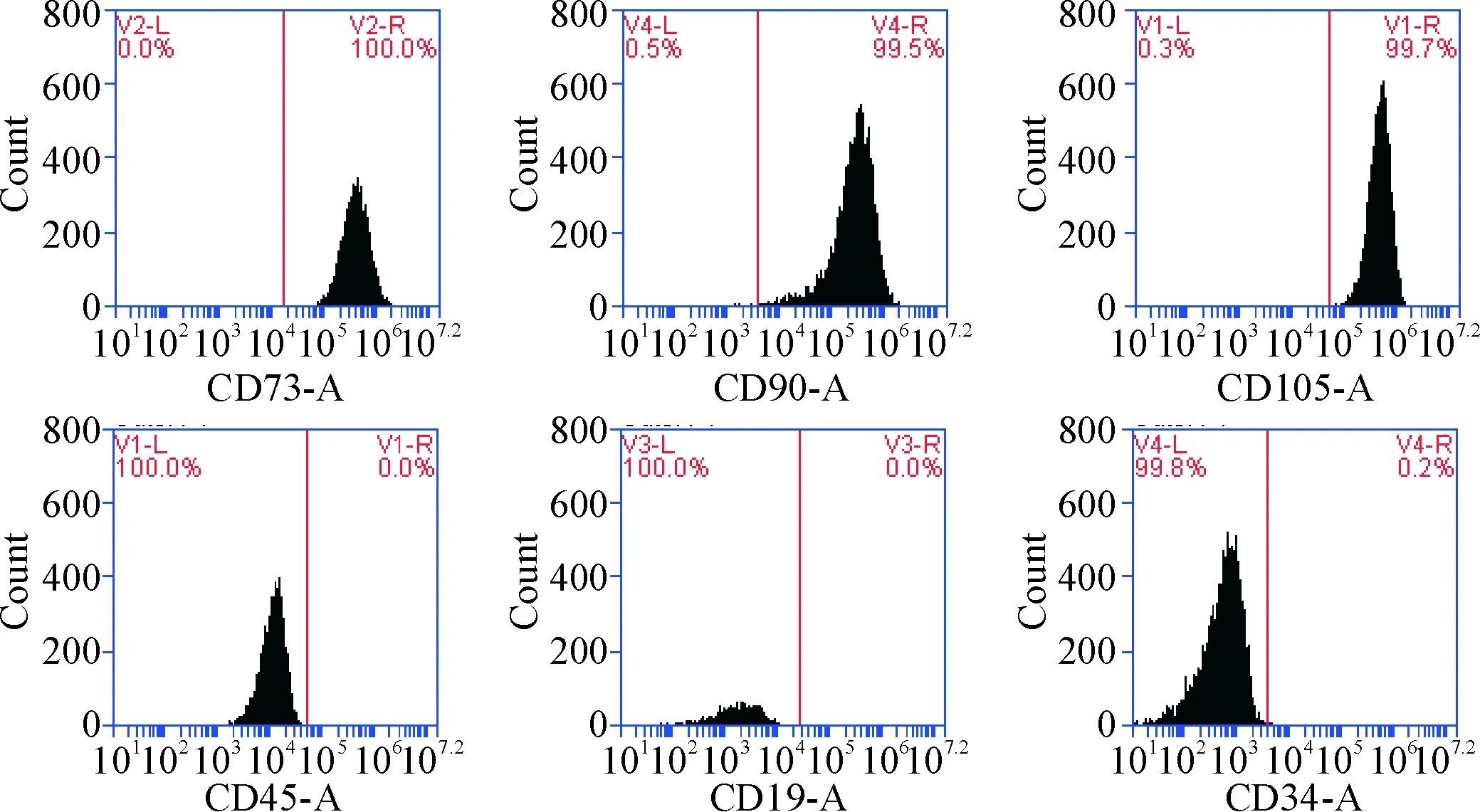
Figure 1. Results of surface antigen expression in hBMSCs.
图1hBMSCs表面抗原检测结果
2hBMSCs成脂和成骨诱导鉴定
P5 hBMSCs形态比较一致,呈成纤维细胞状,贴壁生长,见图2A。成脂诱导第14天可见大部分细胞内出现大而圆的脂滴,经过油红O染色后,脂滴红染,见图2B。成骨诱导第21天,可见细胞不断增殖、重叠,而且出现很多钙化结节,钙化结节经茜素红染后呈红色,见图2C。
3CCL3对hBMSCs的促增殖作用
CCL3对hBMSCs增殖有明显的促进作用。CCK-8实验结果和活细胞计数显示,当CCL3浓度为5 μg/L时,其对hBMSCs增殖已有明显的促进作用(P<0.05)。随着浓度的增加,CCL3对hBMSCs增殖的促进作用增强,呈现良好的量效关系,见图3。
4CCL3可诱导hBMSCs表面受体CCR9表达
流式细胞术结果显示,hBMSCs表面存在CCL3的3个特异性受体CCR1、CCR5和CCR9。10 μg/L CCL3作用hBMSCs后,与对照(0 μg/L CCL3)组相比,CCR9组荧光强度峰值明显右移,说明加入CCL3后hBMSCs表面CCR9表达量增加;CCR1和CCR5组峰值与对照组峰值基本重叠,说明CCR1和CCR5表达量无明显差异,见图4。这一结果提示CCL3可诱导hBMSCs表面受体CCR9表达。

Figure 2. The culture and identification of hBMSCs (×100). A: morphology of hBMSCs; B and C: multi-lineage differentiation abi-lity of hBMSCs (B: adipogenic induction; C: osteogenic induction).
图2hBMSCs成脂和成骨诱导结果
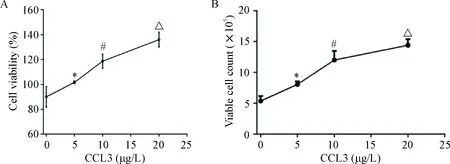
Figure 3. CCL3 promoted the proliferation of hBMSCs in a dose-dependent manner. A: the viability of hBMSCs was measured by CCK-8 assay; B: viable hBMSCs were measured by viable cell counting. Mean±SD.n=3.*P<0.05vs0 μg/L group;#P<0.05vs5 μg/L group;△P<0.05vs10 μg/L group.
图3CCK-8法和活细胞计数检测CCL3对hBMSCs增殖的影响
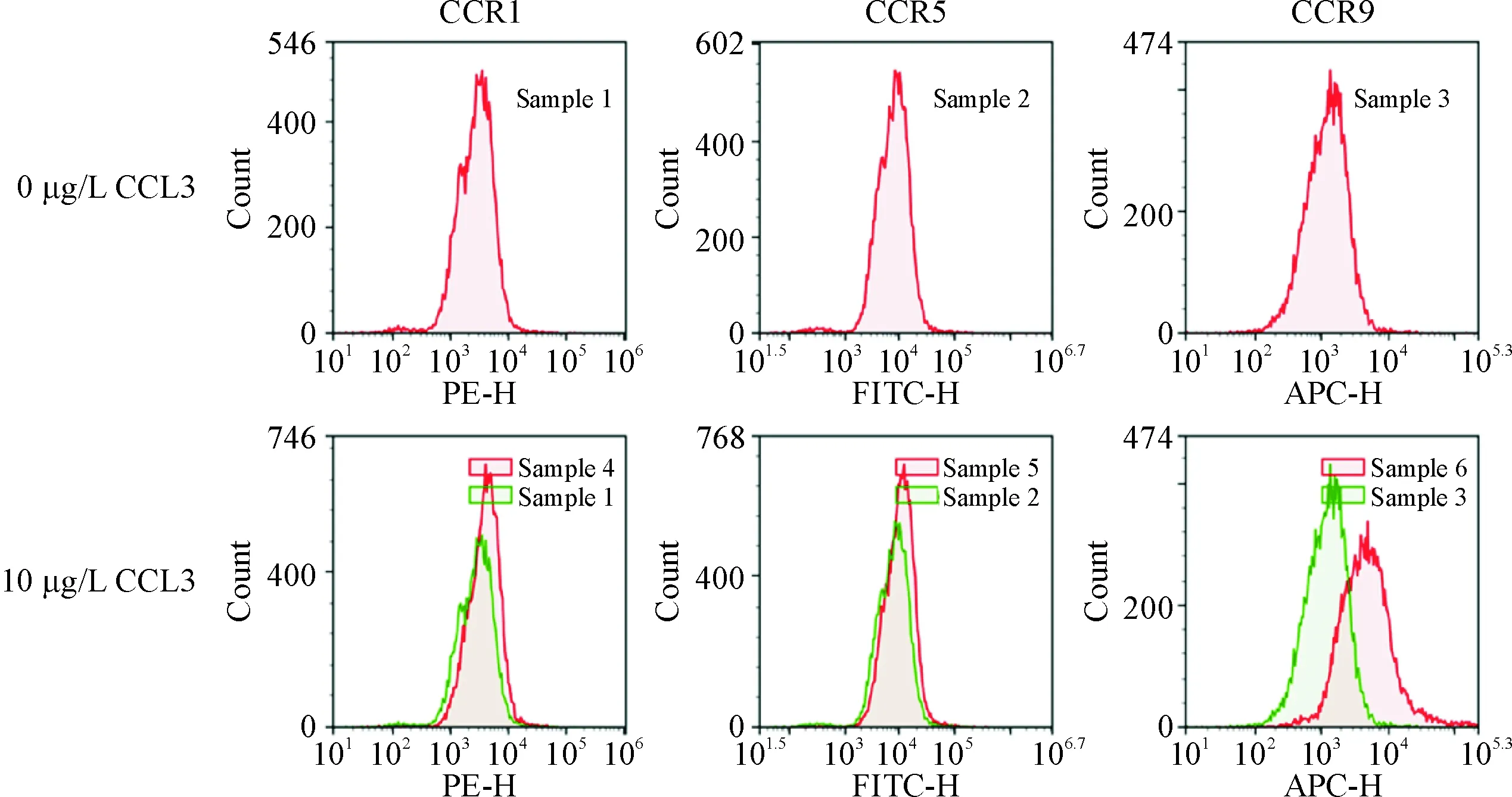
Figure 4. CCL3 induced the expression of CCR9 on hBMSCs.
图4CCL3通过表面受体CCR9作用于hBMSCs
5外泌体电镜鉴定结果
在透射电镜下观察,hBMSCs外泌体呈圆形或椭圆形,直径约30~100 nm[(88.3±26.4) nm],有完整的包膜结构,内含低密度物质,见图5。
6不同浓度CCL3对hBMSCs外泌体分泌量的影响
不同浓度(0、10和20 μg/L)的CCL3作用于hBMSCs后,提取上清液中的外泌体,流式细胞术结果显示,对照(0 μg/L)组CD9+外泌体百分比为65.60%±2.10%,10 μg/L组为51.33%±5.42%选取直径为30~100 nm的外泌体纳入计算。与对照(0 μg/L)组相比,CCL3作用后, hBMSCs外泌体的分泌量均明显减低(P<0.05),外泌体的平均粒径增大(P<0.05),见表1。CCL3影响hBMSCs外泌体的粒径分布,并且其分泌的粒径大于100 nm的微囊泡明显增多, 见图7、 8。
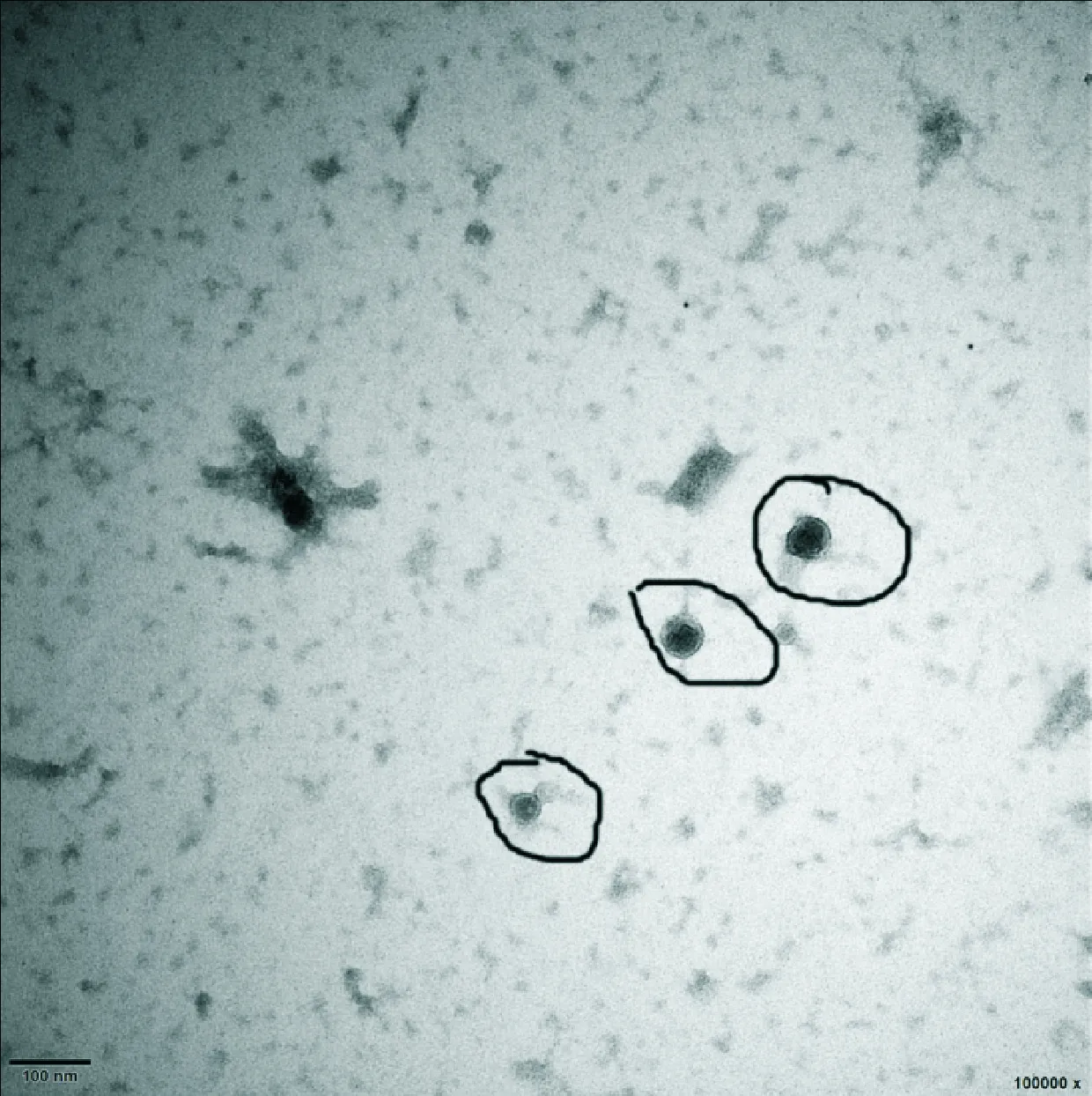
Figure 5. Morphology of hBMSCs-derived exosomes observed by transmission electron microscopy. The scale bar=100 nm.
图5透射电镜观察hBMSCs来源外泌体的形态
(P<0.01),20 μg/L组为21.27%±4.93%(P<0.01),见图6。这说明CCL3抑制了hBMSCs外泌体的分泌。
讨 论
趋化因子在调控免疫细胞到达受体组织的过程中发挥了重要作用。研究表明, CCL3与多种呼吸系统疾病、肿瘤免疫以及血液系统疾病的发生发展密切相关。在MSCs的体外研究中证实,MSCs可通过下调CCL3、CCL8和CCL17等炎症趋化因子的表达,来缓解炎症反应, 但是其作用机制以及MSCs在这一过程中产生的生理变化尚未阐明。目前大多数研究只证实CCL3通过其强大的趋化作用介导MSCs到达炎症局部发挥免疫调节作用,但是我们并不清楚在这一过程中MSCs的相关分泌功能发生了什么变化。Ti等[9]研究表明, 在炎症病理环境中,MSCs外泌体的分泌量会增加;同时相关体外研究证实, 利用干扰素γ模拟炎症环境,MSCs外泌体分泌量会增加[10]。因此我们推测,趋化因子CCL3可能也能促进hBMSCs外泌体的分泌。但是我们的研究证实,CCL3在促进hBMSCs增殖的同时抑制其分泌外泌体。出现上述差异的原因可能在于:(1)既往外泌体的定量检测常采用BCA方法进行,BCA测量的是上清液中细胞分泌的所有囊泡,包括细胞直径在100~1 000 nm的微囊泡和细胞直径在30~100 nm的外泌体;微囊泡是细胞激活、损伤或凋亡后从细胞膜脱落的小囊泡,是真正意义上的“细胞垃圾”;因此采用BCA来进行外泌体定量,由于不能排除大颗粒微囊泡的干扰作用,使得实验结果可能存在较大误差。本实验采用目前进行外泌体定量的2种最准确方法:流式细胞术和NTA,对所收集的外泌体进行准确的定量分析,排除了大颗粒囊泡对实验结果的影响。我们的实验结果表明,CCL3虽然抑制了hBMSCs外泌体的分泌,但是却使大颗粒微囊泡的分泌量增加,这种无效囊泡的增加势必会影响BCA粗测的结果。(2)炎症环境中存在着许多炎症因子,这些炎症因子之间相互作用会形成网络关系,不同的炎症因子对MSCs外泌体分泌的调控作用可能存在差异。 因此势必会出现单一影响因素(如干扰素γ和CCL3)的检测结果与众多因素共同作用的结果不同。
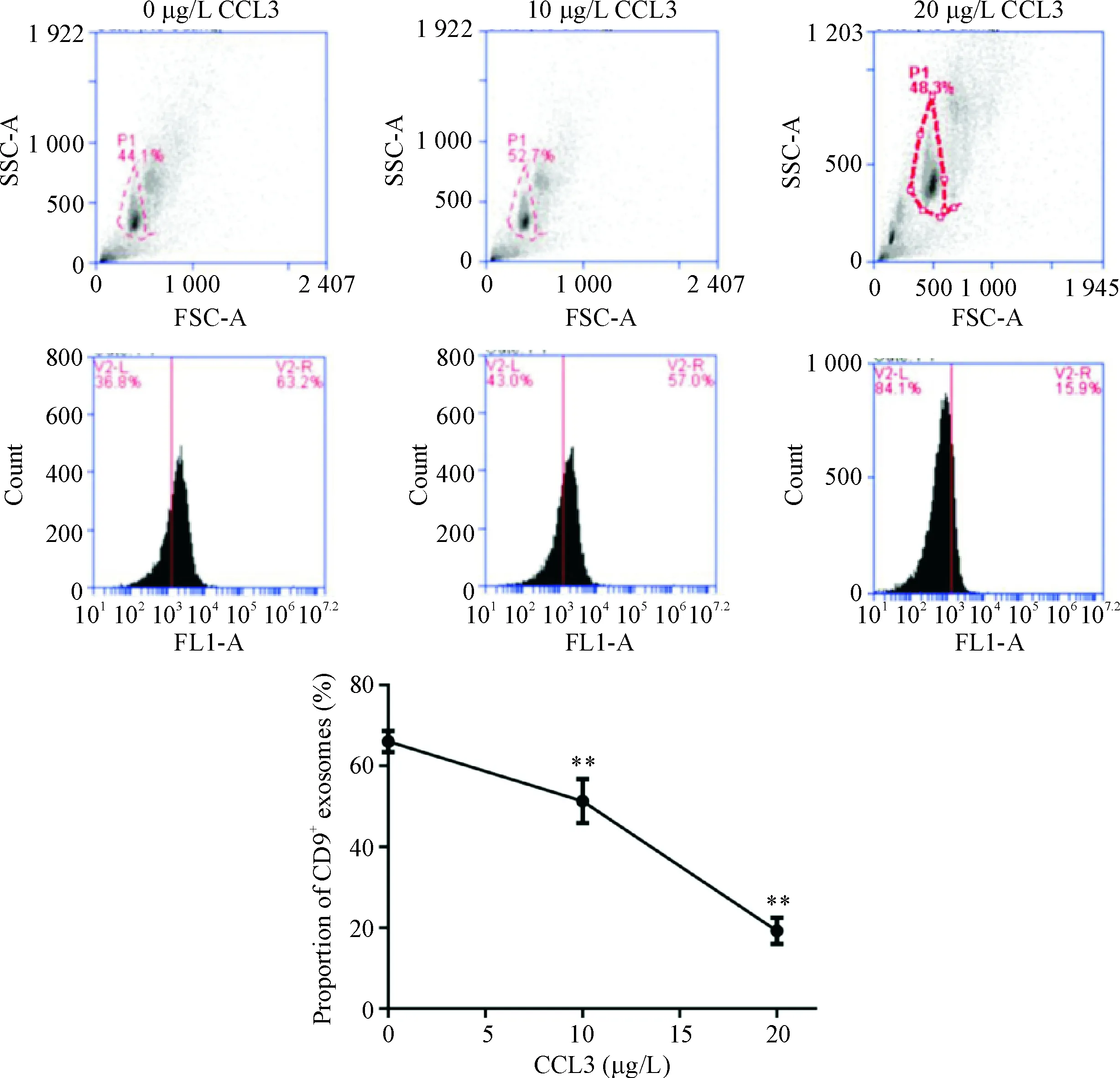
Figure 6. Flow cytometry analysis of exosome secretion in hBMSCs. The proportion of CD9+exosomes with or without CCL3 at 2 different concentrations was determined. Mean±SD.n=3.**P<0.01vs0 μg/L group.
图6流式细胞术检测外泌体的分泌量
表1不同浓度CCL3作用下hBMSCs外泌体粒径分布及浓度的检测结果
Table 1. Size and particle concentrations of the exosomes in hBMSCs with or without CCL3 treatment at different concentrations (Mean±SD.n=3)

CCL3(μg/L)Size(nm)Totalconcentration(×1010particles/mL)089.8±44.15.00±0.0610228.2±150.1∗4.28±0.07∗20310.9±167.4∗3.58±0.07∗
*P<0.05vs0 μg/L group.

Figure 7. CCL3 affected size distribution of exosomes. Nanoparticle tracking analysis (NTA) of hBMSCs exosomes was performed.
图7NTA检测CCL3时外泌体粒径分布的影响
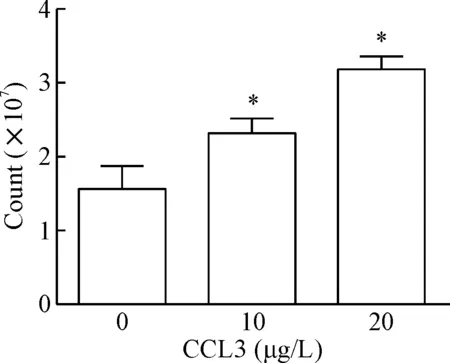
Figure 8. CCL3 stimulated the secretion of nonfunctional microvesicles (diameter >100 nm). Mean±SD.n=3.*P<0.05vs0 μg/L group.
图8CCL3刺激hBMSCs分泌无效囊泡
目前, 外泌体的分泌机制尚未明确,现阶段关于分泌机制的研究聚焦于相关膜蛋白的表达,例如Hyenne等[15]最新发现膜蛋白RAL-1参与调控外泌体的形成。关于细胞因子对于外泌体分泌的调控研究,尚未见较多报道。我们的研究证实了趋化因子CCL3可下调hBMSCs外泌体的表达,这为外泌体的分泌机制研究提供了一种新思路。
最新研究提示, hBMSCs来源的外泌体也可以预防及治疗移植物抗宿主病并促进造血微环境重建[16]。已有研究发现, MSCs的旁分泌调节作用主要通过细胞分泌的外泌体来实现[8]。本实验通过多种方法证实,与对照组相比,CCL3作用后hBMSCs外泌体的分泌量显著降低。这说明CCL3通过某种途径下调了hBMSCs外泌体的分泌。因此, 我们认为CCL3可通过减少外泌体分泌量这一方式来减弱MSCs旁分泌调节作用。此外,Ou等[17]证实, 在再生障碍性贫血环境中CCL3表达量显著增加。再生障碍性贫血来源的骨髓间充质干细胞具有较低的自我更新以及定向分化能力,并且其免疫调控能力也存在缺陷,但具体机制尚未阐明[18]。同时已有研究证实, CCL3结合CCR1后主要通过CCR1-p38途径进行造血负调控[19]。因此, 高分泌的CCL3对造血功能的抑制以及对MSCs外泌体分泌的抑制, 可能是再生障碍性贫血的发病机理之一。
CCL3在生物体内的特异性受体有CCR1、CCR5和CCR9。3种受体在细胞表面分布存在差异,参与的免疫调控作用也不同。研究表明,CCR1可表达于各类免疫细胞表面,对免疫细胞到达炎症部位产生募集效应, 最新研究证实CCL3与造血干细胞表面CCR1特异性结合后可抑制造血干细胞分化,特别表现在抑制红系细胞的发育[19];CCR5是白细胞的一种参与免疫调节作用的表面蛋白,在T细胞免疫中起着重要作用, HIV通过特异性识别CCR5来侵袭T细胞,造成细胞免疫功能缺陷[20], 最新研究证实CCL3与CCR5特异性结合后可通过诱导炎症和血管生成以及嗜酸性粒细胞募集等效应导致口腔癌的发生[21];CCR9多表达于小肠和结肠的T淋巴细胞表面,常与特异性配体CCL25结合参与胃肠道免疫功能调控[22]。目前尚无研究证实CCL3可与hBMSCs表面某个受体特异性结合,同时也没有关于hBMSCs膜表面上述3种受体表达情况的研究,因此我们实验中检测了3种受体在hBMSCs的表达情况以及CCL3诱导后受体的表达差异。我们的研究证实,hBMSCs细胞膜表面存在CCR1、CCR5和CCR9这3种表面蛋白,CCL3作用hBMSCs后CCR9的表达量明显增大,CCR1和CCR5 的表达量无显著差异,说明CCL3可诱导hBMSCs膜表面CCR9表达。因此我们推测CCL3可能主要通过与CCR9特异性结合来参与对hBMSCs分泌外泌体的调控,相关机制需要进一步深入研究。
综上所述,本研究通过多种方法证实了CCL3可促进hBMSCs增殖并抑制其分泌外泌体,说明外泌体的分泌机制不但与相关跨膜蛋白的表达相关,也与环境中的各种细胞因子有关,进一步说明了其分泌机制的复杂性。同时, CCL3通过下调外泌体分泌量这一方式来减弱MSCs旁分泌调节作用以及其表现出的造血负调控作用,为再生障碍性贫血的发病机制提供了新的思路。
致谢: 感谢广东省赛莱拉干细胞研究院和广州军区广州总医院细胞生物治疗中心无偿为本研究提供了所有实验所需间充质干细胞。
[1] Harding C, Heuser J, Stahl P. Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes[J]. J Cell Biol, 1983, 97(2):329-339.
[2] Théry C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2(8):569-579.
[3] Lässer C, Eldh M, Lötvall J, et al. Isolation and characterization of RNA-containing exosomes[J]. J Vis Exp, 2012, 9(59):e3037.
[4] Lai RC, Yeo RW, Lim SK. Mesenchymal stem cells exosomes[J]. Semin Cell Dev Biol, 2015, 4(40):82-88.
[5] Yeo RW, Lai RC, Zhang B, et al. Mesenchymal stem cell: an efficient mass producer of exosomes for drug deli-very[J]. Adv Drug Deliv Rev, 2013, 65(3):336-341.
[6] Théry C, Ostrowski M, Segura E, et al. Membrane vesicles as conveyors of immune responses[J]. Nat Rev Immunol, 2009, 9(8):581-593.
[7] Zöller M. Tetraspanins: push and pull in suppressing and promoting metastasis[J]. Nat Rev Cancer, 2009, 9(1):40-55.
[8] Akyurekli C, Le Y, Richardson RB, et al. A systematic review of preclinical studies on the therapeutic potential of mesenchymal stromal cell-derived microvesicles[J]. Stem Cell Rev, 2015, 11(1):150-160.
[9] Ti D, Hao H, Tong C, et al. LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b[J]. J Transl Med, 2015, 13:308.
[10] 杨翔宇, 李晓红, 肖 静, 等. 干扰素γ刺激hUC-MSCs 分泌外泌体促进调节性T细胞生成[J]. 中国药理学通报, 2017, 33(1):45- 51.
[11] Hattermann K, Knerlich-Lukoschus F, Lucius R, et al. Erythropoietin and CCL3 antagonise their functional pro-perties during neuro inflammation[J]. Neurol Res, 2015, 37(11):1025-1028.
[12] Kohno H, Maeda T, Perusek L, et al. CCL3 production by microglial cells modulates disease severity in murine models of retinal degeneration[J]. J Immunol, 2014, 192(8):3816-3827.
[13] Ravi AK, Khurana S, Lemon J, et al. Increased levels of soluble interleukin-6 receptor and CCL3 in COPD sputum[J]. Respir Res, 2014, 15:103.
[14] Maurer M, von Stebut E. Macrophage inflammatory protein-1[J]. Int J Biochem Cell Biol, 2004, 36(10):1882-1886.
[15] Hyenne V, Apaydin A, Rodriguez D, et al. RAL-1 controls multivesicular bodybiogenesis and exosome secretion[J]. J Cell Biol, 2011, 211(1):27-37.
[16] Del Fattore A, Luciano R, Pascucci L, et al. Immunore-gulatory effects of mesenchymal stem cell-derived extracellular vesicles on T lymphocytes[J]. Cell Transplant, 2015, 24(12):2615-2627.
[17] Ou YQ, Liu HY, Lu W, et al. The mechanism of bone marrow-derived mesenchymal stem cells excessive senescence in severe aplastic anemia mouse model[J]. Zhonghua Xue Ye Xue Za Zhi, 2017, 38(4):325-329.
[18] Hamzic E, Whiting K, Gordon Smith E, et al. Characte-rization of bone marrow mesenchymal stromal cells in aplastic anaemia[J]. Br J Haematol, 2015, 169(6):804-813.
[19] Wang Y, Gao A, Zhao H, et al. Leukemia cell infiltration causes defective erythropoiesis partially through MIP-1α/CCL3[J]. Leukemia, 2016, 30(9):1897-1908.
[20] Allers K, Hütter G, Hofmann J, et al. Evidence for the cure of HIV infection by CCR5 stem cell transplantation[J]. Blood, 2014, 117(10):2791-2799.
[21] de Silva JM, Moreira Dos Santos TP, Sobral LM, et al. Relevance of CCL3/CCR5 axis in oral carcinogenesis[J]. Oncotarget, 2017, 8(31):51024-51036.
[22] Kunkel EJ, Campbell JJ, Haraldsen G, et al. Lymphocyte CC chemokine receptor 9 and epithelial thymus-expressed chemokine (TECK) expression distinguish the small intestinal immune compartment: epithelial expression of tissue-specific chemokines as an organizing principle in regional immunity[J]. J Exp Med, 2000, 192(5):761-768.

