沉默PARP-1对乳腺癌细胞MCF-7顺铂耐药的影响*
李金霞, 马 力
(1邢台市人民医院产科, 河北 邢台 054000; 2河北医科大学第四医院乳腺中心, 河北省乳腺疾病诊治中心, 河北 石家庄 050011)
乳腺癌是一种乳腺上皮组织恶性肿瘤,严重威胁着妇女的身心健康。近年来,随着人们对肿瘤研究的深入及分子生物学的不断发展,关于肿瘤的治疗方式及治疗理念都出现了转变。目前,针对乳腺癌的治疗手段主要有放化疗、手术治疗及靶向分子疗法,其中化疗在术前及术后均起着不可替代的作用,但临床治疗中肿瘤细胞耐药性的出现,大大降低了药物的疗效并可能导致治疗失败[1-3]。因此,探讨乳腺癌耐药性的产生机制,寻找逆转耐药性的潜在靶点及逆转策略,对于提高临床疗效具有重要的意义。
肿瘤细胞的耐药性以获得性耐药为主,且多会对作用机制相异的其它类抗肿瘤药物产生交叉耐药[4]。肿瘤细胞获得性耐药的产生机制比较复杂,经常表现为多种机制联合作用。这些机制主要包括:膜转运蛋白[如P-糖蛋白(P-glycoprotein,P-gp)及多药耐药相关蛋白(multidrug resistance-associated protein,MRP)等]的高表达致肿瘤细胞内药物浓度降低;DNA损伤修复能力加强;酶系统,如谷胱甘肽巯基转移酶(glutathioneS-transferase,GST)及细胞色素P450(cytochrome P450,CYP)超家族等的异常表达;激素受体的减少;药物靶点的改变及细胞凋亡受到抑制[5-10]等。
多聚腺苷二磷酸核糖聚合酶1[poly(ADP-ribose) polymerase-1,PARP-1]是PARP家族的重要成员,该家族有蛋白修饰和核苷酸聚合作用,是一类DNA修复酶,在机体出现氧化应激和DNA损伤等情况时,PARP可通过识别断裂的DNA片段而被激活[11-12]。有研究显示,PARP-1的异常表达及基因多态性与多种肿瘤的发病有着密切的联系[12-14];此外还有研究表明,PARP-1的异常表达在肿瘤的化疗耐药中起着重要的作用[15-16]。Li等[17]的研究提示,下调PARP-1的活性可抑制细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路,进而抑制细胞增殖,参与影响骨肉瘤U2OS细胞的耐药性;而Mishra等[18]的研究则表示,姜黄素可通过清除PARP-1促进急性淋巴细胞性白血病细胞的凋亡。但是PARP-1在乳腺癌细胞化疗耐药中的作用及相关机制目前并没有明确的阐释。本文通过小干扰RNA(small interfering RNA,siRNA)下调乳腺癌耐药细胞株MCF-7/DDP中PARP-1的表达,研究PARP-1在乳腺癌细胞化疗耐药中的作用及其相关作用机制。
材 料 和 方 法
1材料与试剂
乳腺癌细胞株MCF-7及乳腺癌耐药细胞株MCF-7/DDP购于中科院上海细胞库;胎牛血清(fetal bovine serum,FBS)、DMEM培养基及Opti-NEM培养基均购于Gibco;PARP-1 siRNA、阴性对照siRNA及SYBR Green I Real-Time PCR Kit由上海吉玛制药技术有限公司提供; Lipofectamine 2000及相关转染试剂由Invitrogen提供;抗PARP-1、Bcl-2、Bax、caspase-3、cleaved caspase-3、细胞色素C(cytochrome C,Cyto-C)、p-ERK、ERK及 β-actin 单克隆抗体购于Santa Cruz;CCK-8细胞活力分析试剂盒购于Sigma;细胞凋亡检测试剂盒购于南京凯基生物科技发展有限公司;顺铂(cisplatin,Cis)购于齐鲁制药公司;紫杉醇(paclitaxel,PTX)购于海南海药股份有限公司;ERK特异性抑制剂U0126购于Cell Signaling;其余试剂均为国产市售分析纯。
2方法
2.1细胞培养、分组及转染 细胞常规培养于含10% FBS的DMEM培养基中,培养条件设置为37 ℃、5% CO2、饱和湿度。每2 d换液1次,每3~5 d用0.25%的胰酶消化、传代。siRNA的转染:首先取对数生长期的细胞接种于6孔板中(接种密度为1×108/L),待细胞长至60%~80%融合时进行转染。组别设置为空白对照(blank control,control)组、阴性对照siRNA(negative control siRNA,Neg)组和PARP-1 siRNA(siRNA)组。将siRNA溶解于Opti-MEM培养基中,室温孵育5 min,标记为A液;另取Lipofectamine 2000,溶解于Opti-MEM培养基中,室温孵育5 min,标记为B液;轻柔混合A液和B液,室温静置25 min,形成复合体。将复合体加入相应组别的细胞中,室温孵育6 h后更换为正常细胞培养基继续培养48 h。检测转染效率并进行后续实验分析。PARP-1 siRNA的序列为 5’-AAGATAGAGCGTGAAGGCGAA-3’;阴性对照siRNA的序列为 5’-TTCTCCGAACGTGTCACGT-3’。
2.2Real-time PCR检测PARP-1的mRNA表达 参照操作手册采用Trizol一步法抽提细胞总RNA。取2 μg总RNA经逆转录反应合成cDNA(反应终体积为20 μL),采用SYBR Green real-time PCR方法检测mRNA的表达。PARP-1的正向引物为5’-GCCCTAAAGGCTCAGAACGAC-3’,反向引物为5’- CACCATGCCATCAGCTACTCG-3’; β-actin作为内参照,正向引物为5’-TGGACATCCGCAAAGAC-3’,反向引物为5’-GAAAGGGTGTAACGCAACTA-3’。PCR反应体系包括2 μL逆转录产物、10 μL SYBR Green PCR Master Mix和500 nmol/L正、反向引物。采用MyiQ单色实时PCR检测系统(Bio-Rad),反应条件为:95 ℃预变性5 min; 95 ℃ 10 s、60 ℃ 30 s、72 ℃ 15 s,循环40次。采用2-ΔΔCt法分析基因的相对表达量。
2.3细胞化疗药物敏感性的检测 采用CCK-8法检测化疗药物对乳腺癌细胞的半数抑制浓度(half maximal inhibitory concentration,IC50)。取对数生长期的细胞接种于96孔板中(接种密度为1×108/L),待细胞贴壁生长至80%~90%融合时更换为无血清培养基同步化12 h,然后分别加入终浓度为0、0.01、0.1、1、10和100 μmol/L的Cis或PTX,继续培养46 h,加入100 μL 的CCK-8试剂孵育2 h,经酶标仪测定450 nm波长处的吸光度(A),计算相应药物的IC50。
2.4细胞凋亡的检测 用流式细胞术(Annexin V/PI 双染色法)检测细胞凋亡情况,将各组细胞消化后,1 000×g离心收集细胞,加入Binding Buffer 重悬细胞。而后向细胞悬液中加入Annexin V-FITC混匀,室温避光静置10 min;然后加碘化丙啶(propi-dium iodide,PI)染液,室温下避光染色10 min,采用流式细胞仪检测细胞的凋亡情况,检测的激发波长Ex=488 nm,发射波长Em=530 nm。
2.5Western blot检测蛋白表达水平 收集各组细胞的蛋白样品,并用BCA蛋白定量试剂盒进行蛋白定量,调整各组蛋白上样量(80 μg)后加入4倍体积的Loading Buffer,98 ℃水浴变性5 min。微量移液器上样后采用8% SDS-PAGE,待蓝色的Loading Buffer泳出分离胶后将蛋白电转至PVDF膜(约90 min),加入5%脱脂牛奶室温封闭90 min,依据说明书加入相应比例的 I 抗,4 ℃孵育过夜,复温后TBST洗涤3次,每次5 min;分别加入相应的抗HRP标记的 II 抗,室温孵育120 min,TBST洗涤3次,每次10 min。于暗室中将PVDF膜的蛋白面浸入HRP-ECL发光液中激发荧光,压X片、显影并定影。实验结果采用ImageJ 灰度分析软件进行蛋白半定量分析。
3统计学处理
采用SPSS 13.0标准版统计软件包行数据分析,实验结果以均数±标准差(mean±SD)表示,多组间比较采用方差分析,各组均数间的两两比较用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1PARP-1的表达与乳腺癌细胞MCF-7化疗耐药之间的关系
本实验首先检测了化疗药物对乳腺癌耐药细胞株MCF-7/DDP及其对照亲本细胞株MCF-7的IC50,结果表明,MCF-7/DDP对2种不同化疗药物的耐药性显著强于其亲本细胞株(P<0.05),见表1。同时real-time PCR及Western blot的结果显示,MCF-7/DDP中PARP-1的mRNA及蛋白表达水平均明显高于其亲本细胞株(P<0.05);在MCF-7细胞中加入不同浓度的顺铂后,PARP-1的蛋白表达水平显著升高,提示PARP-1的表达可能与乳腺癌细胞MCF-7顺铂耐药之间存在相关关系,见图1。
表1乳腺癌细胞对化疗药物的敏感性
Table 1. Drug sensitivity of the breast cancer cells (μmol/L. Mean±SD.n=6)
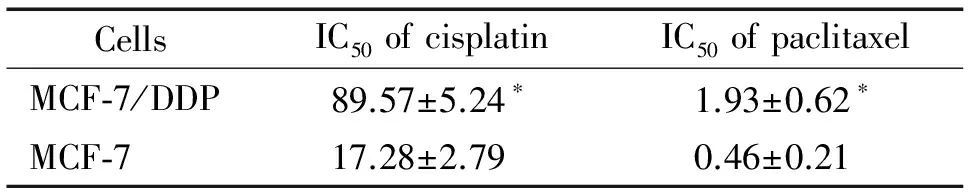
CellsIC50ofcisplatinIC50ofpaclitaxelMCF⁃7/DDP89.57±5.24∗1.93±0.62∗MCF⁃717.28±2.790.46±0.21
*P<0.05vsMCF-7 cells.
2转染效率的检测
用real-time PCR和Western blot实验检测PARP-1 siRNA在乳腺癌耐药细胞株MCF-7/DDP及其对照亲本细胞株MCF-7中的转染效率,结果显示,转染PARP-1 siRNA后,MCF-7/DDP及MCF-7细胞中PARP-1的mRNA表达和蛋白表达均明显降低(P<0.05),见图2。
3沉默PARP-1对乳腺癌细胞MCF-7/DDP及MCF-7化疗敏感性的影响
为进一步证明PARP-1的表达与乳腺癌细胞MCF-7对顺铂耐药之间的相互关系,我们在耐药细胞株MCF-7/DDP及其对照亲本细胞株MCF-7中沉默PARP-1,并检测其对化疗药物的敏感性。CCK-8实验的结果显示,沉默MCF-7/DDP细胞的PARP-1表达后,细胞对顺铂的敏感性明显增加,差异具有统计学意义;在MCF-7细胞中沉默PARP-1同样可增加细胞对顺铂的敏感性,见表2。
4沉默PARP-1对耐药细胞株MCF-7/DDP凋亡的影响
CCK-8实验结果显示,在MCF-7/DDP细胞中沉默PARP-1的表达之后,早期凋亡率升高(P<0.05);而中晚期细胞凋亡/细胞坏死率差异无统计学意义,见图3。这表明沉默PARP-1的表达可明显促进耐药细胞MCF-7/DDP的凋亡。
5沉默PARP-1对凋亡信号通路相关分子蛋白水平的影响
Western blot实验的检测结果显示,沉默耐药细胞MCF-7/DDP中PARP-1的表达之后,抗凋亡蛋白Bcl-2的表达显著下降,而凋亡蛋白Bax和激活型caspase-3的蛋白水平明显增加;此外,Cyto-C的检测结果示,线粒体中Cyto-C的含量显著降低,胞浆中Cyto-C显著升高,说明Cyto-C释放增加,提示线粒体凋亡信号通路被激活,见图4。

Figure 1. The relationship between PARP-1 expression and drug-resistance in MCF-7 breast cancer cells. A: the mRNA expression level of PARP-1 in MCF-7 cells and MCF-7/DDP cells; B: the protein expression level of PARP-1 in MCF-7 cells and MCF-7/DDP cells; C: the protein expression of PARP-1 was increased in MCF-7 cells treated with cisplatin (Cis). Mean±SD.n=6.*P<0.05vsMCF-7 cells;#P<0.05vs0 μmol/L.
图1PARP-1的表达与乳腺癌MCF-7细胞化疗耐药之间的关系
除此之外,我们还检测了ERK信号通路的磷酸化情况,结果显示,沉默耐药细胞MCF-7/DDP中PARP-1的表达之后,p-ERK的蛋白水平显著降低,但是对ERK总蛋白的表达没有明显影响,提示沉默PARP-1可抑制耐药细胞MCF-7/DDP中ERK信号通路的磷酸化活化。且采用ERK特异性抑制剂U0126预孵MCF-7/DDP细胞可导致PARP-1干扰组的细胞活性进一步降低,见图5。
讨 论
PARP-1已被证实参与细胞能量代谢,影响细胞的生存,并与肿瘤细胞获得性耐药的出现密切相关[13, 15, 17]。我们的研究发现,在乳腺癌耐药细胞株MCF-7/DDP中,PARP-1的mRNA和蛋白的表达水平均显著升高,且在MCF-7细胞中梯度加入低浓度顺铂后,PARP-1的蛋白表达水平显著升高,提示PARP-1可能参与调控乳腺癌化疗耐药性的产生。此外通过转染PARP-1 siRNA下调其表达,可提高耐药细胞MCF-7/DDP对化疗药物的敏感性。因此我们认为,PARP-1参与调控乳腺癌化疗耐药的出现。
为进一步了解PARP-1介导乳腺癌化疗耐药的作用机制,我们通过沉默耐药细胞MCF-7/DDP中PARP-1的表达,检测PARP-1对细胞凋亡的影响,结果发现,沉默PARP-1可促进MCF-7/DDP的凋亡,提示沉默PARP-1可提高乳腺癌耐药细胞的化疗敏感性可能是与促进耐药细胞的凋亡有关。众所周知,细胞凋亡是一个涉及多条信号通路的复杂过程。目前认为细胞的凋亡途径包括死亡受体通路介导的细胞凋亡和线粒体途径介导的细胞凋亡[19]。结合PRAP-1在细胞能量代谢中的作用,我们检测了沉默*P<0.05vssiRNA group.
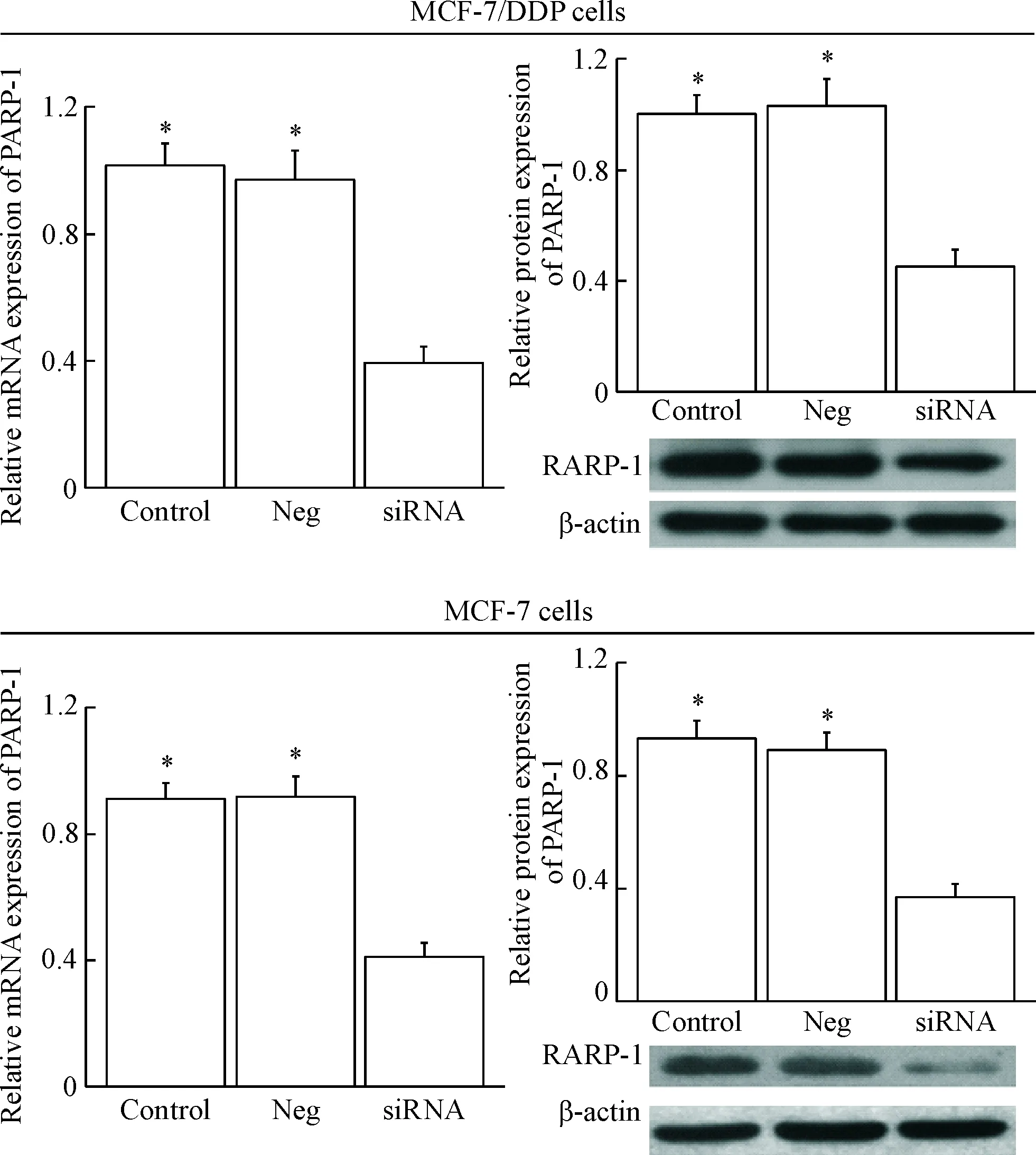
Figure 2. The expression of PARP-1 in MCF-7/DDP and MCF-7 cells after transfected withPARP-1 siRNA. Mean±SD.n=6.*P<0.05vssiRNA group.
图2MCF-7/DDP和MCF-7细胞转染PARP-1siRNA后PARP-1的表达水平
表2沉默PARP-1可提高乳腺癌细胞MCF-7/DDP及MCF-7对化疗药物的敏感性
Table 2.PARP-1 knockdown increased drug sensitivity of MCF-7/DDP and MCF-7 cells (μmol/L. Mean±SD.n=6)

CellsTreatmentIC50ofcisplatinIC50ofpaclitaxelMCF⁃7/DDPControl89.57±5.24∗1.93±0.62Neg87.61±6.13∗2.02±0.59siRNA54.19±5.111.04±0.47MCF⁃7Control17.28±2.79∗0.46±0.21Neg15.34±2.51∗0.45±0.24siRNA10.07±1.820.37±0.18
PARP-1对线粒体凋亡信号通路的影响,实验中我们发现,PARP-1沉默可促进耐药细胞中促凋亡蛋白Bax的表达,抑制抗凋亡蛋白Bcl-2的表达;同时促进线粒体Cyto-C的释放,激活caspase家族中的关键效应蛋白caspase-3。结果表明,沉默PARP-1可激活线粒体凋亡信号通路,这可能是沉默PARP-1促凋亡作用的机制之一。ERK信号通路可通过磷酸化过程激活细胞内多种酶和信号分子,参与调控细胞的增殖、分化及凋亡过程[20-21]。联系到PARP-1对ERK信号通路的影响[17, 22],我们进一步检测了沉默PARP-1对MCF-7/DDP细胞中ERK信号通路的影响,结果表明沉默PARP-1可抑制耐药细胞MCF-7/DDP中ERK信号通路的磷酸化活化;且采用ERK特异性抑制剂U0126预孵MCF-7/DDP细胞可导致PARP-1干扰组的细胞活性进一步降低。但是其具体的调控机制还有待进一步深入的研究。

Figure 3. The effect ofPARP-1 knockdown on MCF-7/DDP cell apoptosis analyzed by flow cytometry. Mean±SD.n=6.*P<0.05vssiRNA group.
图3沉默PARP-1对MCF-7/DDP细胞凋亡的影响
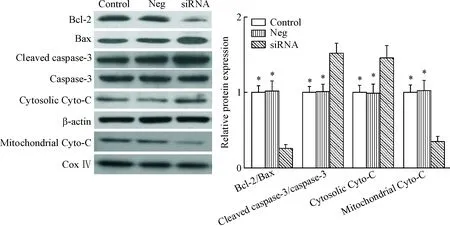
Figure 4. The effect ofPARP-1 knockdown on mitochondrial apoptosis pathway in MCF-7/DDP cells. Mean±SD.n=6.*P<0.05vssiRNA group.
图4沉默PARP-1对MCF-7/DDP细胞线粒体凋亡信号通路的影响
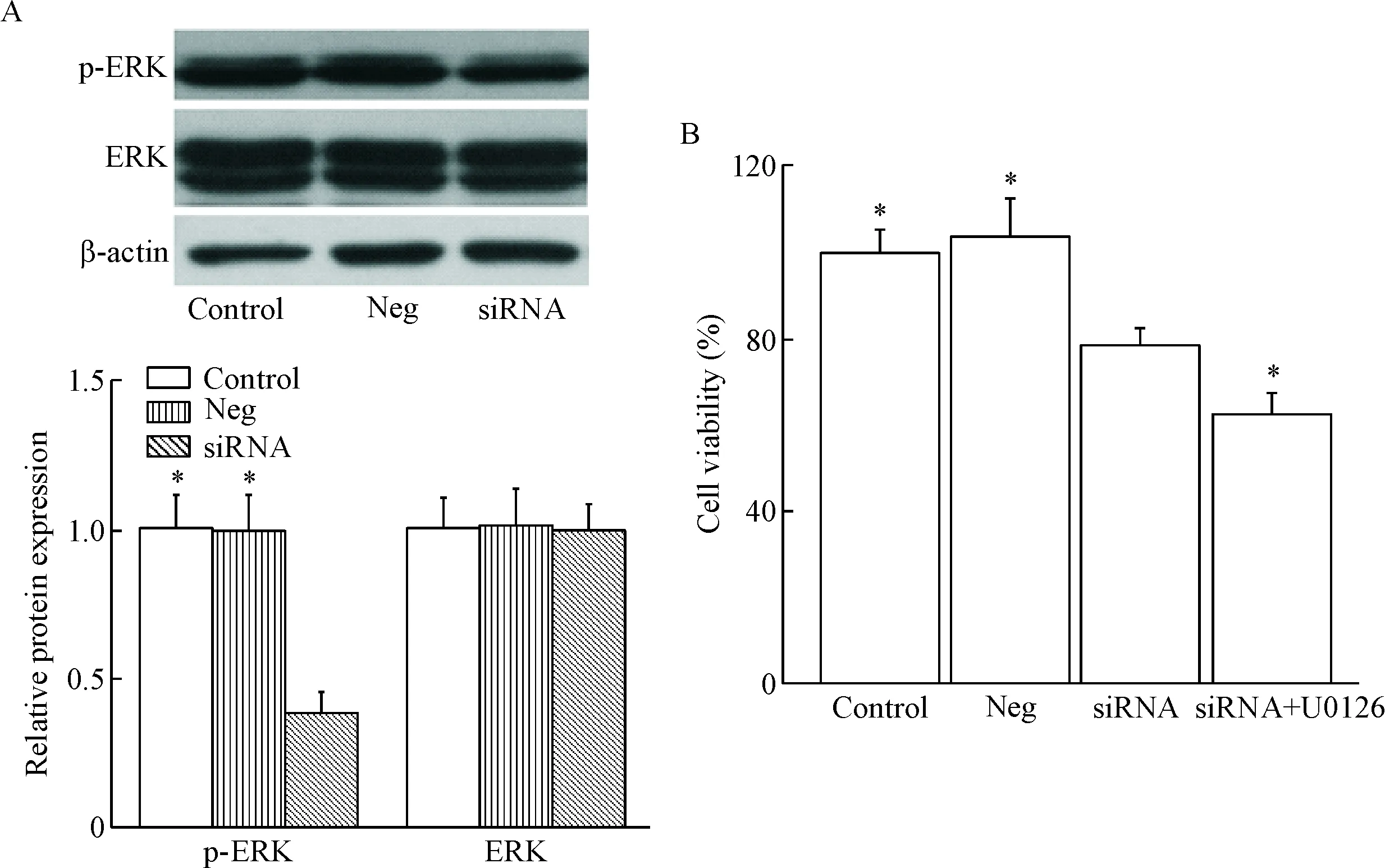
Figure 5. The effect ofPARP-1 knockdown on the activation of ERK. A: the expression of p-ERK and ERK in MCF-7/DDP cells after transfected withPARP-1 siRNA; B: the effect of U0126 incubation on cell viability. Mean±SD.n=6.*P<0.05vssiRNA group.
图5沉默PARP-1对MCF-7/DDP细胞ERK活性的影响
综上所述,乳腺癌顺铂耐药细胞MCF-7/DDP中沉默PARP-1可增强细胞对化疗药物的敏感性,并促进细胞经线粒体途径凋亡,其机制可能与抑制ERK信号通路的磷酸化有关。
[1] Rosenberg SM, Partridge AH. Management of breast can-cer in very young women[J]. Breast, 2015, 24(Suppl 2):S154-S158.
[2] Maruthanila VL, Elancheran R, Kunnumakkara AB, et al. Recent development of targeted approaches for the treatment of breast cancer[J]. Breast Cancer, 2017, 24(2):191-219.
[3] Niraula S, Ocana A. Mechanism of drug resistance in relation to site of metastasis: meta-analyses of randomized controlled trials in advanced breast cancer according to anticancer strategy[J]. Cancer Treat Rev, 2016, 50:168-174.
[4] Chen X, Lu P, Wu Y, et al. MiRNAs-mediated cisplatin resistance in breast cancer[J]. Tumour Biol, 2016, 37(10):12905-12913.
[5] Lv MM, Zhu XY, Chen WX, et al. Exosomes mediate drug resistance transfer in MCF-7 breast cancer cells and a probable mechanism is delivery of P-glycoprotein[J]. Tumour Biol, 2014, 35(11):10773-10779.
[6] Sun Z, Shi Y, Shen Y, et al. Analysis of different HER-2 mutations in breast cancer progression and drug resistance[J]. J Cell Mol Med, 2015, 19(12):2691-2701.
[7] Dong H, Yao L, Bi W, et al. Combination of survivin siRNA with neoadjuvant chemotherapy enhances apoptosis and reverses drug resistance in breast cancer MCF-7 cells[J]. J Cancer Res Ther, 2015, 11(4):717-722.
[8] Liu C, Srihari S, Lal S, et al. Personalised pathway ana-lysis reveals association between DNA repairpathway dysregulation and chromosomal instability in sporadic breast cancer[J]. Mol Oncol, 2016, 10(1):179-193..
[9] Li WJ, Zhong SL, Wu YJ, et al. Systematic expression analysis of genes related to multidrug-resistance in isogenic docetaxel- and adriamycin-resistant breast cancer cell lines[J]. Mol Biol Rep, 2013, 40(11):6143-6150.
[10] Wang M, Shu ZJ, Wang Y, et al. Stachydrine hydrochloride inhibits proliferation and induces apoptosis of breast cancer cells via inhibition of Akt and ERK pathways[J]. Am J Transl Res, 2017, 9(4):1834-1844.
[11] Gemble S, Buhagiar-Labarchède G, Onclercq-Delic R, et al. Cytidine deaminase deficiency impairs sister chromatid disjunction by decreasing PARP-1 activity[J]. Cell Cycle, 2017, 16(11):1128-1135.
[12] Rajawat J, Shukla N, Mishra DP. Poly(ADP-ribose) polymerase 1: a therapeutic hope in gynecologic cancers[J]. Front Biosci (Schol Ed), 2017, 9:343-356.
[13] Cui NH, Qiao C, Chang XK, et al. Associations of PARP-1 variant rs1136410 with PARP activities, oxidative DNA damage, and the risk of age-related cataract in a Chinese Han population: a two-stage case-control analysis[J]. Gene, 2017, 600:70-76.
[14] Martín-Guerreroa SM, Leóna J, Quiles-Pereza R, et al. Expression and single nucleotide polymorphism of poly (ADP-ribose) polymerase-1 in gastrointestinal tumours: clinical involvement[J]. Curr Med Chem, 2017, 24(20):2156-2173.
[15] Condorelli R, André F. Combining PI3K and PARP inhi-bitors for breast and ovarian cancer treatment[J]. Ann Oncol, 2017, 28(6):1167-1168.
[16] Luo Y, Tong L, Meng H, et al. MiR-335 regulates the chemo-radioresistance of small cell lung cancer cells by targeting PARP-1[J]. Gene, 2017, 600:9-15. doi: 10.1016/j.gene.2016.11.031.
[17] Li S, Cui Z, Meng X. Knockdown ofPARP-1 inhibits proliferation and ERK signals, increasing drug sensitivity in osteosarcoma U2OS cells[J]. Oncol Res, 2016, 24(4):279-286.
[18] Mishra D, Singh S, Narayan G. Curcumin induces apoptosis in pre-B acute lymphoblastic leukemia cell lines via PARP-1 cleavage[J]. Asian Pac J Cancer Prev, 2016, 17(8):3865-3869.
[19] Xu P, Liu X, Xiong X, et al. Flavonoids ofRosaroxburghiiTratt exhibit anti-apoptosis properties by regulating PARP-1/AIF[J]. J Cell Biochem, 2017, 118(11):3943-3952.
[20] Sun Y, Liu WZ, Liu T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35(6):600-604.
[21] Steelman LS, Chappell WH, Abrams SL, et al. Roles of the Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging[J]. Aging (Albany NY), 2011, 3(3):192-222.
[22] Weaver AN, Yang ES. Beyond DNA repair: additional functions of PARP-1 in cancer[J]. Front Oncol, 2013, 3:290.

