苦豆碱对缺血再灌注引起的H9c2心肌细胞损伤和炎症应答的作用
张会超, 徐 里, 芮浩淼, 曹程浩, 杨凤鸣, 袁 彬
(1河南省中医院, 河南 郑州 450002; 2河南中医药大学, 河南 郑州 450008)
心肌梗死是常见的缺血性心脏病之一,具有较高的发病率和致死率,已成为影响人类健康的重要杀手。在经手术治疗恢复血流的过程中,常会触发心肌的缺血再灌注(ischemic reperfusion,I/R)损伤,从而引起心肌细胞的凋亡,诱发炎症反应,造成心力衰竭和心律失常等临床上常见问题,严重影响治疗效果,是目前心脑血管研究领域亟待解决的关键问题[1]。苦豆碱(aloperine,Alo)是从中药苦豆子中分离出来的一种生物碱,具有抗炎、抗肿瘤及抗感染的功效[2]。大量研究表明,苦豆碱能够减缓慢性压迫性损伤引起的神经疼痛,保护氧糖剥夺再灌注引起的海马神经元损伤[3-4]。近期研究证实,苦豆碱可以保护缺血再灌注诱发的急性肾损伤[5]。但是,苦豆碱是否可以保护缺血再灌注损伤的心肌尚不清楚。因此,本研究通过体外缺氧/复氧方法来模拟缺血再灌注(simulated ischemia-reperfusion,SI/R)损伤,分析苦豆碱对SI/R引起的H9c2心肌细胞损伤及炎性应答的影响,并探讨可能的作用机制,从而进一步为心肌缺血再灌注损伤防治提供新的治疗策略。
材 料 和 方 法
1材料
大鼠H9c2胚胎心肌细胞株购自ATCC。苦豆碱购自上海邦景实业有限公司(纯度>99%);新生牛血清(华美生物工程有限公司);DMEM培养基、噻唑蓝[3-(4,5-dimethylthiazol-2-yl)2,5-diphenyl tetrazo-lium bromide,MTT]和PI3K/AKT信号通路抑制剂LY294002购自Sigma;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自BioVision;丙二醛(malondialdehyde,MDA)检测试剂盒购自南京建成生物制品研究所;BCA蛋白质定量试剂盒购自武汉博士德生物工程有限公司;抗大鼠p-PI3K p85、PI3K p85、p-AKT、AKT、Bcl-2和Bax抗体及辣根过氧化物酶标记的羊抗兔 II 抗均购自Abcam;检测白细胞介素(intreleukin,IL)-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和IL-1β的ELISA试剂盒购自Abcam。
2主要方法
2.1心肌细胞的培养 将H9c2细胞置于高糖DMEM完全培养集中培养(含10%胎牛血清)中培养,所有细胞均在37 ℃、5% CO2的培养箱中孵育。
2.2体外心肌细胞缺血再灌注模型的构建 采用缺氧/复氧的方法体外模拟体内心肌细胞I/R,即用DMEM培养基(不含糖和血清)培养细胞,并将其置于含95% N2和5% CO2的37℃培养箱中模拟缺氧环境,即对照组(control组);孵育10 h后置换含糖及血清的DMEM培养基,将细胞置于37 ℃培养箱(95% O2和5% CO2)中复氧,继续孵育4 h,即SI/R组。此外,设置苦豆碱处理(SI/R+Alo)组,即分别加入不同浓度的苦豆碱(20、50和100 mg/L)处理不同时间(8、12、24和48 h)后行SI/R;同时设置SI/R+ALo+LY294002(25 μmol/L)组。
2.3MTT实验检测细胞存活率 分别将500 μL细胞(2×107/L)接种于96孔培养板中,按上述条件处理后置换DMEM培养基,加入20 μL MTT(5 g/L)继续孵育4 h;按每孔150 μL加入DMSO以充分溶解结晶产物。将样品置于酶标仪上,测定490 nm处的吸光度(A),每孔重复3次。细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
2.4检测细胞上清中LDH和MDA的水平 收集不同处理组的细胞培养液,4 ℃、5 000×g离心 15 min,收集上清。按照试剂盒说明书分析细胞上清中LDH和MDA的水平。
2.5Annexin V/PI检测细胞凋亡 采用Annexin V/PI双重染色法检测细胞凋亡。收集不同处理组的细胞,PBS洗涤3次;加入配制好的结合缓冲液(250 μL)重悬细胞,调整至密度为1×109/L;将100 μL上述细胞悬液接种至5 mL流式管;加入Annexin V/FITC(5 μL)和 PI(10 μL)染色,室温下避光孵育;15 min后流式细胞仪检测细胞凋亡率。
2.6Caspase-3的活性分析 将不同处理组细胞收集后离心弃上清,加入细胞裂解液,冰上孵育15 min;12 000×g、4 ℃离心机离心;15 min后收集上清,按照caspase-3活性分析试剂盒说明书步骤于波长405 nm处测定A值,根据制备的标注曲线评估caspase-3活性。
2.7Western blot实验 收集不同处理组细胞,RIPA裂解液处理细胞,离心后采用BCA蛋白浓度测定试剂盒检测蛋白浓度。将等量样本处理后,进行SDS-PAGE,结束后采用半干转法进行转膜。将含有目的蛋白的NC膜用5%的脱脂奶粉封闭1.5 h;加入抗Bcl-2、Bax、p-PI3K p85、PI3K p85、p-AKT和AKT 的 I 抗,4 ℃过夜;TBST洗涤3次,加入辣根过氧化物酶标记的 II 抗,继续孵育1 h;用显影液ECL处理1 min,以β-actin为内参照放射自显影分析目标蛋白的表达水平。采用GS-800成像系统扫描图像,ImageJ定量分析条带灰度值。
2.8ELISA分析炎症因子的表达水平 收集不同处理组上清,采用ELISA法检测炎性因子IL-6、TNF-α和IL-1β的水平,具体操作按照ELISA试剂盒操作说明书进行。
3统计学处理
采用SPSS 17.0统计软件进行统计学分析,所有结果均采用均数±标准差(mean±SD)表示,两组间比较采用t检验,多组间比较采用单因素方差分析及SNK-q检验,所有实验至少重复3次以P<0.05为差异有统计学意义。
结 果
1苦豆碱对SI/R处理的H9c2心肌细胞损伤的影响
SI/R处理后,H9c2心肌细胞的存活率较对照组明显降低(P<0.05);当用苦豆碱预处理后,SI/R处理的心肌细胞的存活率明显增加,且在Alo 100 mg/L时效果最强(P<0.05),见图1A;随着苦豆碱作用时间的增加,SI/R受损的心肌细胞的存活率呈上升趋势,且在24 h和48 h时效果最强(P<0.05),见图1B。因此本研究选取100 mg/L苦豆碱作用24 h的实验条件进行后续分析。此外,苦豆碱可显著降低SI/R增加的LDH活性(P<0.05)及MDA含量(P<0.05),见图1C、D。

Figure 1. The effects of aloperine (Alo) on cardiomyocyte injury under SI/R condition. A: the viability of H9c2 cells treated with Alo at various doses; B: the viability of H9c2 cells treated with Alo for various time; C: the changes of LDH activity; D: the changes of MDA level. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsSI/R group.
图1苦豆碱对SI/R诱导的心肌细胞损伤的影响
2苦豆碱抑制SI/R诱发的H9c2心肌细胞凋亡
流式细胞术分析表明,SI/R处理明显诱导H9c2心肌细胞的凋亡(P<0.05),而苦豆碱(100 mg/L)处理可显著抑制细胞的凋亡率(P<0.05),见图2A;此外,苦豆碱可显著降低SI/R增加的caspase-3活性(P<0.05),见图2B。SI/R处理后,H9c2心肌细胞中Bcl-2/Bax比值明显降低(P<0.05),而苦豆碱能够显著增加Bcl-2/Bax比值(P<0.05),见图2C。
3苦豆碱对SI/R处理的H9c2心肌细胞促炎性因子水平的影响
ELISA分析证实,与对照组相比,SI/R处理后H9c2心肌细胞中促炎因子IL-6、TNF-α和IL-1β的浓度显著增加(P<0.05),而苦豆碱作用后,IL-6、TNF-α和IL-1β的浓度均较SI/R组明显降低(P<0.05),提示苦豆碱可显著降低SI/R诱发炎性因子的水平,见图3。
4苦豆碱对SI/R作用下H9c2心肌细胞中PI3K/AKT通路的影响
与对照组相比,SI/R处理后H9c2心肌细胞中p-PI3K p85和p-AKT的蛋白水平有不同程度的升高(P<0.05),当用苦豆碱作用后,细胞中p-PI3K p85和p-AKT的蛋白水平进一步升高(P<0.05),提示苦豆碱能够加强SI/R作用下H9c2心肌细胞中PI3K/AKT通路的活化,见图4。
Figure 2. The effects of aloperine (Alo) on the cardiomyocyte apoptosis under SI/R condition. A: the cell apoptosis detected by flow cytometry; B: the changes of caspase-3 activity; C: the protein expression of Bcl-2 and Bax determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsSI/R group.
图2苦豆碱对SI/R处理的心肌细胞凋亡的影响
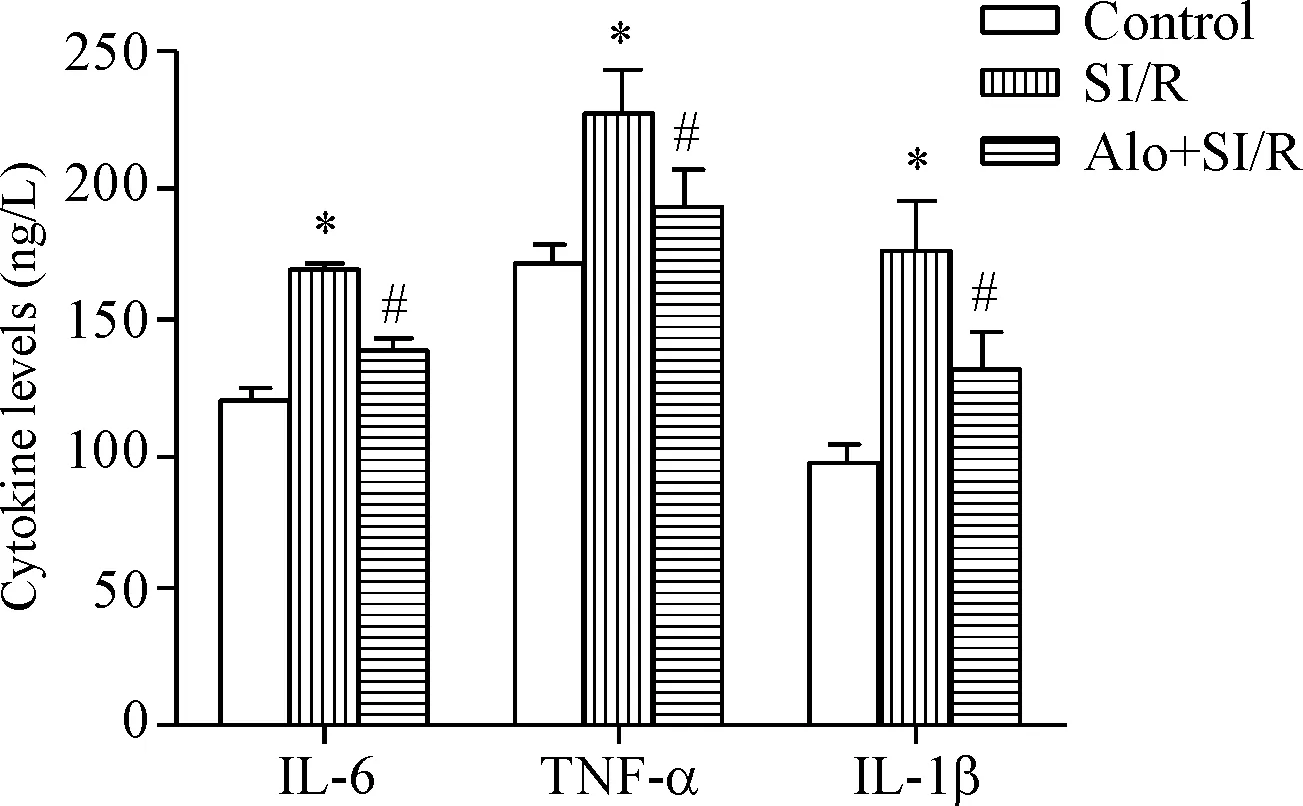
Figure 3. The effects of aloperine (Alo) on the levels of inflammatory cytokines in the H9c2 cells with SI/R. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsSI/R group.
图3苦豆碱对SI/R处理的心肌细胞炎性因子水平的影响
5苦豆碱通过激活PI3K/AKT通路减轻SI/R引起的H9c2心肌细胞损伤及炎症水平
与SI/R+Alo组相比,采用LY294002处理后,H9c2细胞中p-AKT的蛋白水平明显降低(P<0.01),见图5A;阻断PI3K/AKT通路后,苦豆碱上调的细胞存活率明显降低(P<0.05),见图5B;同时苦豆碱发挥的抗SI/R心肌细胞的凋亡能力显著下降(P<0.05),见图5C;此外,苦豆碱下调的促炎因子水平也明显上升(P<0.05),见图5D。
讨 论
心肌缺血恢复血流供应后造成的再灌注损伤能够引起心律不齐和心力衰竭等问题,是目前临床上影响缺血性心血管疾病治疗效果不理想的关键原因。大量研究已证实苦豆碱在抗炎、抗肿瘤、保护海马神经元损伤及肾脏的I/R中起重要作用[2, 4-5]。但是,苦豆碱对心肌I/R的作用及机制尚不明确。
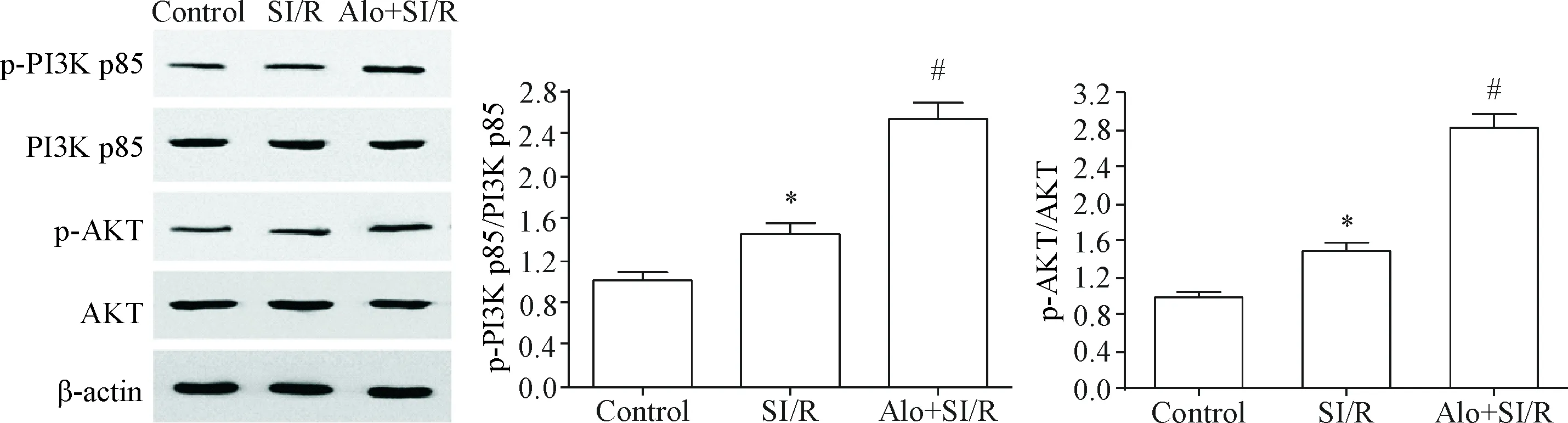
Figure 4. The effects of aloperine (Alo) on the protein levels of PI3K/AKT pathway-related molecules in the H9c2 cells with SI/R. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsSI/R group.
图4苦豆碱对SI/R细胞中PI3K/AKT信号通路的影响
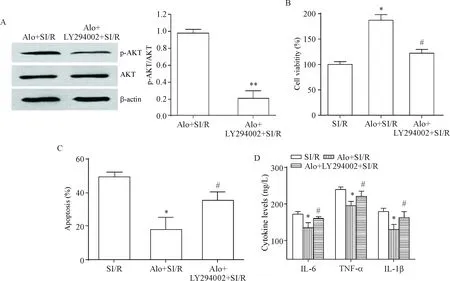
Figure 5. The effects of PI3K/AKT pathway on the protective role of aloperine in attenuating injury and inflammation in the H9c2 cells with SI/R. A: the effect of LY294002 on the protein levels of AKT and p-AKT; B~D: the effect of LY294002 on the viability (B), apoptosis (C) and inflammatory cytokine levels (D) in aloperine (Alo)-treated cells with SI/R. Mean±SD.n=3.*P<0.05vsSI/R group;#P<0.05,##P<0.01vsSI/R+Alo group.
图5PI3K/ATK通路参与苦豆碱介导的SI/R心肌细胞损伤及炎症应答
已知H9c2细胞具有与原代培养的乳鼠心肌细胞类似的功能,因此,本研究通过缺氧/复氧处理H9c2细胞来模拟体内心肌I/R损伤,从而探讨苦豆碱对心肌I/R的作用及机制。结果发现,苦豆碱能够提高SI/R抑制的H9c2心肌细胞的存活率。已有研究证实,缺血再灌注损伤能够引起心肌细胞凋亡,导致LDH等释放进入血液中,可以从一个方面反映出心肌的坏死程度[6-7]。此外,该过程中活性氧的增多会进一步加重心肌的损伤,其中MDA是常见的评估氧化应激损伤的标记分子[8]。本研究发现,苦豆碱作用后能够抑制SI/R诱导的H9c2心肌细胞中LDH及MDA的水平。此外,苦豆碱还可明显抑制SI/R处理引起的H9c2心肌细胞的凋亡,降低caspase-3的活性,同时增加抗凋亡分子Bcl-2的水平。因此,这些结果提示苦豆碱具有减轻缺血再灌注引起的心肌细胞损伤的作用。
越来越多的研究表明,缺血后心脏功能的损伤及细胞坏死程度与体内促炎因子的水平直接相关,炎症反应能够加重缺血再灌注后组织的损伤及凋亡[6, 9-10]。心脏缺血再灌注后伴随有IL-6、TNF-α和IL-1β等促炎因子释放的增加,从而引起大量炎性细胞聚集,造成血管堵塞、管腔狭窄和心肌细胞凋亡,其中,TNF-α高表达与心力衰竭程度、心肌梗塞等密切相关[11-12]。此外,大量研究证实,抑制心肌细胞的凋亡及炎症应答能够减缓心肌的I/R损伤进程[13-14]。与前期研究一致,体外SI/R处理后,H9c2心肌细胞中炎性因子IL-6、TNF-α和IL-1β的水平明显增加[12]。更为重要的是,苦豆碱处理能够明显抑制上述炎性因子的释放,提示苦豆碱有可能通过抑制炎症应答来减缓心肌I/R损伤。
为进一步探讨苦豆碱抑制SI/R引起的心肌细胞损伤及炎性应答的作用机制,本研究探讨了PI3K/AKT通路在该过程中的作用。大量研究证实,PI3K/AKT信号通路可参与包括心肌和肾脏在内的多种缺血再灌注损伤的修复进程[11, 13, 15]。当激活PI3K/AKT通路后,缺血再灌注引起的心肌凋亡及炎症应答均受到抑制,从而对抗心肌的I/R损伤,减少心肌的坏死及保护心脏功能[12, 14, 16-17]。在缺血再灌注的条件下,受损心肌细胞中PI3K/AKT通路被激活,在心肌的损伤应答中发挥重要作用[12]。本研究也证实,SI/R处理下,PI3K/AKT被适度激活。但是,该过程中PI3K/AKT的激活显示出一定程度的增加,但不能大量活化,这也许是导致缺血再灌注条件下机体自身无法完全修复心肌损伤的原因。在糖尿病大鼠中,大量激活PI3K/AKT也能够减缓I/R诱导的心肌凋亡[15]。本研究发现,给予苦豆碱处理可明显提高H9c2心肌细胞中PI3K/AKT信号通路的活化,而LY294002处理可明显抑制上述进程。进一步分析发现,抑制PI3K/AKT通路后,苦豆碱促进的SI/R心肌细胞存活率降低,同时其发挥的抑制心肌细胞凋亡及炎性因子水平的作用明显减弱。因此,上述结果提示PI3K/AKT可能参与苦豆碱发挥的抗心肌I/R损伤进程。
综上所述,苦豆碱可通过激活PI3K/AKT通路发挥抗SI/R引起的心肌细胞损伤及炎症应答。因此,本研究提示苦豆碱有可能通过抑制心肌细胞凋亡及炎症应答对缺血再灌注损伤条件下的心肌起保护作用。
[1] Ibanez B, Heusch G, Ovize M, et al. Evolving therapies for myocardial ischemia/reperfusion injury[J]. J Am Coll Cardiol, 2015, 65(14):1454-1471.
[2] 金少举, 金道欣, 王文宝, 等. 苦豆碱药理学研究进展[J]. 中药药理与临床, 2015, 31(3):214-217.
[3] Xu YQ, Jin SJ, Liu N, et al. Aloperine attenuated neuropathic pain induced by chronic constriction injury via anti-oxidation activity and suppression of the nuclear factor κB pathway[J]. Biochem Biophys Res Commun, 2014, 451(4):568-573.
[4] 郝银菊, 周 茹, 姚婉霞, 等. 苦豆碱对氧糖剥夺再灌注损伤后海马神经元的保护作用[J]. 中药药理与临床, 2016, 32(1):44-46.
[5] Hu S, Zhang Y, Zhang M, et al. Aloperine protects mice against ischemia-reperfusion (IR)-induced renal injury by regulating PI3K/AKT/mTOR signaling and AP-1 activity[J]. Mol Med, 2015, 21(1):912-923.
[6] Guo J, Wang SB, Yuan TY, et al. Coptisine protects rat heart against myocardial ischemia/reperfusion injury by suppressing myocardial apoptosis and inflammation[J]. Atherosclerosis, 2013, 231(2):384-391.
[7] Yu Q, Zhou N, Nan Y, et al. Effective glycemic control critically determines insulin cardioprotection against ischemia/reperfusion injury in anesthetized dogs[J]. Cardiovasc Res, 2014, 103(2):238-247.
[8] Yang M, Chen J, Zhao J, et al. Etanercept attenuates myocardial ischemia/reperfusion injury by decreasing inflammation and oxidative stress[J]. PLoS One, 2014, 9(9):e108024.
[9] 孟秋宏, 王剑波. 心肌缺血/再灌注损伤中炎症反应作用机制的研究进展[J]. 临床内科杂志, 2014, 31(3):214-216.
[10] 郭庆军, 王桂敏, 张秀秀. 淫羊藿苷预处理对心肌缺血再灌注损伤炎症反应的影响[J]. 中国病理生理杂志, 2013, 29(11):2034-2038.
[11] Tian M, Yuan YC, Li JY, et al. Tumor necrosis factor-α and its role as a mediator in myocardial infarction: a brief review[J]. Chronic Dis Transl Med, 2015, 1(1):18-26.
[12] Ren R, Xiao X. Erythropoietin pretreatment suppresses inflammation by activating the PI3K/Akt signaling pathway in myocardial ischemia-reperfusion injury[J]. Exp Ther Med, 2015, 10(2):413-418.
[13] Li Q, Shen L, Wang Z, et al. Tanshinone IIA protects against myocardial ischemia reperfusion injury by activating the PI3K/Akt/mTOR signaling pathway[J]. Biomed Pharmacother, 2016, 84:106-114.
[14] Park BM, Cha SA, Lee SH, et al. Angiotensin IV protects cardiac reperfusion injury by inhibiting apoptosis and inflammation via AT4R in rats[J]. Peptides, 2016, 79:66-74.
[15] Chen K, Li G, Geng F, et al. Berberine reduces ische-mia/reperfusion-induced myocardial apoptosis via activating AMPK and PI3K-Akt signaling in diabetic rats[J]. Apoptosis, 2014, 19(6):946-957.
[16] Zhang J, Wang C, Yu S, et al. Sevoflurane postconditio-ning protects rat hearts against ischemia-reperfusion injury via the activation of PI3K/AKT/mTOR signaling[J]. Sci Rep, 2014, 4:7317.
[17] Liu Y, Yang H, Liu L X, et al. NOD2 contributes to myocardial ischemia/reperfusion injury by regulating cardiomyocyte apoptosis and inflammation[J]. Life Sci, 2016, 149:10-17.

