原花青素对Aβ25-35作用下PC12细胞的保护作用*
汪 琴, 杨 燕, 王 东, 安 俊, 张 力, 叶茂斌
(华中科技大学同济医学院附属武汉中心医院神经内科, 湖北 武汉 430024)
阿尔茨海默病(Alzheimer disease,AD)又称原发性老年痴呆,是一种老年人群最常见的神经退行性疾病。流行病学调查研究发现,AD患病率呈现随年龄增长而发病率升高的趋势。数据显示[1],年龄在65岁以上的人群中AD患病率约为5%,而在年龄85岁以上的人群中其患病率达到20%左右。在临床表现上,AD患者表现出渐进性的记忆衰退、认知功能障碍、语言能力退化、判断力下降和丧失生活自理能力,最终导致死亡[2]。阿尔兹海默病其病理特征主要表现为β-淀粉样蛋白(β-amyloid,Aβ)沉积、神经元纤维缠结、神经元和突触丢失以及脑血管淀粉样病变等[3-4]。迄今为止,关于AD的有效治疗方案并没有得以实现,目前临床上使用较多的药物为胆碱酯酶抑制剂和N-甲基-D-天冬氨酸受体拮抗剂等,不但经济花费大,而且并不能逆转病情的持续恶化。所以进一步探索AD的病因及发病风险因素,对预防AD的发生发展至关重要。
原花青素(procyanidins,PC)是一种天然的强效抗氧化剂,具有较强的抗氧化和清除活性氧簇(reactive oxygen species,ROS) 的能力,还具有抗肿瘤、预防心血管疾病及改善人体微循环等多重功效。已有研究表明,神经中枢的过氧化损伤以及机体抗氧化能力降低所致的氧化-还原稳态失衡是AD发病机制中的关键因素[5-6]。据此推测原花青素对AD患者的治疗有着广阔的前景,但相关临床基础研究鲜有报道。本研究采用Aβ25-35处理PC12细胞诱导细胞损伤,观察原花青素对PC12细胞是否具有保护作用及可能的机制,从而为AD的临床治疗提供新的参考。
材 料 和 方 法
1 材料与仪器
PC12细胞购自中国科学院上海细胞生物学研究所;原花青素(纯度≥98%)购自成都德锐可生物科技有限公司;二氯二氢荧光素二乙酸酯(DCFH-DA)、MTT、DMSO和Aβ25-35均购自Sigma;DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自Gibco;JC-10线粒体膜电位检测试剂盒和Annexin V-FITC/PI细胞凋亡检测试剂盒均购自上海碧云天生物技术有限公司;兔抗人caspase-3 多克隆抗体和兔抗人GAPDH单克隆抗体购自Cell Signaling Techno-logy。酶标仪购自Bio-Rad;流式细胞仪购自BD;全自动数码凝胶成像仪购自上海天能科技有限公司。
2 方法
2.1细胞培养及分组处理 PC12细胞使用含10% FBS、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基复苏,并置于37 ℃、5% CO2的培养箱中培养。待细胞单层生长至90%左右密度时,使用0.25%胰酶37 ℃消化传代。根据实验需求分为对照(control)组、模型组和PC处理(PC)组。每组设4个平行孔,PC组分别加入终浓度为25、50和100 mg/L的原花青素,对照组和模型组分别以等量含10% FBS的DMEM培养基代替,培养24 h后在模型组和各处理组中分别加入终浓度为25 μmol/L的Aβ25-35继续培养48 h,进行后续实验检测。
2.2MTT检测细胞存活率 取对数生长期的PC12细胞,以每孔1×103个接种于96孔板中,细胞分组处理后,在避光条件下每孔加入终浓度为5 g/L的MTT 20 μL,置于培养箱中继续培养4 h,弃上清每孔加入100 μL DMSO,轻轻振荡10 min,待紫色甲瓒颗粒充分溶解后,置于酶标仪上测波长为570 nm处的吸光度(A),取均值计算细胞存活率。细胞存活率(%)=(实验组A-空白组A)/(对照组A-空白组A)×100%。
2.3AnnexinⅤ/PI双染流式细胞术检测细胞凋亡 取对数生长期的PC12细胞,以每孔1×104个接种于6孔板中,细胞分组处理后,0.25%胰酶消化收集细胞,调整细胞浓度为1×108/L,经离心、洗涤后加入500 μL Incubation Buffer重悬细胞,加5 μL Annexin V-FITC混匀,再加5 μL PI充分混匀,避光孵育15 min,上流式细胞仪进行检测,实验重复3次。
2.4Western blot 检测凋亡蛋白caspase-3的表达 取对数生长期的PC12细胞接种于细胞培养皿中,待细胞生长至60%的细胞密度时进行细胞分组处理。处理结束后吸去培养液,使用PBS洗2次,使用细胞刮收集细胞于15 mL离心管中,1 500 r/min离心5 min,弃上清留细胞沉淀,视细胞沉淀体积适量加入RIPA裂解液,在冰上充分裂解30 min,4 ℃、12 000 r/min离心20 min,收集上清,采用Bradford法进行蛋白定量。取25 μg 蛋白进行SDS-PAGE,并将蛋白转移至PVDF膜上,5%脱脂奶粉室温孵育1 h,分别加入兔抗人caspase-3 多克隆抗体(1∶1 000)和兔抗人GAPDH单克隆抗体(1∶1 000)4 ℃孵育过夜,TBS洗涤3次,加入II抗HRP AffiniPure Goat Anti-Rabbit IgG(1∶10 000)室温孵育1 h,TBS洗涤3次,ECL发光显色,采用全自动数码凝胶图像分析系统自动显影与数据分析,实验重复3次。
2.5流式细胞术检测细胞内ROS含量 取对数生长期的PC12细胞,以每孔1×104个接种于6孔板中,待细胞生长至60%时进行分组处理。处理结束后用0.25%胰酶消化收集细胞,调整细胞密度为1×108/L,经离心、洗涤后加入荧光探针DCFH-DA 10 μmol/L,37 ℃避光孵育30 min,流式细胞仪上机检测,实验重复3次。
2.6流式细胞术检测细胞线粒体膜电位的变化 接种处于对数生长期的PC12细胞于6孔板中,待细胞生长至60%时进行分组处理。处理结束后0.25%胰酶消化收集细胞,调整细胞密度为1×108/L,经离心、洗涤后加入2 μmol/L JC-10,37 ℃避光孵育1 h,流式细胞仪上机检测,实验重复3次。
3统计学分析
采用SPSS 19.0软件进行统计分析,计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素分析,采用GraphPad Prism 5.0 软件进行结果作图分析,以P<0.05为差异有统计学意义。
结 果
1原花青素提高Aβ25-35作用下PC12细胞的存活率
采用25 μmol/L的Aβ25-35与PC21细胞共培养48 h后,相对于对照组,模型组的细胞存活率下降至(41.67±3.86)%,差异具有统计学意义(P<0.01)。25 mg/L、50 mg/L和100 mg/L的原花青素预处理,相对于模型组,PC12细胞存活率逐步提高,依次为(53.00±2.45)%、(65.00±4.08)%和(84.33±5.31)%(P<0.05或P<0.01)。说明原花青素可以抑制Aβ25-35对PC12细胞的损伤作用,见图1。
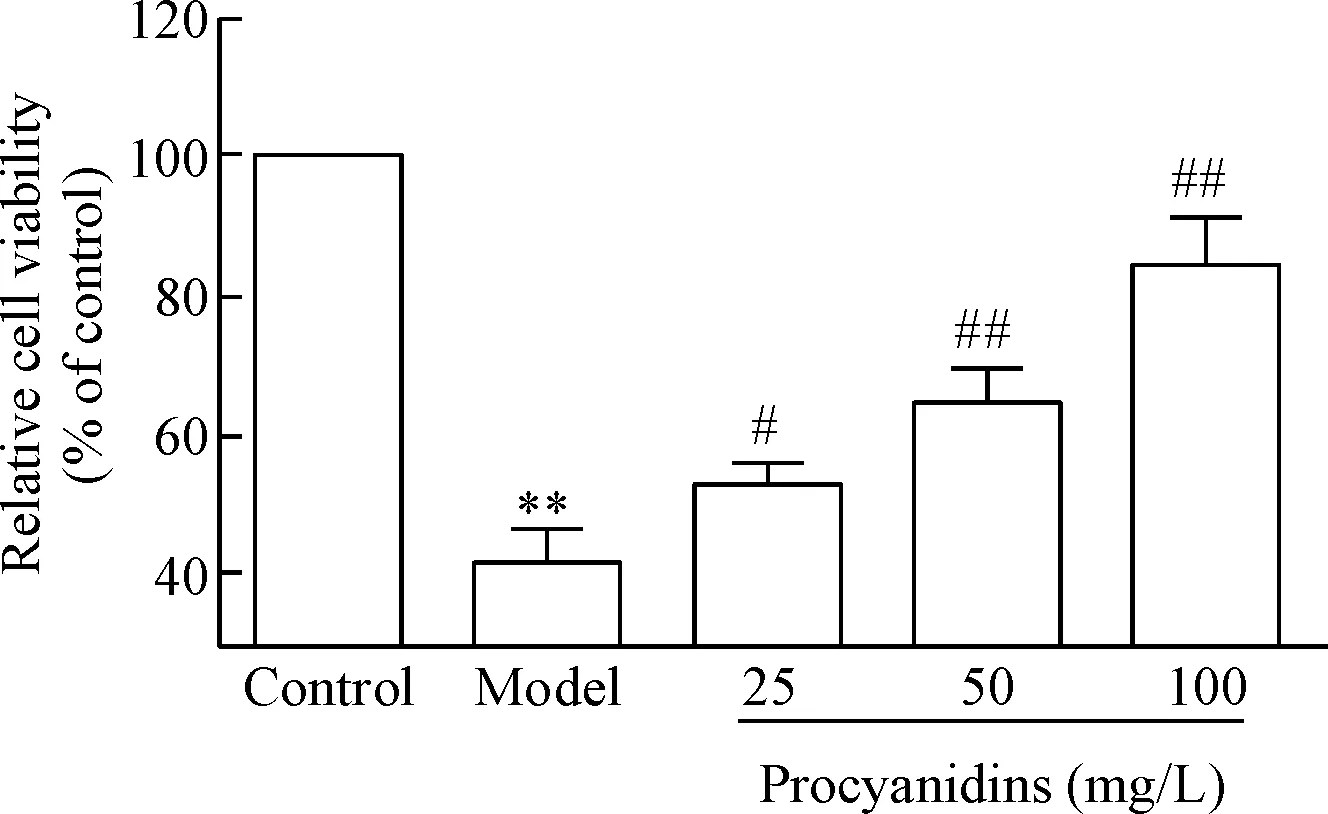
Figure 1. The effect of procyanidins on the viability of PC12 cells exposed to Aβ25-35. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图1原花青素对Aβ25-35作用下PC12细胞存活率的影响
2原花青素降低Aβ25-35诱导的PC12细胞内的ROS水平
利用DCFH-DA荧光探针单染,流式细胞术检测细胞内活性氧水平的结果显示,与Aβ25-35共培养后,模型组细胞内的ROS水平急剧上升,与对照组比较差异有统计学意义(P<0.01),说明Aβ25-35作用下PC12细胞的氧化损伤较严重。而经过不同浓度的原花青素预处理后,发现随着原花青素浓度的升高,细胞内ROS水平逐渐降低,与模型组比较差异有统计学意义(P<0.01),说明原花青素能够清除Aβ25-35诱导的PC12细胞内异常增多的ROS,见图2。
3原花青素阻碍Aβ25-35作用下PC12细胞线粒体膜电位的下降
JC-10单染流式细胞术检测细胞线粒体膜电位的结果所示,与Aβ25-35共培养后,模型组细胞线粒体膜电位急剧下降,与对照组比较差异具有统计学意义(P<0.01)。采用不同浓度原花青素预处理后,发现Aβ25-35作用下PC12细胞的线粒体膜电位下降程度有所减弱,说明原花青素对AD模型细胞的线粒体膜具有保护作用,可维持线粒体膜的完整性,见图3。
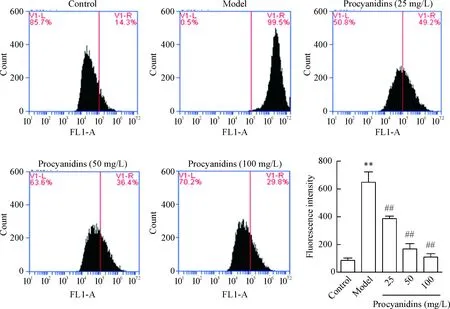
Figure 2. The effect of procyanidins on the intracellular ROS level of PC12 cells exposed to Aβ25-35. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsmodel group.
图2原花青素对Aβ25-35作用下PC12细胞内ROS水平的影响
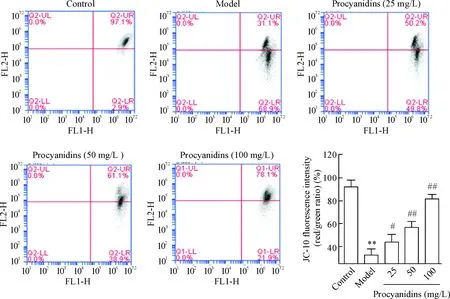
Figure 3. The effect of procyanidins on the mitochondrial membrane potential of PC12 cells exposed to Aβ25-35. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图3原花青素对AD细胞模型PC12细胞线粒体膜电位的影响
4原花青素抑制Aβ25-35诱导的PC12细胞凋亡
Western blot结果显示,Aβ25-35作用下模型组PC12细胞中凋亡蛋白caspase-3的切割活性最高,不同浓度原花青素预处理后caspase-3切割活性随原花青素浓度的升高而降低(P<0.01),见图4A。而且,AnnexinⅤ/PI双染流式细胞术检测细胞凋亡结果显示,Aβ25-35共培养后可导致PC12细胞凋亡率上升至(43.77±3.67)%,远高于对照组的(8.63±1.48)%,两组比较差异有统计学意义(P<0.01)。采用不同浓度原花青素预处理后,原花青素可降低AD模型细胞PC12的凋亡率,与模型组比较差异具有统计学意义(P<0.01),说明原花青素能够抑制AD模型PC12细胞的凋亡,见图4B。
讨 论
AD是一种发病机制十分复杂的弥漫性中枢神经系统退行性疾病。目前,Aβ的毒性级联反应被公认为是AD病理进程中的关键环节[7],而氧化应激则是Aβ病理机制中的关键影响因子[8-9]。有研究表明,AD患者体内存在大量活性氧的产生以及抗氧化能力的下降[10]。氧化-还原稳态失衡可导致毒性活性氧簇的产生,增加Aβ的生产。Aβ在脑内聚集,星形胶质细胞和小胶质细胞被激活,进行性突触和神经突触受损,引起氧化应激损伤,最终导致细胞凋亡[11]。大量研究表明[12-13],Aβ25-35处理可以复制AD的病理过程。因此,本研究采用Aβ25-35体外处理PC12细胞,探讨AD的发病机制。
原花青素是一种强效的抗氧化剂,其抗氧化能力强于维生素C和维生素E[14],能够抑制体内氧自由基的生成以及脂质过氧化反应,减少星形胶质细胞和小胶质细胞的活化[15]。原花青素在医药、保健食品和化妆品等领域中广泛应用,是极具发展前景的天然植物提取物。
本实验中使用25 μmol/L的Aβ25-35与PC12细胞共培养48 h,用不同浓度(25 mg/L、50 mg/L和100 mg/L)的原花青素预处理均能使Aβ25-35作用下的PC12细胞存活率明显提高,其中以100 mg/L原花青素最为明显,说明原花青素对PC12细胞具有保护作用。有研究表明,原花青素能减轻H2O2引起PC12细胞的氧化损伤[16],提示原花青素对PC12细胞的保护作用可能是通过减轻细胞氧化损伤的途径实现的。ROS是机体内各种形式的氧自由基和非氧自由基形式存在的含氧化合物的总称,机体内ROS含量的高低能够反映机体氧化损伤程度[17]。细胞内ROS含量检测结果显示,与Aβ25-35共培养后,PC12细胞中ROS含量显著上升,说明Aβ导致PC12细胞的氧化损伤较严重。而经过不同浓度的原花青素预处理后,发现随着原花青素浓度的升高细胞内ROS含量逐渐降低,说明原花青素能够清除Aβ25-35作用下细胞内异常增多ROS。蔡洪斌等[18]研究也表明,葡萄籽原花青素可清除AD 模型大鼠脑组织中氧自由基。另外,线粒体是机体动力工厂,也是机体ROS产生的场所。原花青素清除机体ROS可能与线粒体功能相关。本研究实验结果显示,与对照组比较,Aβ25-35作用下细胞的线粒体膜电位下降非常明显,而原花青素预处理组细胞线粒体膜电位下降幅度并不明显,尤其是100 mg/L原花青素组,说明原花青素对线粒体双层膜具有保护作用,可能是通过清除线粒体内产生的ROS,减弱了ROS对线粒体膜的攻击作用。
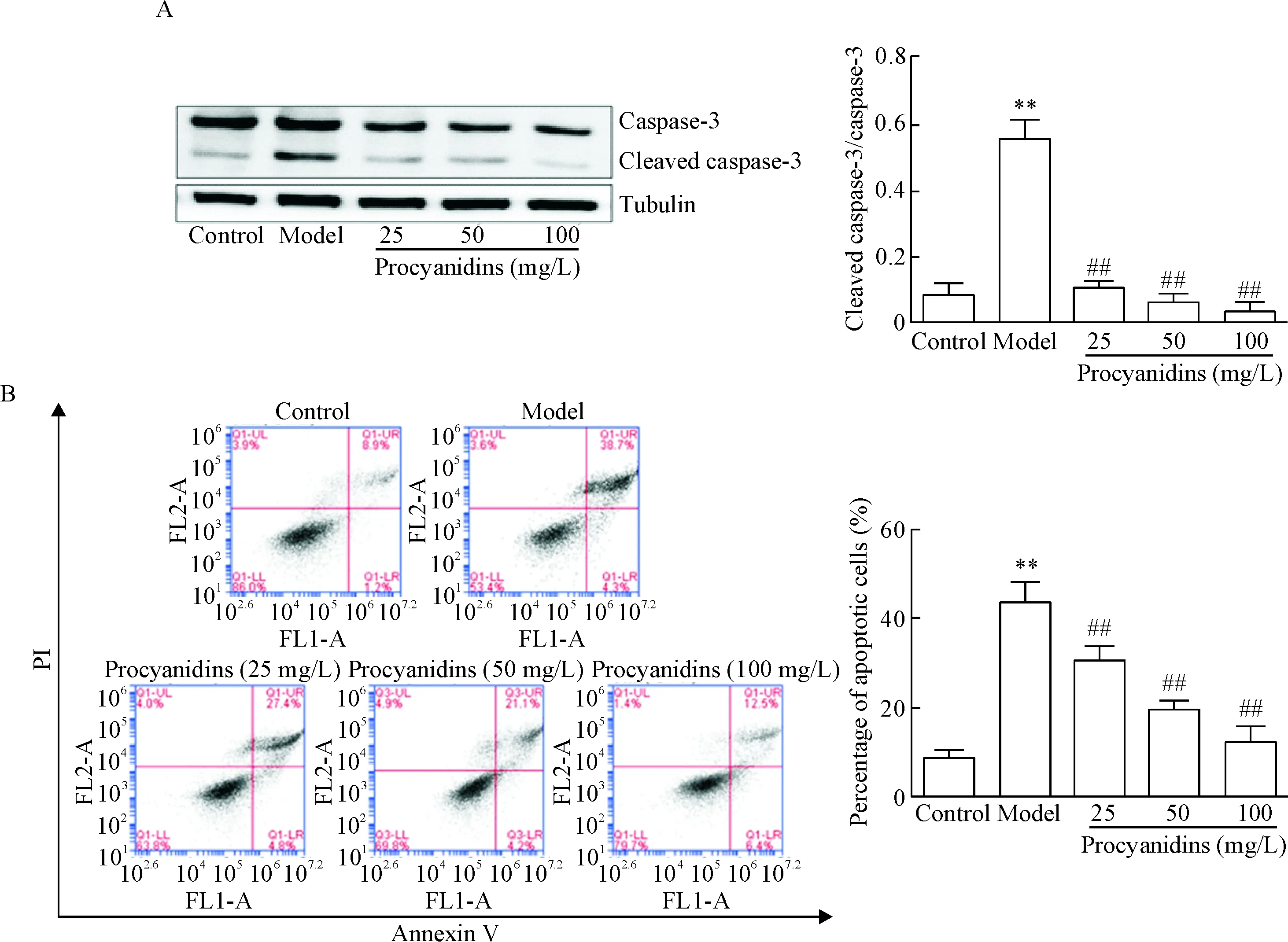
Figure 4. The effect of procyanidins on the apoptosis of PC12 cells exposed to Aβ25-35. A: the protein level of cleaved caspase-3 was detected using Western blot; B: the apoptosis of PC12 cells was detected by flow cytometry. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsmodel group.
图4原花青素对Aβ25-35诱导的PC12细胞凋亡的影响
线粒体膜电位下降可以导致线粒体内膜通透性增加,进一步促进线粒体内部氧自由基以及促凋亡因子的释放。有研究表明,线粒体膜电位的下降是细胞凋亡的早期事件[19]。原慧萍等[20]等研究发现原花青素可抑制微波诱导视网膜神经节细胞凋亡的发生。本研究结果显示,与Aβ25-35共培养后,PC12细胞凋亡明显,而原花青素预处理后,随着原花青素的浓度升高而细胞的凋亡率逐渐下降。而且Western blot检测凋亡蛋白caspase-3的结果也显示,模型组的cleaved caspase-3活性最高,随着原花青素预处理浓度的升高cleaved caspase-3的活性逐渐降低。说明,原花青素能够抑制Aβ25-35作用下PC12细胞的凋亡。
综上所述,原花青素通过清除Aβ25-35作用下PC12细胞内的ROS含量,减轻细胞线粒体膜氧化损伤,最终抑制细胞发生凋亡,进而对Aβ25-35作用下PC12细胞产生保护作用。因此,原花青素有望成为治疗AD的一种潜在药物。
[1] 段 磊, 司继刚, 刘 萍. 阿尔茨海默病药物治疗研究进展[J]. 河北医药, 2015, 37(7):1077-1080.
[2] 王灵芝, 呼日勒特木尔. 金属离子在阿尔茨海默病中的作用[J]. 疑难病杂志, 2015, 14(3):319-322.
[3] Bagyinszky E, Giau VV, Shim K,et al. Role of inflammatory molecules in the Alzheimer’s disease progression and diagnosis[J]. J Neurol Sci, 2017, 376(15):242-254.
[4] 陈晓春. 新近推出的阿尔茨海默病诊断标准的临床实用性[J]. 中华神经科杂志, 2012, 45(5):289-291.
[5] Tönnies E, Trushina E. Oxidative stress, synaptic dysfunction, and Alzheimer’s disease[J]. J Alzheimers Dis, 2017, 57(4):1105-1121.
[6] Huang WJ, Xia Z, Chen WW. Role of oxidative stress in Alzheimer’s disease[J]. Arch Neurol, 2016, 4(5):519-522.
[7] Selivanova OM, Surin AK, Marchenkov VV, et al. The mechanism underlying amyloid polymorphism is opened for Alzheimer’s disease amyloid-β peptide[J]. J Alzheimers Dis, 2016, 54(2):821-830.
[8] Ganguly G, Chakrabarti S, Chatterjee U, et al. Proteino-pathy, oxidative stress and mitochondrial dysfunction: cross talk in Alzheimer’s disease and Parkinson’s disease[J]. Drug Des Devel Ther, 2017, 11:797-810.
[9] Jiang T, Qian S, Chen S. Oxidative stress: a major pathogenesis and potential therapeutic target of antioxidative agents in Parkinson’s disease and Alzheimer’s disease[J]. Prog Neurobiol, 2016, 147:1-19.
[10] Umeno A, Biju V, Yoshida Y.InvivoROS production and use of oxidative stress-derived biomarkers to detect the onset of diseases such as Alzheimer’s disease, Parkinson’s disease, and diabetes[J]. Free Radic Res, 2017,51(4):1-15.
[11] 何 清, 杨思雨, 汪 琴, 等. 原花青素对β淀粉样蛋白25-35诱导的小鼠海马神经细胞毒性的影响[J]. 中国临床神经科学, 2014, 22(5):481-488.
[12] Li L, Xu S, Liu L, et al. Multifunctional compound AD-35 improves cognitive impairment and attenuates the production of TNF-α and IL-1β in an Aβ25-35-induced rat model of Alzheimer’s disease[J]. J Alzheimers Dis, 2017, 56(4):1403-1417.
[13] 艾合麦提·图尔贡. 阿里红提取物对Aβ25-35诱导大鼠及PC12细胞痴呆模型保护作用机制的研究[D]. 乌鲁木齐: 新疆医科大学, 2016.
[14] Fracassetti D, Costa C, Moulay L, et al. Ellagic acid derivatives, ellagitannins, proanthocyanidins and other phenolics, vitamin C and antioxidant capacity of two powder products from camu-camu fruit (Myrciariadubia)[J]. Food Chem, 2013, 139(1-4):578-588.
[15] Reddy PH. Amyloid precursor protein-mediated free radicals and oxidative damage: implications for the development and progression of Alzheimer’s disease[J]. J Neurochem, 2006, 96(1):1-13.
[16] 马玉红, 窦德宇, 柳春燕, 等. 原花青素对体外阿尔茨海默病的预防作用[J]. 皖南医学院学报, 2014, 33(3):199-201.
[17] Sakellariou GK, Pearson T, Lightfoot AP, et al. Mitochondrial ROS regulate oxidative damage and mitophagy but not age-related muscle fiber atrophy[J]. Sci Rep, 2016, 6:33944.
[18] 蔡洪斌, 王 峰, 张义军. 原花青素对阿尔茨海默病模型大鼠脑组织的预防保护作用[J]. 中国老年学, 2011, 31(22):4408-4410.
[19] Sinha K, Das J, Pal PB, et al. Oxidative stress: the mitochondria-dependent and mitochondria-independent pathways of apoptosis[J]. Arch Toxicol, 2013, 87(7):1157-1180.
[20] 原慧萍, 马春阳, 周欣荣, 等. 原花青素对微波诱导视网膜神经节细胞凋亡的拮抗作用[J]. 中国病理生理杂志, 2008, 24(4):812-814.

