葡萄皮天然色素的提取工艺及其稳定性研究
冯靖,时玉正,邱晓,彭效明,李翠清,晁建平,居瑞军(北京石油化工学院,北京102617)
葡萄,又被称为山葫芦,草龙珠,古代被称为蒲陶,是葡萄科种葡萄属植物[1-4]。葡萄作为世界四大果品之一,其葡萄皮中蕴含着大量的花色苷类色素。最新发现葡萄皮色素具有许多的生理功能[5-9]:消除自由基、改善肝脏以及血清中的脂质、抗变异原以及抗肝疡、防御身体过氧化、防止动脉硬化以及提高视力等作用。而最新的研究表明,来源于葡萄皮的花青素能够起到降低心脏病的作用。我国对于葡萄皮天然色素的开发应用研究起步相对较晚,而且有很大的局限性,只开发探究了相对较为简单的提取工艺过程,所提取产品质量粗。因此,对于葡萄产物的综合开发就具有十分显著的意义。不仅可以避免了环境污染问题,还可以提高经济效益,废物利用,利国利民[10-14]。
本论文利用溶剂浸提法对葡萄皮色素的提取工艺进行了探索研究,先后利用单因素试验和响应面试验获得了葡萄皮色素提取的最佳提取条件和最适提取工艺,并对葡萄皮天然色素的稳定性进行了比较全面的研究,这些问题的研究,为葡萄皮色素今后进一步研究和工业化生产提供依据及借鉴[15-18]。
1 材料与方法
1.1 材料
80%乙醇、磷酸氢二钠、柠檬酸、盐酸、氨水、醋酸、亚硫酸钠(均为分析纯):北京化工厂公司;葡萄皮色素标准品(食用级):山东西亚化学股份有限公司;双氧水(分析纯):天津市天力化学试剂有限公司;苯甲酸钠(分析纯):天津市凯通化学试剂有限公司;JTD3003型电子天平:余姚纪铭称重校验设备有限公司;JJ-1型精密定时电动搅拌器:金坛市荣华仪器制造有限公司;DF-101S型集热式磁力加热搅拌器:金坛市晶波实验仪器厂公司;200克多功能粉碎机:永康市率通工具有限公司;R-1005型旋转蒸发仪:郑州长城科工贸有限公司;标准检验筛(20、40目):浙江上虞市肖金标准筛剧场公司;UV2300型分光光度计:上海天美科学仪器有限公司;LDZ5-2型京立医用离心机:北京京立离心机有限公司。
1.2 试验方法
用打碎机粉碎葡萄皮时长1 min,用标准检验筛筛取20目~40目葡萄皮粉末,封闭保存在干燥瓶中备用。
1.2.1 葡萄皮色素含量的测定
标准曲线的绘制:分别称取葡萄皮色素标准品0.001 0、0.001 5、0.002 0、0.002 5、0.003 0、0.003 5、0.004 0、0.004 5、0.005 0 g,依次分别加入到编号为 1、2、3、4、5、6、7、8、9的试管中,取pH 值为 3的缓冲液,将 1.2.1中标准品分别定容稀释至100mL,就能得到浓度分别为1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%的色素液,于520 nm处测定溶液吸光度,以浓度为横坐标,吸光度为纵坐标制作标准曲线,得到拟合方程。
1.2.2 溶液吸光度的测量
量取625 mL的80%浓度的乙醇,用1 000 mL容量瓶定容,配置成50%的乙醇溶液,将1 L三口烧瓶放置在加热搅拌器中,取500 mL的50%乙醇加入到三口烧瓶中,打开加热器开关恒温到50℃。称量50 g葡萄皮粉末,将50 g粉末加入三口烧瓶中反应1 h,用离心机分离所得液,残渣在提取1次,将两次所得溶液置于旋转蒸发仪中浓缩到150 mL左右。将上述浓缩所得液体稀释至500mL。从500mL溶液中量取1.5mL,用pH值为3的缓冲液定容至25 mL,于520 nm处测吸光度,对比标准曲线,得出葡萄皮色素浓度[19]。
1.2.3 单因素试验方法
1.2.3.1 提取温度对葡萄皮色素提取的影响
通过查找文献[20-22]可知,用50%的乙醇溶液作为萃取剂,液料比为 10∶1(mL/g),提取剂pH值为7,依次提取两次测定不同温度下的葡萄皮色素的提取浓度,测定温度分别为40、50、60、70、80℃。采用
1.2.2中的方法测量溶液中葡萄皮色素的吸光度,作出折线图。
1.2.3.2 乙醇浓度对葡萄皮色素提取的影响
通过查找文献可知,不同浓度乙醇溶液作为试验变量,液料比为 10∶1(mL/g),提取温度为 50℃,提取剂pH值为7,提取两次测定不同乙醇浓度下葡萄皮色素的提取浓度,乙醇浓度分别为40%、50%、60%、70%、80%。采用1.2.2中的方法测量溶液中葡萄皮色素的吸光度并转化为葡萄皮色素含量,作出折线图。
1.2.3.3 液料比对葡萄皮色素提取的影响
通过查找文献可知,以50%乙醇溶液为萃取剂,提取温度为50℃,提取剂pH值为7,提取两次,测定不同的液料比时花色素的提取浓度,液料比分别为5 ∶1、7.5∶1、10∶1、12.5∶1、15∶1(mL/g)。采用1.2.2 中的方法测量溶液中葡萄皮色素的吸光度并转化为葡萄皮色素含量,作出折线图。
1.2.3.4 提取次数对葡萄皮色素提取的影响
通过查找文献可知,以50%乙醇溶液为萃取剂,液料比为10∶1(mL/g),提取温度为50℃,提取剂pH值为7,测定不同的提取次数时花色素的提取浓度,提取次数分别是 1、2、3、4、5。采用 1.2.2 中的方法测量溶液中葡萄皮色素的吸光度并转化为葡萄皮色素含量,作出折线图。
1.2.3.5 提取剂pH值对葡萄皮色素提取的影响
通过查找文献可知,以50%乙醇溶液为萃取剂,液料比为10∶1(mL/g),提取温度为50℃,提取两次,测定提取剂不同pH值时花色素的提取浓度,pH值分别为 1、2、3、4、5。pH 值大小通过盐酸来进行滴定调节。采用1.2.2中的方法测量溶液中葡萄皮色素的吸光度并转化为葡萄皮色素含量,作出折线图。
1.2.4 响应面试验方法
通过查找文献和试验表明提取温度,乙醇浓度,液料比,提取剂pH值,提取次数对葡萄皮色素的提取均有影响,其中提取温度、乙醇浓度、液料比对葡萄皮色素的提取效率影响比pH值与提取次数大,并且更有规律,因此根据响应面试验设计原理,对上述提取温度(A),乙醇浓度(B),液料比(C),进行三因素三水平的响应面试验,并对其结果进行分析,最终获得葡萄皮色素的最优提取工艺参数。试验因数水平及编码见表1。

表1 试验因素水平及编码Table 1 Test factor level and coding
1.2.5 葡萄皮色素的稳定性研究
对于葡萄皮色素的光谱特性、葡萄皮色素的稳定性(酸、碱、光照、氧化剂、还原剂、金属离子、食品添加剂(食盐、蔗糖、柠檬酸,苯甲酸钠等)等逐一进行研究,为葡萄皮色素的深入研究和工业开发利用提供详细的基础资料。
1.2.5.1 葡萄皮色素的光谱特性
用红外光谱对葡萄皮色素进行红外试验,得到红外图谱。
1.2.5.2 酸和碱对葡萄皮色素的影响
在此试验中使用盐酸、氨水、醋酸调节缓冲溶液的酸碱性测定不同pH值下溶液的吸光度。配制500mL 3.5%g/L的葡萄皮色素溶液,分成5份,每份100 mL,分别调节葡萄皮色素溶液 pH值至1、3、5、7、9,依次测定溶液520 nm处的吸光度转化为葡萄皮色素含量,做出折线图,同时观察颜色变化,结果列于表4中。
1.2.5.3 光照对葡萄皮色素的影响
配制3.5%g/L的葡萄皮色素溶液,分成3份,分别置于日光、避光、室内灯光(作为对照试验)的环境下,分别测定 1、2、3、4、5 h 时的溶液 520 nm 处的吸光度并转化为葡萄皮色素含量,做出折线图并分析试验结果。
1.2.5.4 氧化剂对葡萄皮色素的影响
本试验中探究所用氧化剂采用双氧水溶液。分别配制成0.6%、1.2%、2.4%的H2O2溶液,用移液管分别取2 mL加入到6 mL3.5%的葡萄皮色素溶液中,使混合后溶液浓度为0.15%、0.30%、0.60%,放于室内避光下1、2、3、4 h分别测定各自溶液520 nm处的吸光度并转化为葡萄皮色素含量,做出折线图并分析试验结果。
1.2.5.5 还原剂对葡萄皮色素的影响
本试验中探究所用还原剂采用亚硫酸钠溶液。分别配制成0.6%、1.2%、2.4%的Na2SO3溶液,用移液管分别取2mL加入到6 mL 3.5%的葡萄皮色素溶液中,使混合后溶液浓度为0.15%、0.30%、0.60%,放于室内避光下1、2、3、4 h分别测定各自溶液520 nm处的吸光度并转化为葡萄皮色素含量,做出折线图并分析试验结果。
1.2.5.6 金属离子对葡萄皮色素的影响
本试验中探究所用金属离子为Fe3+、Ca2+、Cu2+、Mg2+、K+。分别配制 0.1%、0.2%、0.3%、0.4%、0.5%的上述离子葡萄皮色素溶液,分别测定各自溶液520 nm处的吸光度并转化为葡萄皮色素含量,做出折线图并分析试验结果。
1.2.5.7 食品添加剂对葡萄皮色素的影响
本试验中探究所用食品添加剂为食盐、蔗糖、柠檬酸,苯甲酸钠。分别配制0.1%、0.2%、0.3%、0.4%、0.5%的上述添加剂葡萄皮色素溶液,分别测定各自溶液520 nm处的吸光度并转化为葡萄皮色素含量,做出折线图并分析试验结果。
2 结果与分析
2.1 葡萄皮色素标准曲线
分别配制的 1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%,5%的葡萄皮色素液在520 nm处测定吸光度,测得吸光度依次分别为 0.196、0.298、0.424、0.512、0.622、0.738、0.844、0.930、1.068。以标准品色素液浓度为横坐标,吸光度为纵坐标做出标准曲线,得到拟合方程。绘制标准曲线见图1。
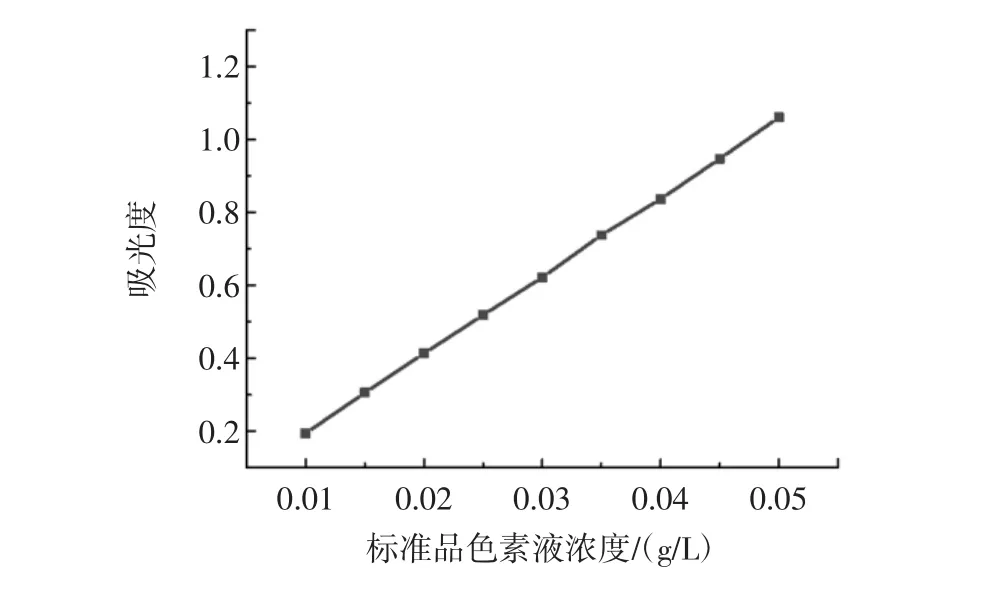
图1 葡萄皮色素标准曲线Fig.1 Grape skin pigment standard curve
由图1得到拟合方程为Y=21.275X-0.011 2,其中R2=0.999 1。拟合方程具有较好的线性关系。由公式即可得到已知吸光度相对应的葡萄皮色素液的浓度,从而得出葡萄皮色素的含量。
2.2 单因素试验结果
2.2.1 提取温度与葡萄皮色素含量的关系
温度对葡萄皮色素提取的影响见图2。
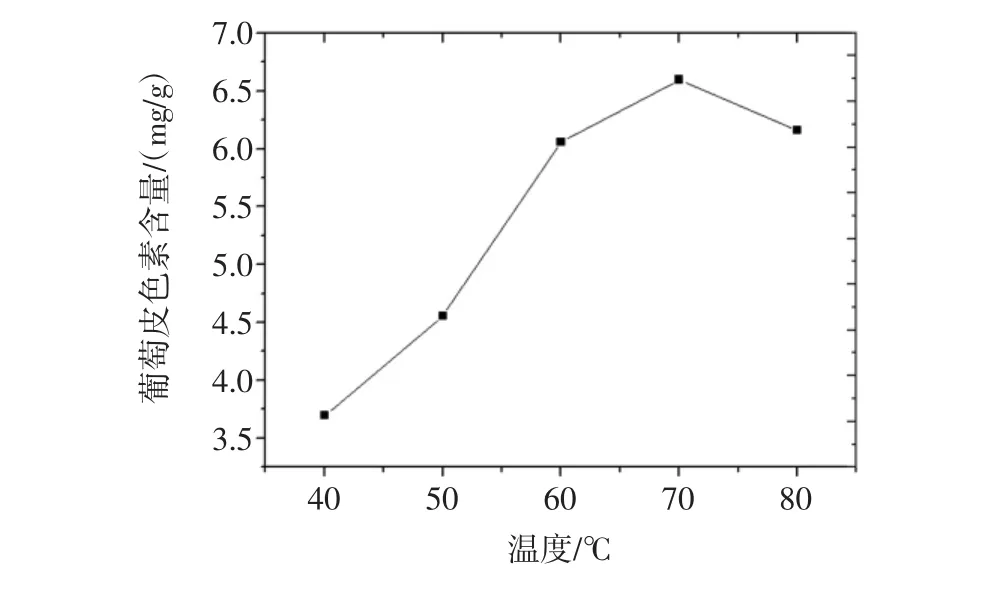
图2 温度对葡萄皮色素提取的影响Fig.2 Effects of temperature on the extraction of grape skin pigment
由图2可以看出不同提取温度下的葡萄皮色素提取量的变化关系。在40℃~70℃的提取温度范围内,葡萄皮色素的提取量随着温度的升高而不断地增大,在70℃~80℃的提取温度范围内,葡萄皮色素的提取量随着温度的升高而呈现下降趋势。由此可以得出结论,当提取温度为70℃时是葡萄皮色素的最佳提取温度。
2.2.2 乙醇浓度与葡萄皮色素含量的关系
乙醇浓度对葡萄皮色素提取的影响见图3。
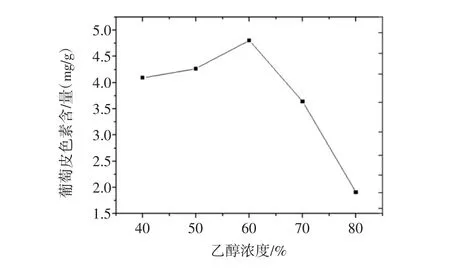
图3 乙醇浓度对葡萄皮色素提取的影响Fig.3 Effects of ethanol concentration on the extraction of grape skin pigment
由图3可以看出不同提取剂浓度下的葡萄皮色素提取量的变化关系。在40%~60%的乙醇浓度范围内,葡萄皮色素的提取量随着乙醇浓度的升高而不断地增大,在60%~80%的乙醇浓度范围内,葡萄皮色素的提取量随着乙醇浓度的升高而呈现下降趋势。由此可以得出结论,当提取剂乙醇浓度为60%时是葡萄皮色素的最佳提取浓度。
2.2.3 液料比与葡萄皮色素含量的关系
液料比对葡萄皮色素提取的影响见图4。
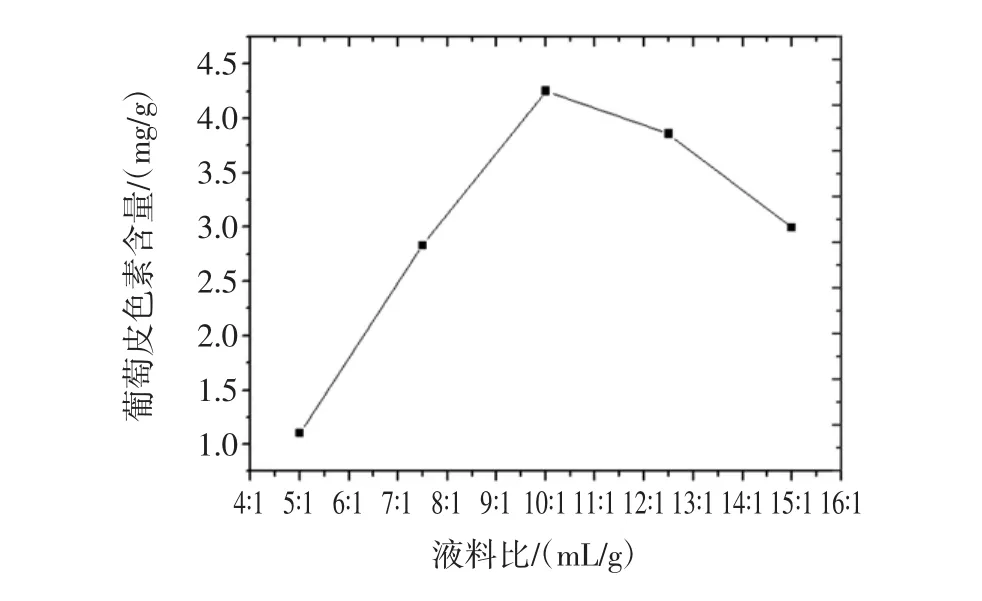
图4 液料比对葡萄皮色素提取的影响Fig.4 Effects of ratio of liquor to material on the extraction of grape skin pigment
由图4可以看出不同液料比下的葡萄皮色素提取量的变化关系。在 5 ∶1(mL/g)~10 ∶1(mL/g)液料比范围内,葡萄皮色素的提取量随着液料比的升高而不断地增大,在 10 ∶1(mL/g)~15 ∶1(mL/g)的液料比范围内,葡萄皮色素的提取量随着液料比的升高而呈现下降趋势。由此可以得出结论,当液料比为10∶1(mL/g)时是提取葡萄皮色素的最优值。
2.2.4 提取次数与葡萄皮色素含量的关系
提取次数对葡萄皮色素提取的影响见图5。
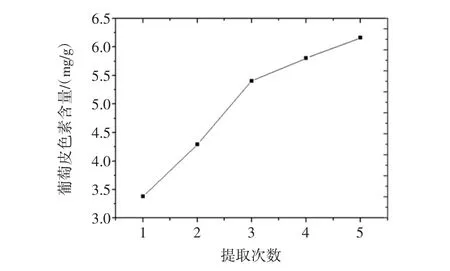
图5 提取次数对葡萄皮色素提取的影响Fig.5 Effects of extraction times on the extraction of grape skin pigment
由图5可以看出不同提取次数下的葡萄皮色素提取量的变化关系。随着提取次数的增多,葡萄皮色素的提取量也在不断地增大,当提取次数为1次~3次时,葡萄皮色素的提取量随着提取次数的增多而显著增强,而当提取次数为3次~5次时,葡萄皮色素的提取量随着提取次数的增多幅度却明显降低。由此可以得出结论,当提取葡萄皮色素时只需提取3次即可。
2.2.5 提取剂pH值与葡萄皮色素含量的关系
pH值对葡萄皮色素提取的影响见图6。
由图6可以看出不同提取剂pH值下的葡萄皮色素提取量的变化关系。随着pH值的增大,葡萄皮色素含量在不断减小,表明葡萄皮色素的提取量与pH值的大小成反比。由此可以得出结论,当提取剂pH值为1时,所提取的葡萄皮色素的量最多。
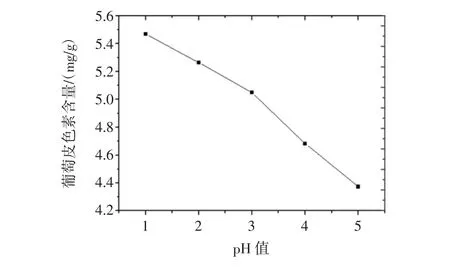
图6 pH值对葡萄皮色素提取的影响Fig.6 Effects of pH value on the extraction of grape skin pigment
2.3 响应面试验结果
响应面分析方案与试验结果见表2,回归方程显著性参数表见表3。
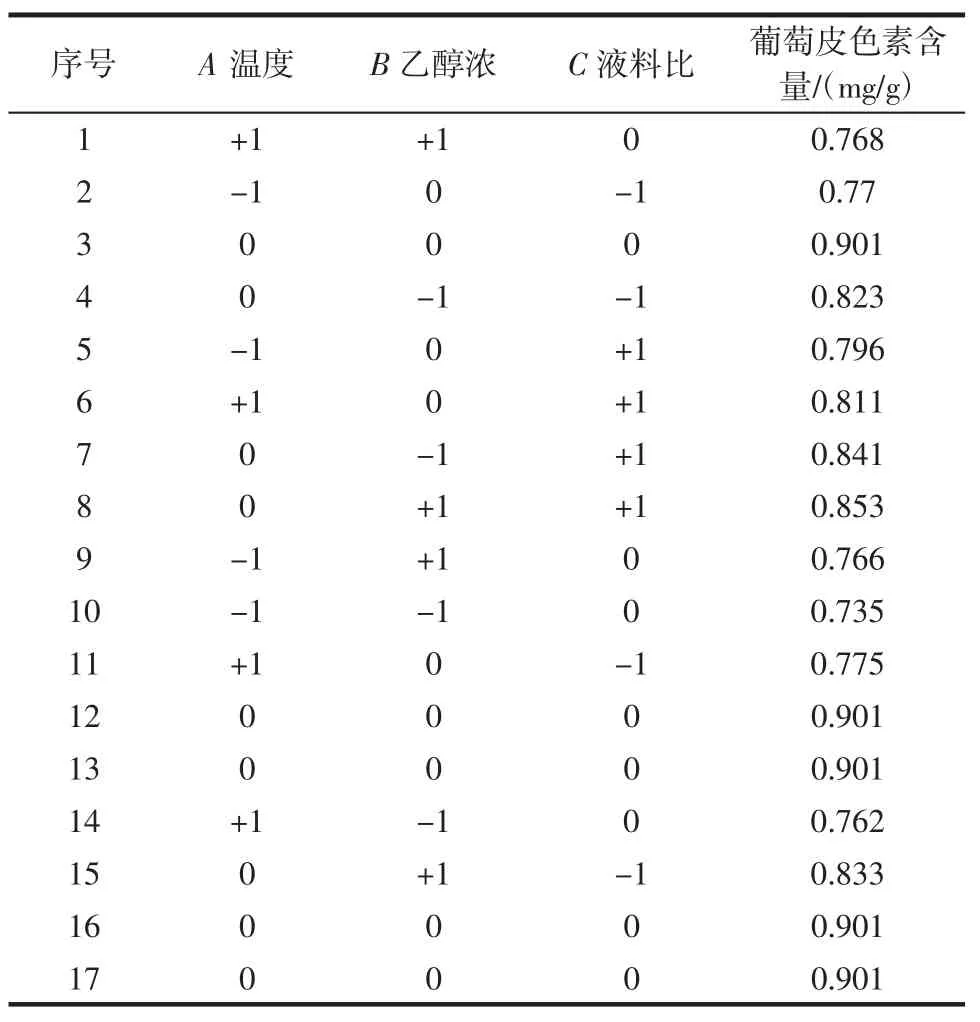
表2 响应面分析方案与试验结果Table 2 Response surface analysis scheme and test results
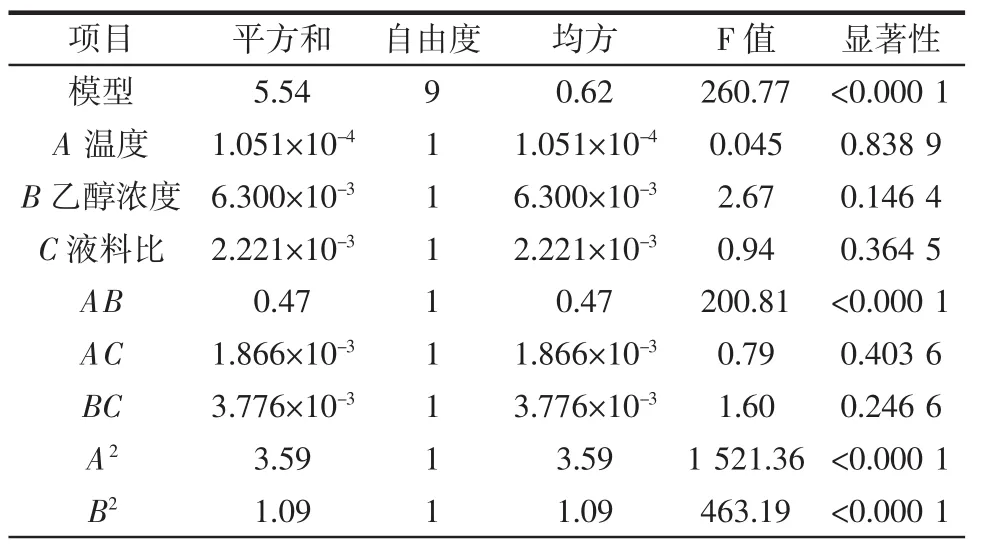
表3 回归方程显著性参数表Table 3 Regression equation significant parameter table
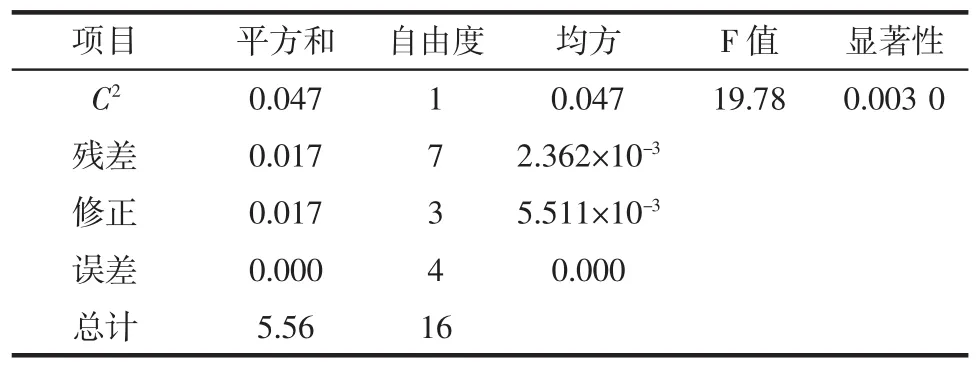
续表3 回归方程显著性参数表Continue table 3 Regression equation significant parameter table
响应面结果分析见图7~图12。
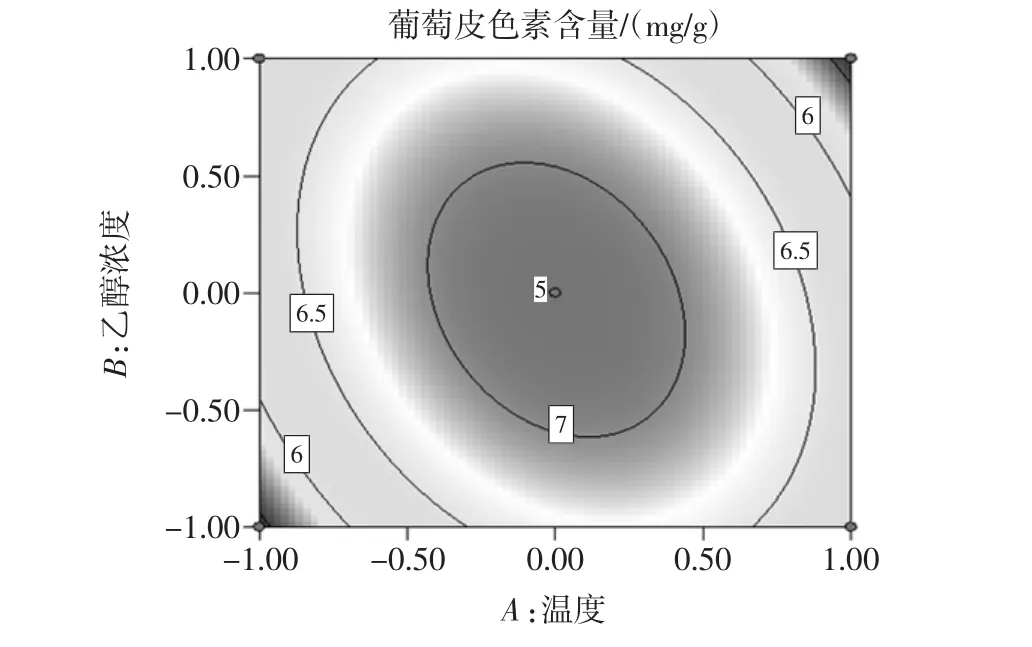
图7 温度和浓度等高线图Fig.7 Temperature and concentration contour map
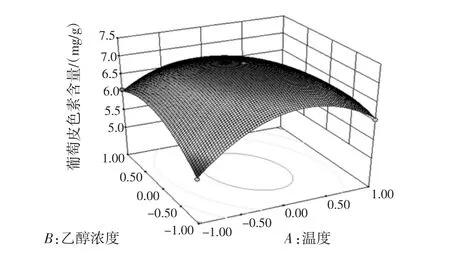
图8 温度和浓度3D图Fig.8 Temperature and concentration 3D map
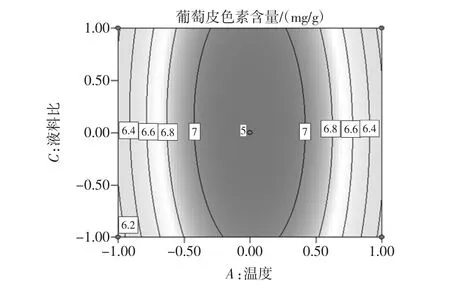
图9 温度和液料比等高线图Fig.9 Temperature and ratio of liquor to material contour map
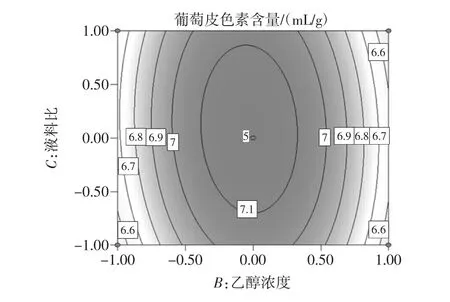
图11 浓度和液料比等高线图Fig.11 Concentration and ratio of liquor to material contour map
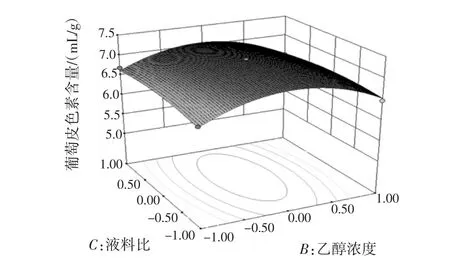
图12 浓度和液料比3D图Fig.12 Concentration and ratio of liquor to material 3D map
对响应面试验结果进行分析得出结论:对葡萄皮色素提取影响因素按照由大到小为液料比,乙醇浓度,反应温度。由此得到最佳的提取工艺条件为提取温度70.34℃,提取浓度60.79%,液料比 10∶1(mL/g),提取次数3次,提取剂pH值为1。通过设计验证试验,以响应面得到的最佳工艺为反应条件,提取葡萄皮色素,测量所得溶液的葡萄皮色素吸光度为0.901,计算葡萄皮色素浓度为7.163 5 mg/g,所得结果与响应面所得结果相同,说明响应面分析得到的最佳工艺具有可信度。
2.4 葡萄皮色素的稳定性研究结果
2.4.1 葡萄皮色素的光谱特性
按照1.2.5.1试验方法进行试验,所得到红外光谱图见图13。
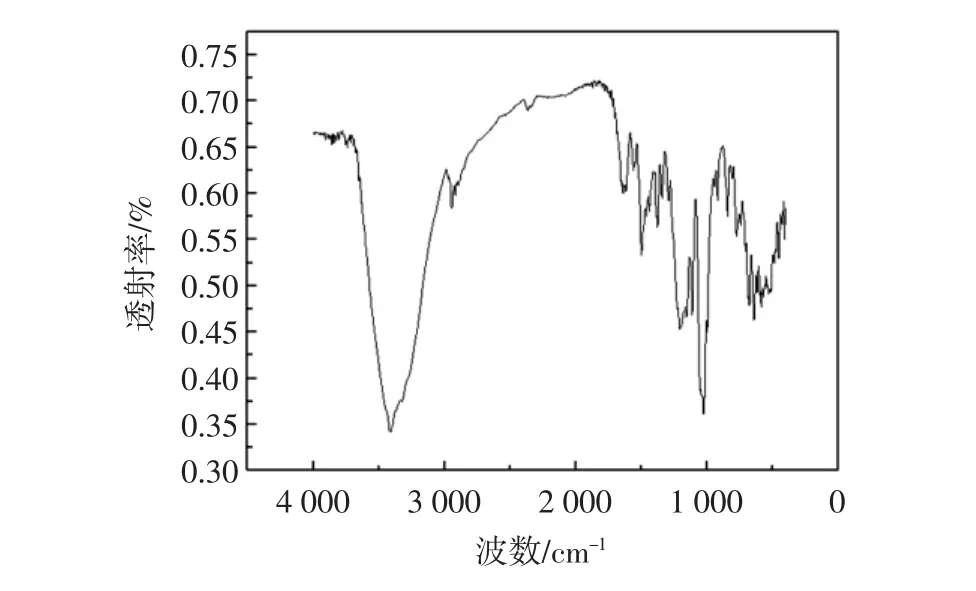
图13 红外光谱图Fig.13 Infrared spectrogram
由图13进行分析,葡萄皮色素在400cm-1~4000cm-1波长范围内趋势很明显,透射率有显著的特征,说明葡萄皮色素的成分及机能较为优异。
2.4.2 酸和碱对葡萄皮色素的影响结果
按照1.2.5.2试验方法进行试验,所得到酸和碱对葡萄皮色素的影响结果见表4,酸和碱对葡萄皮色素含量的影响见图14。
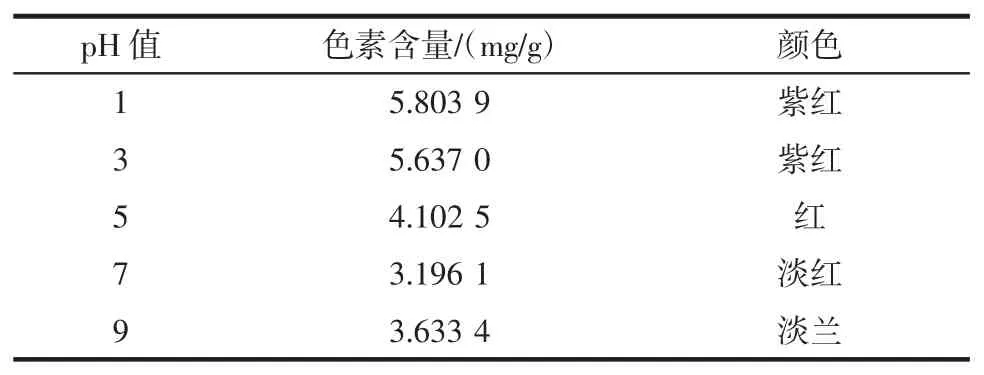
表4 酸和碱对葡萄皮色素的影响结果Table 4 Effects of acid and alkali on the extraction of grape skin pigment
由表4中数据可知,葡萄皮色素随着pH值的改变其溶液葡萄皮色素含量和颜色也有所差异,当pH<7时,随着pH值的减小其葡萄皮色素含量在不断增大,且溶液颜色有所加深,说明酸性环境对葡萄皮色素有着增色效应,在酸性环境中比较稳定。当pH值大于7时,溶液颜色变为淡蓝色,溶液颜色发生改变,说明葡萄皮色素在碱性环境中不稳定。所以葡萄皮色素适合做酸性物质的添加剂。
2.4.3 光照对葡萄皮色素的影响结果
按照1.2.5.3试验方法进行试验,所得到不同光照环境下对葡萄皮色素的影响结果见图15。
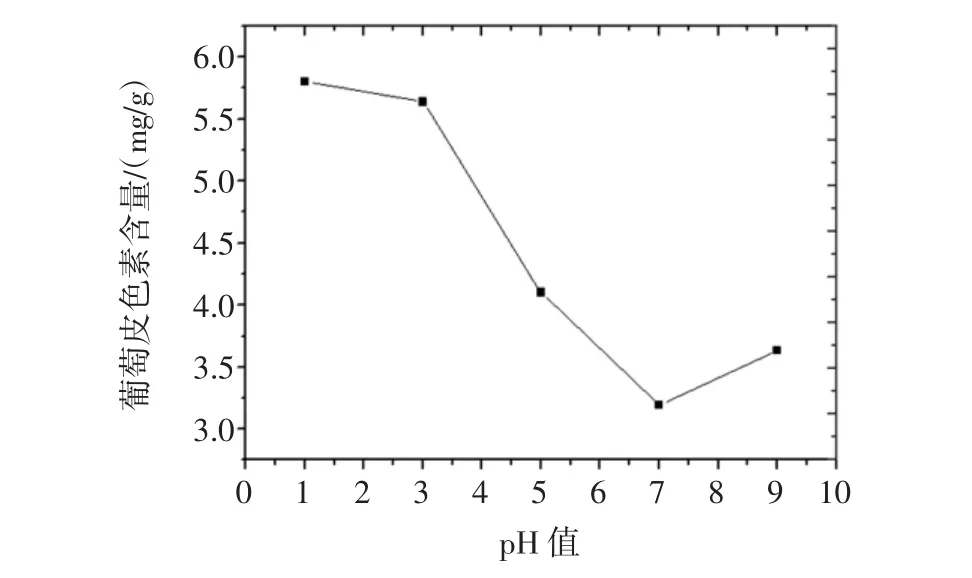
图14 酸和碱对葡萄皮色素含量的影响图Fig.14 Effects of acid and alkali on the extraction of grape skin pigment
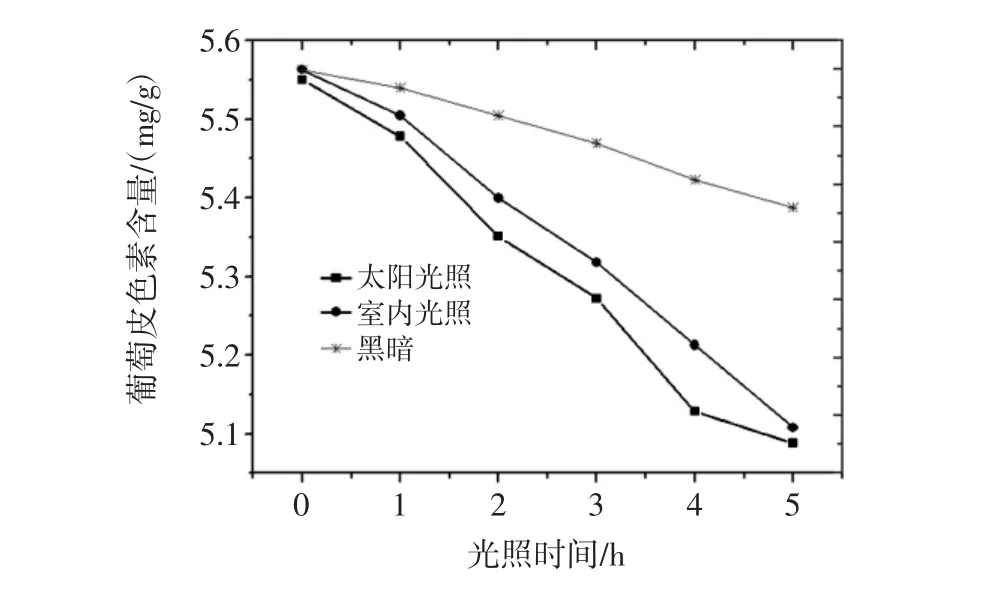
图15 光照对葡萄皮色素影响图Fig.15 Effects of light time on the extraction of grape skin pigment
由图15结果可以看出,葡萄皮色素在不同光照环境下随着放置时间的增长其溶液葡萄皮色素含量均有所下降。在避光环境下,葡萄皮色素溶液的葡萄皮色素含量是最高的,且下降幅度较小,能够长时间保持稳定状态;在日光下,随着放置时间的增长其溶液葡萄皮色素含量快速下降;当处于室内避光时,其溶液葡萄皮色素含量也呈下降趋势。所以为了更好地保存葡萄皮色素,应将其放置于避光环境中。
2.4.4 氧化剂对葡萄皮色素的影响结果
按照1.2.5.4试验方法进行试验,所得到不同氧化剂浓度对葡萄皮色素的影响结果见图16。
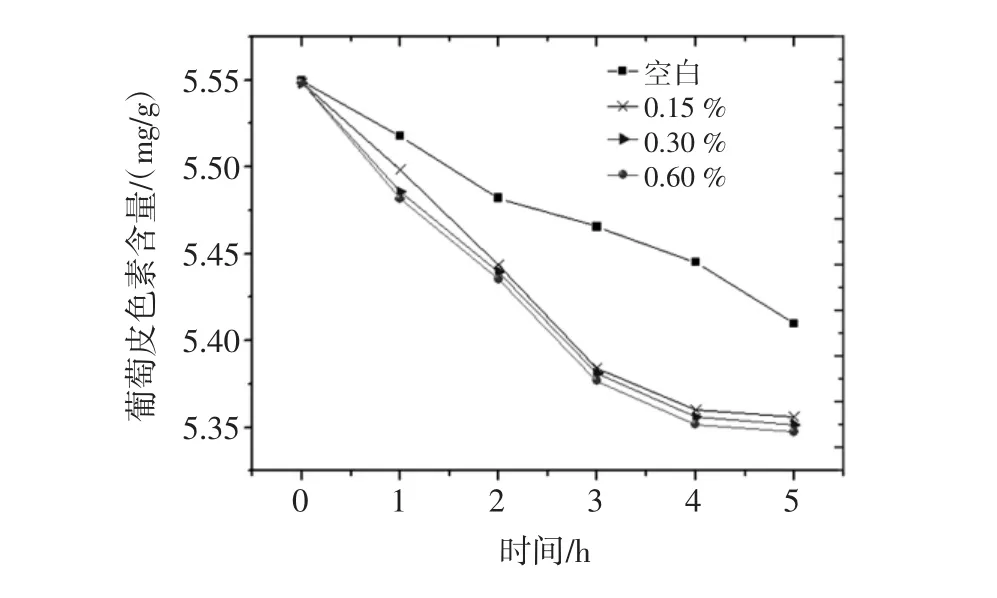
图16 氧化剂对葡萄皮色素的影响结果图Fig.16 Effects of oxidant on the extraction of grape skin pigment
由图16结果可以看出,葡萄皮色素在不同氧化剂浓度下随着放置时间的增长葡萄皮色度含量均快速下降。而且不同浓度的氧化剂对葡萄皮色素的稳定性影响没有明显差异,均呈现快速下降趋势,所以为了更好地保存葡萄皮色素,不添加氧化剂保存最为合适。
2.4.5 还原剂对葡萄皮色素的影响结果
按照1.2.5.5试验方法进行试验,所得到不同还原剂浓度下对葡萄皮色素的影响结果见图17。
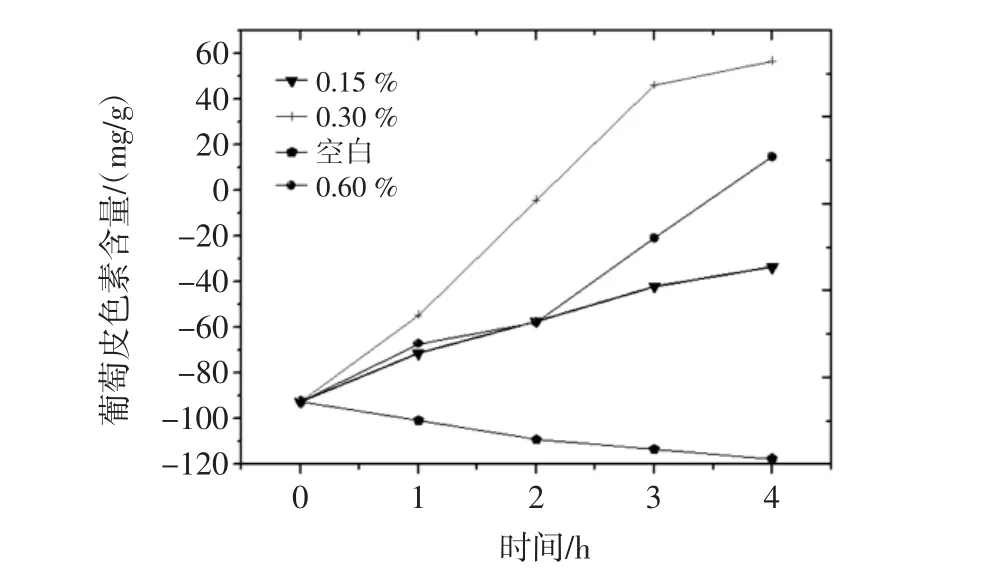
图17 还原剂对葡萄皮色素的影响结果图Fig.17 Effects of reductant on the extraction of grape skin pigment
由图17结果可以看出,不同还原剂浓度之间对葡萄皮色素的影响较大,没有明显规律,且不同浓度之间葡萄皮色素含量值有交叉现象,说明葡萄皮色素在还原剂中不太稳定,所以为了更好地保存葡萄皮色素,应避免与还原剂共同放置。
2.4.6 金属离子对葡萄皮色素的影响结果
按照1.2.5.6试验方法进行试验,所得到不同金属离子之间对葡萄皮色素的影响结果见图18。
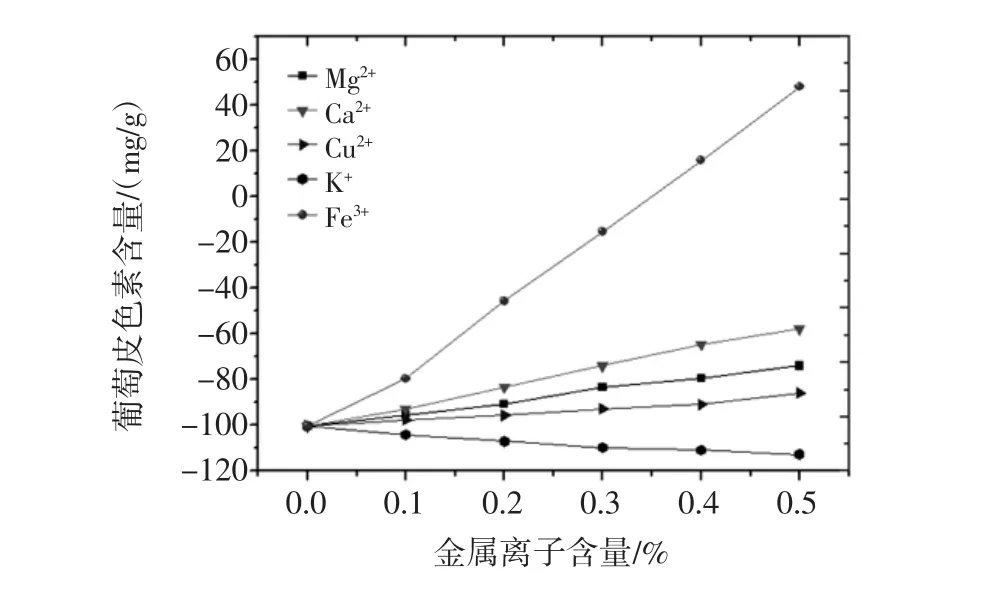
图18 金属离子对葡萄皮色素影响图Fig.18 Effects of metallic ion on the extraction of grape skin pigment
由图 18 试验结果分析可知,Ca2+、Cu2+、Mg2+、K+金属离子葡萄皮色素溶液不同浓度之间溶液葡萄皮色素含量差异不大,由此可知 Ca2+、Cu2+、Mg2+、K+金属离子对葡萄皮色素的影响较小。而Fe3+对该色素溶液葡萄皮色素含量影响较大,在该色素溶液中加入Fe3+后,溶液不稳定,其颜色发生迅速的变化,从红色变成了浅黄色,且该色素溶液葡萄皮色素含量随着Fe3+浓度的增大而不断增大,溶液颜色也不断地加深,由此可知,葡萄皮色素溶液在Fe3+中不稳定,葡萄皮色素对Fe3+比较敏感,所以为了更好地保存葡萄皮色素,应避免与Fe3+共同放置。
2.4.7 食品添加剂对葡萄皮色素的影响结果
按照1.2.5.7试验方法进行试验,所得到不同食品添加剂之间对葡萄皮色素的影响结果见图19。
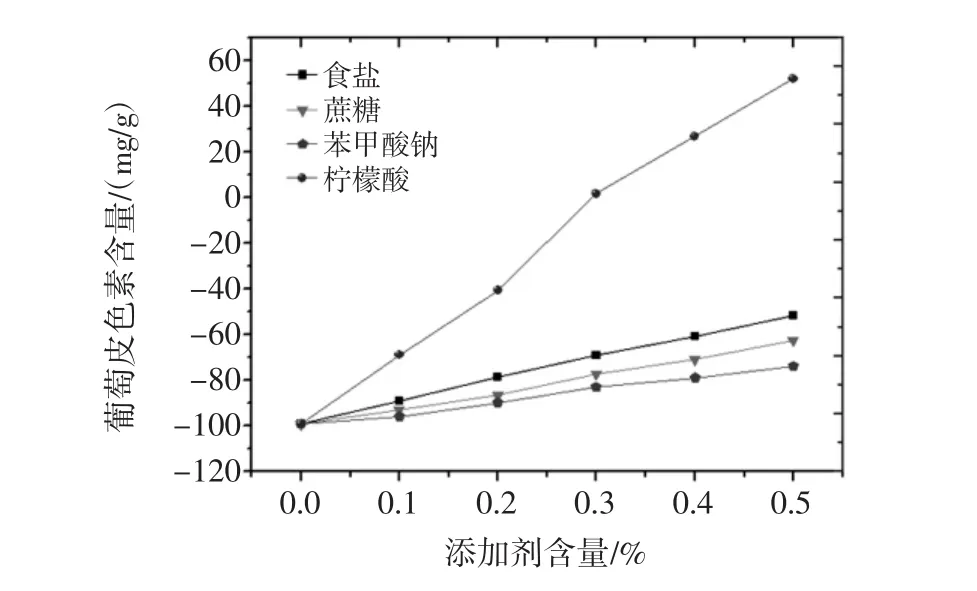
图19 食品添加剂对葡萄皮色素的影响结果图Fig.19 Effects of food additive on the extraction of grape skin pigment
由图19试验结果分析可知,食盐、蔗糖、苯甲酸钠添加剂对葡萄皮色素溶液不同浓度之间溶液葡萄皮色素含量差异较小,溶液颜色也基本没有变化,由此可知食盐、蔗糖、苯甲酸钠添加剂对葡萄皮色素无明显影响。而柠檬酸对该色素溶液葡萄皮色素含量影响较大,在该色素溶液中加入柠檬酸后,溶液颜色发生明显的变化,由红色变成了深红色,且该色素溶液葡萄皮色素含量随着柠檬酸浓度的增大而不断增大,溶液颜色也不断地加深,由此可知,柠檬酸对葡萄皮色素溶液葡萄皮色素含量影响较大,其对葡萄皮色素溶液有明显的增色效应。所以在日常中可以将葡萄皮色素与柠檬酸结合使用,效果会更好。
3 结论与展望
本文通过单因素试验对提取温度、乙醇浓度、液料比、提取次数、提取剂pH值5个因素分别对葡萄皮色素的提取进行了探究,确定了对葡萄皮色素提取影响最大的3个因素、最佳的提取工艺和葡萄皮色素的稳定性总结,最终确定了溶剂浸提法提取葡萄皮色素的最佳工艺条件为提取温度70℃,提取浓度61%,液料比10∶1(mL/g),提取次数3次,提取剂pH 值为1。在最佳试验条件下,葡萄皮色素提取浓度为7.163 5 mg/g。完成了初始工作计划,取得了较为满意的结果,为下一步的研究工作奠定了良好基础。由前面的工作基础,进一步的研究工作主要为可以继续探索提取时间对葡萄皮色素的提取的影响,进而进行响应面分析试验设计,确定出这6个因素下对葡萄皮色素提取的影响大小顺序。也相信在不久的将来,葡萄皮色素可以应用到工业化生产中,更够为我们的社会发挥更大的价值。
[1] 罗璇,李颖,邓艳芹.响应面法提取葡萄皮色素及其稳定性的研究[J].中国调味品,2015,40(2):104-113
[2] 马绍英,苏利荣,李胜,等.葡萄籽中原花青素、葡萄籽油和白藜芦醇的联合提取[J].甘肃农大学报,2015,29(4):145-149
[3] Krol J,Loedige I,Filipowicz W.The widespread regulation of microRNA biogenesis,function and decay[J].Nat Rev Genet,2010,11(3):597-610
[4] Yong Hwee E,Soojin V.Evolution of microRNAs and the diversification of species[J].Genome Biol Evol,2011,3(1):55-65
[5] 冯艳芸,岳田利,王周利.葡萄皮中白藜芦醇提取工艺优化[J].农产品加工(上),2015,397(12):35-37
[6] 李晓东,何卿,郑先波,等.葡萄白藜芦醇研究进展[J].园艺学报,2011,38(1):171-184
[7]刘秀奇,陈红.葡萄白藜芦醇的提取研究[J].科技创新导报,2011(26):134
[8] 郑先波,申炎龙,史江莉,等.中国野生葡萄果皮和叶片白藜芦醇含量测定[J].果树学报,2016,33(9):1092-1102
[9] S Nakao,M Mabuchi,S Wang,et al.Synthesis of resveratrol derivatives as new analgesic drugs through desensitization of the TRPA1 receptor[J].Bioorganic&Medicinal Chemistry Letters,2017,27(14):3167-3172
[10]李艳梅,李国银,赵福顺.玫瑰香葡萄皮色素的提取及其抗氧化活性研究[J].食品工业科技,2011,7(4):164-177
[11]张燕,曹爱勤,孙玉春,等.国家标准对葡萄酒产品的质量及技术指标是怎么规定的[J].产品可靠性报告,2006,24(4):28-29
[12]葛维娟,白换换,常娇,等.不同提取方法对葡萄皮中白藜芦醇含量的影响[J].粮食流通技术,2016,3(5):90-91
[13]詹丽,周鑫,张小月.葡萄酒消费者的食品安全认知与消费行为[J].三峡大学学报,2016(1):61-63
[14]管林勇,陈静.葡萄皮中白藜芦醇提取工艺初步研究[J].中药材,2013,36(7):1177-1179
[15]王艺璇,洪剑斌,刘荣俊.葡萄中提取白藜芦醇的工艺研究[J].泉州师范学院学报,2012,30(4):28-32
[16]薛娟萍,杨梅.葡萄酒的工艺研究[J].食品研究与开发,2015,36(8):19-20
[17]安梅,周瑾,陈晓宇.白藜芦醇药理学作用的研究进展[J].肿瘤药学,2014,4(4):242-246
[18]吕文,张福庆,崔艳.几种处理方法对低醇葡萄酒发酵和品质的影响[J].中国酿造,2012,31(5):74-77
[19]VB Souza,A Fujita,M Thomazini,et al.Functional properties and stability of spray-dried pigments from Bordo grape(Vitis labrusca)winemaking pomace[J].Food Chemistry,2014,164(1):380-386
[20]彭程,吴萍萍,尹艳艳,等.葡萄酒发酵过程中白藜芦醇含量变化研究[J].广东农业科学,2015(1):92-95
[21]秦迪.葡萄酒发酵过程中白藜芦醇含量变化研究[J].工程技术,2016,4(25):66-67
[22]钱伟斌,张美玲,吕文,等.赤霞珠干红葡萄酒发酵过程中白藜芦醇含量的变化[J].中外葡萄与葡萄酒,2017(2):39-41

