不同分子量段巢脾多糖理化性质及其抗氧化活性分析
殷玲,吉挺,战旭梅,李冠华
(1.江苏农牧科技职业学院,江苏泰州225300;2.扬州大学动物科技学院,江苏扬州225009)
中国是世界第一养蜂大国,养蜂生产淘汰下来的巢脾数量相当可观。蜜蜂世代在巢脾内栖息和繁衍,老巢脾内残留大量蜂蜜、花粉、蜂王浆、蜂胶、幼虫茧衣及其分泌物,研究表明蜜蜂巢脾含有大量的生物活性成分,如多糖、有机酸、生物碱、鞣质以及苷类等[1-3]。蜜蜂巢脾具有抑菌杀菌,杀虫攻毒,祛风镇痛,降血压,降血脂,抗氧化等多种生物学及药理学价值[4-6]。但巢脾常被用来提取蜂蜡,而其它活性物质却被丢弃,造成了极大的资源浪费。近年来,随着人们对天然多糖研究的深入,天然多糖所具有的调节人体免疫、抗氧化、抗肿瘤、降低固醇等各种生理功能逐渐为人们所重视[7-9],多糖已经开始在食品、功能性保健品、药物等领域进行开发应用[10-11]。蜜蜂巢脾多糖(下文简称巢脾多糖)是蜜蜂巢脾中的主要功效成分,有着重要的开发价值和广阔的应用空间,而目前对于蜂巢多糖的生物活性研究仍处于空白。多糖的生物学活性受到多糖的分子量,结构,及其理化性质如黏度、溶解度等因素的影响[12-13]。本试验采用超滤法对巢脾多糖进行分级分离,获得分子量为 4 kDa~10 kDa(HCP-1)、10 kDa~50 kDa(HCP-2)、50 kDa~100 kDa(HCP-3),大 于100 kDa(HCP-4)4个不同分子量段的巢脾多糖,并对4个分子量段巢脾多糖的理化性质和抗氧化活性进行分析,以期为巢脾多糖的构效关系研究及活性成分的有效开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
西方蜜蜂老巢脾(使用3年以上)。
氯仿、正丁醇、乙酸乙酯、咔唑、溴化钾、乙腈、甲醇、磷酸二氢钠(均为分析纯):国药集团化学试剂有限公司;三氟乙酸(TFA)、1-苯基-3-甲基-5-吡啉酮(PMP)、单糖标准品均为(色谱纯):上海源叶生物科技有限公司。
抗超氧阴离子测定试剂盒、羟自由基测定试剂盒、总抗氧化测定试剂盒:南京建成生物制药研究所。
1.2 仪器与设备
MSC300 超滤杯、截留分子量为 4、10、50、100 kDa的超滤膜:上海魔速科学器材有限公司;4种超滤膜紫外可见分光光度计T6、双光束紫外可见分光光度TU-1901:北京普析通用仪器有限公司;高效液相色谱1260:德国安捷伦公司;显微红外光谱仪670:美国Varian公司;全波长扫描式多功能读数仪:美国Thermo公司。
1.3 方法
1.3.1 蜜蜂巢脾多糖的提取及分级
粉碎的蜜蜂巢脾→按1∶15(g/mL)加入蒸馏水→50℃水浴锅水浴90 min→120目纱布过滤→重复3次→浓缩至原溶液的1/4→冷却离心→1∶4无水乙醇→4℃静置过夜→取沉淀离心→蜜蜂巢脾粗多糖→去色素→去蛋白→蜜蜂巢脾多糖→依次使用截留分子量的为4、10、50、100 kDa的超滤膜超滤→获得分子量为 4 kDa~10 kDa(HCP-1)、10 kDa~50 kDa(HCP-2)、50 kDa~100 kDa(HCP-3),大于 100 kDa(HCP-4)的多糖样品。
1.3.2 巢脾多糖基本理化性质的测定
1.3.2.1 基本组成测定
分别采用费林试剂反应及硫酸-苯酚法测定蜜蜂巢脾多糖中还原糖及总糖含量;利用三氯化铁反应及碘-碘化钾反应分别检测多羟基酚类物质及淀粉;考马斯亮蓝法检测蛋白质含量;硫酸-咔唑法检测糖醛酸含量;pH计在室温下测其pH值;不同极性溶液检测其溶解性。
液相色谱法测定巢脾多糖的单糖组成。液相色谱条件[13]为色谱柱:ZORBAX Eclipse XDB-C18,250 mm×4.6 mm×5 μm;流动相:0.1 mol/L 磷酸二氢钾(pH6.7)缓冲液-乙腈(0~18 min体积比为82∶18,18 min~40 min体积比为83∶17);柱温:25℃;检测波长:250 nm;流速:1 mL/min;进样体积:20 μL。检测器:DAD。
1.3.2.2 光谱分析
巢脾多糖样品(0.05 mg/mL)置于紫外可见分光光度计中190 nm~380 nm波长处进行扫描。巢脾多糖(充分干燥粉末)少许,加入少许溴化钾晶体,在红外灯照射下于玛瑙研钵中轻轻研磨至极细,用压片机压制成透明薄片,经显微红外光谱仪400 cm-1~4 000 cm-1中红外区扫描。
1.3.3 体外抗氧化能力检测
按照试剂盒方法测定各分子量段的巢脾多糖体外抑制羟自由基能力、抗超氧阴离子能力及总抗氧化能力。
2 结果与分析
2.1 不同分子量段蜜蜂巢脾多糖理化性质鉴定
2.1.1 不同分子量段蜜蜂巢脾多糖的单糖基本组成
对不同分子量巢脾多糖的蛋白质含量、总糖含量、糖醛酸含量、还原糖含量及pH值进行分析,结果见表1。
由表1可知,经计算巢脾多糖中总糖含量为75 g/100 g左右,糖醛酸含量在0.2 g/100 g左右,各分子量段差异不大。蛋白质含量随着分子量的增大而增高,这是由于多糖的糖链常与肽链结合,形成糖肽或糖蛋白,增加了多糖的分子量。而还原糖含量则随着分子量的增大而减小,说明多次超滤,有效地降低了单双糖的含量。各分子量段巢脾多糖pH值在7左右,属于中性多糖。多糖溶于水是其发挥生物学活性的首要条件[12],定性检测结果显示,各级别HCP不含淀粉及多酚类物质,可溶于水、稀酸及稀碱,不溶于乙醇、丙酮、乙酸乙酯等有机溶液。
本试验以12种常见单糖作标准品,采用柱前衍生化法对蜜蜂巢脾多糖中的单糖组成进行分析。分析结果如表2所示。

表2 不同分子量段巢脾多糖的单糖组成Table 2 Monosaccharide composition of comb polysaccharide with different molecular weights
由表2可知,不同级别多糖均含有甘露糖、葡萄糖醛酸,各分子量段单糖组成及含量差异较大。HCP-1中含鼠李糖、半乳糖醛酸、氨基半乳糖;HCP-2中含氨基葡萄糖、核糖;HCP-3中含核糖、鼠李糖、半乳糖醛酸、葡萄糖、木糖、阿拉伯糖;HCP-4中含核糖、鼠李糖、氨基半乳糖、葡萄糖、木糖、阿拉伯糖。本研究中各HCP的单糖组成差异较大,有研究结果显示多糖生物学活性受其主链糖单元组成影响较大[14-15],提示各分子量段生物活性差异可能与其单糖组成有关。
2.1.2 光谱分析
紫外光谱扫描结果见图1。
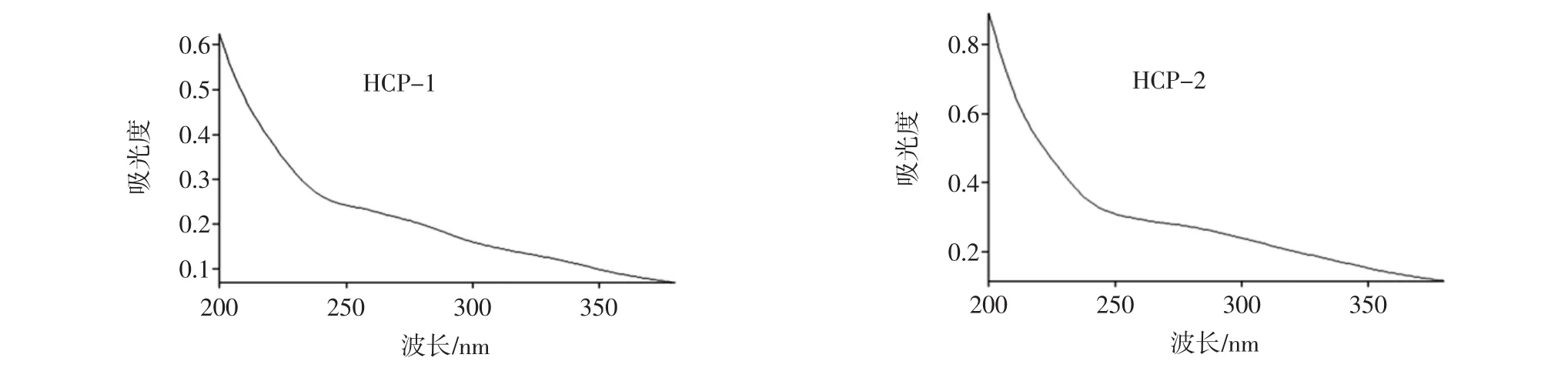
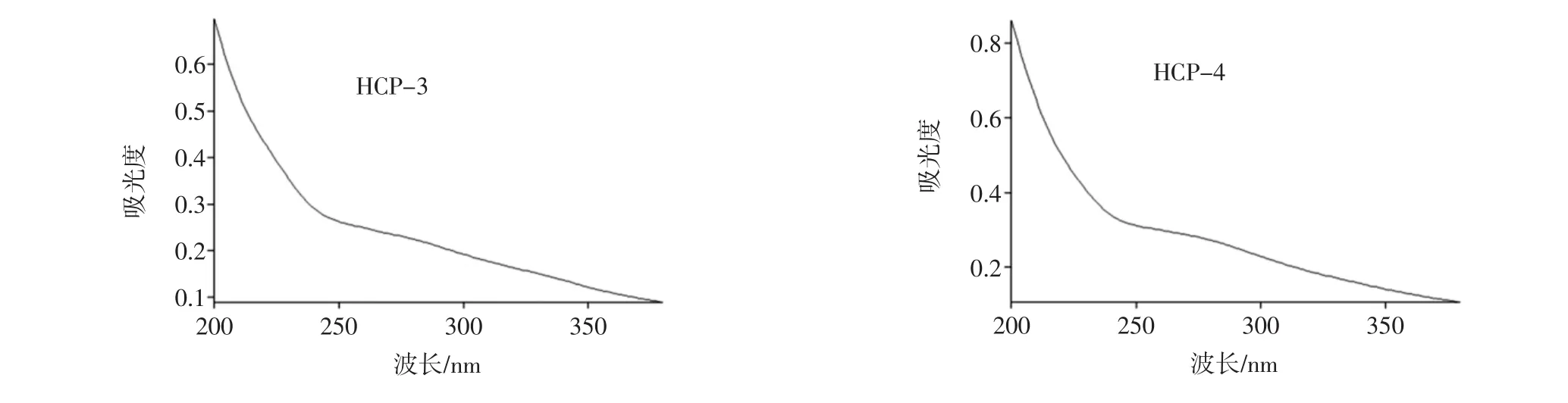
图1 不同分子量段巢脾多糖的紫外光谱图Fig.1 UV absorption spectra of comb polysaccharide with different molecular weights
由图1可知,各分子量段巢脾多糖峰型特征一致,在波长380 nm~190 nm中,各分子量未出现明显的特征吸收峰,吸光度值随着波长的缩短而增大,直至190 nm处出现最大吸收值。
红外光谱是研究聚合物结构和化学键,表征或鉴别不同化合物的常用手段之一,具有高度的特征性,是一种有效研究分子官能团特征的手段。各分子量段巢脾多糖的红外光谱图如图2所示。
图2结果显示各分子量段巢脾多糖皆具有典型的多糖特征吸收峰(3 387.3、2 934.4、1 413.4、772.3 cm-1),且峰型基本一致[16]。在3387.3cm-1处出现的宽峰为分子间和分子内羟基(O-H)伸缩振动特征峰[17],2 934.4 cm-1处吸峰收为糖链中饱和甲基或亚甲基(C-H)伸缩振动峰[18],1 413.4 cm-1处吸收峰为N-H的变角振动峰,772.3 cm-1处吸收峰为C-X伸缩振动[19]。此外,1 630.2 cm-1处吸峰收为C=O伸缩振动峰,表明该多糖为糖蛋白缀合物[20-21]。而在1700 cm-1~1 775 cm-1范围内无明显吸收峰,表明样品中不含羧基,即该多糖是一种中性糖[18],这与pH值检测结果一致。1 075.9 cm-1处吸收峰可能是吡喃糖环的特征吸收峰[19],891.3 cm-1处有吸收说明该多糖存在β型吡喃糖苷[17]。由于多糖的结构具有一定的相似性,所以多糖的红外光谱具有某些相同的特征吸收峰。通过对一些特征峰的分析,可对多糖结构中是否含有这些残基或大致结构类型进行判断。试验结果显示,各分子量段红外光谱特征吸收峰基本一致,说明其所含残基大致相同。
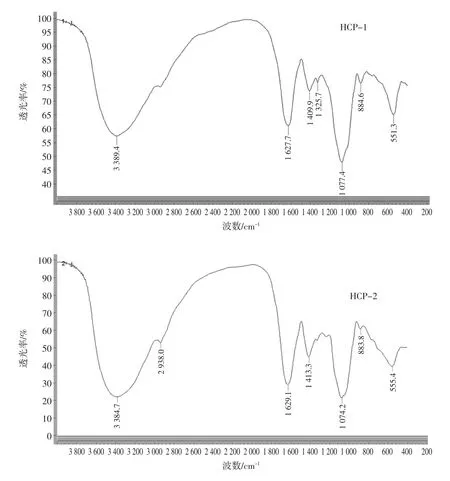
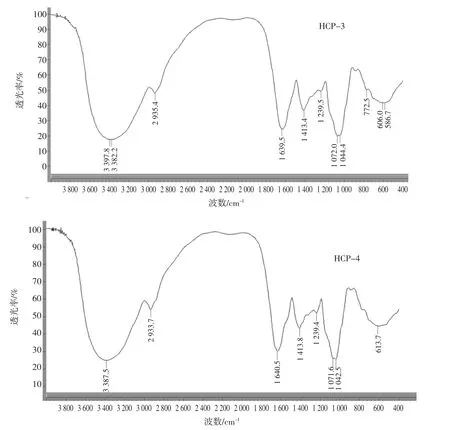
图2 巢脾多糖的红外光谱图Fig.2 Infrared spectra of comb polysaccharide with different molecular weights
2.2 不同分子量段蜜蜂巢脾多糖的抗氧化活性
2.2.1 不同分子量段巢脾多糖对羟自由基的清除作用
不同分子量段巢脾多糖对羟自由基的清除能力如图3所示。
由图3可知,在所选浓度范围内,所有分子量段的巢脾多糖清除能力随浓度的增大而增大,在浓度为30 mg/mL时,HCP-4对羟自由基的清除能力达到最高80.80 U/mL。总体而言,各分子量段巢脾多糖对羟自由基都具有较强的清除能力,其中HCP-3及HCP-4效果最好。
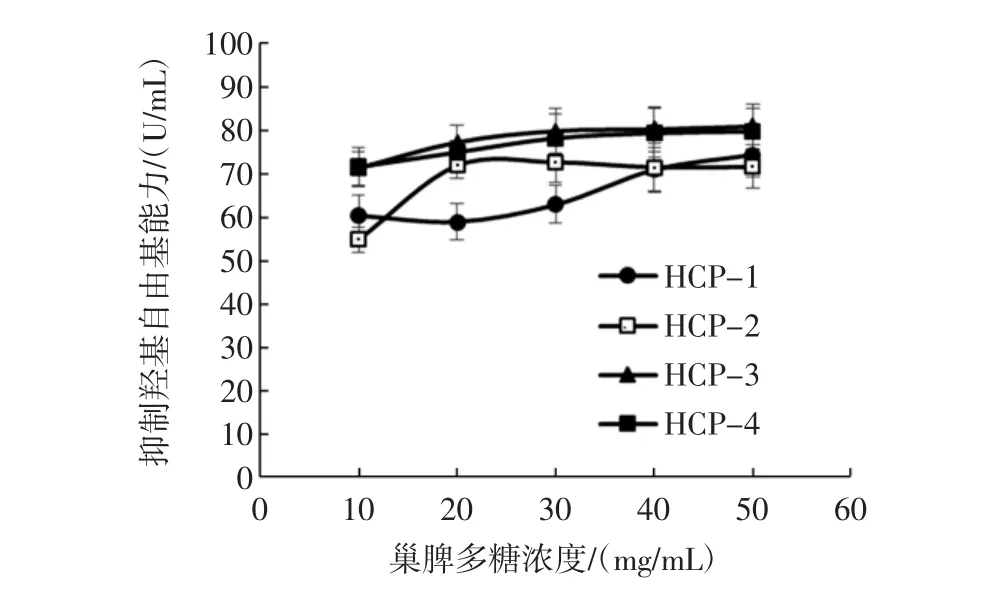
图3 不同分子量巢脾多糖对羟自由基的清除能力Fig.3 Scavenging activities of comb polysaccharide with different molecular weights against alkyl free radicals
2.2.2 不同分子量段巢脾多糖对超氧自由基的清除作用
不同分子量段巢脾多糖对超氧自由基的清除能力如图4所示。
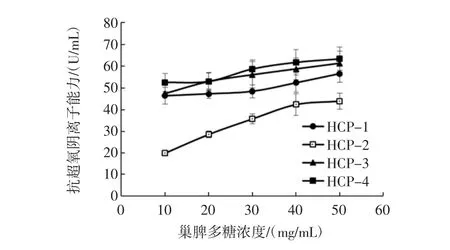
图4 不同分子量巢脾多糖对超氧自由基的清除能力Fig.4 Scavenging activities of comb polysaccharide with different molecular weights against hydroxyl free radicals
由图4可知,各分子量段巢脾多糖均具有清除超氧自由基的能力,在一定范围内,抑制率与多糖浓度呈量效关系。其中HCP-3及HCP-4对超氧自由基的清除能力优于HCP-1及HCP-2,在浓度为50 mg/mL时,HCP-4对羟自由基的清除能力达到最高63.40 U/mL。
2.2.3 不同分子量段巢脾多糖对总抗氧化能力的测定
不同分子量段巢脾多糖总抗氧化能力(TOA)如图5所示。

图5 不同分子量巢脾多糖对总抗氧化能力的测定Fig.5 Total antioxidant capacity of comb polysaccharide with different molecular weights
由图5可知,在一定浓度范围内,各级分子量多糖TOA与多糖浓度呈量效关系。当多糖浓度达到40mg/mL时,各级分子量多糖的TOA达到最高,其中HCP-4总抗氧化能力最高为486.23 U/mL,且HCP-4总抗氧化能力明显高于其它分子量多糖。
3 结论
本试验采用4个不同截留分子量的超滤膜,对巢脾多糖进行分级分离,获得分子量为4 kDa~10 kDa(HCP-1)、10 kDa~50 kDa(HCP-2)、50 kDa~100 kDa(HCP-3),大于 100 kDa(HCP-4)4 个不同分子量段的巢脾多糖,并对不同分子量段巢脾多糖的理化性质和抗氧化活性进行分析。结果显示巢脾多糖中总糖含量为75 g/100 g左右,糖醛酸含量在0.2 g/100 g左右,各分子量段差异不大。蛋白质含量随着分子量的增大而增高,还原糖含量则随着分子量的增大而减小。各分子量段巢脾多糖pH值在7左右,属于中性多糖。定性检测结果显示,各分子量段多糖不含淀粉及多酚类物质,可溶于水、稀酸及稀碱,不溶于乙醇、丙酮、乙酸乙酯等有机溶液。各分子量段巢脾多糖紫外及红外光谱特征相似,而单糖组成及含量差异较大,HCP-3及HCP-4中单糖种类及含量相比于HCP-1及HCP-2都较为丰富。体外抗氧化活性分析结果显示,在一定浓度范围内,各分子量段多糖对超氧自由基、羟自由基清除能力及总抗氧化能力与多糖浓度呈明显的量效关系,总体而言,HCP-4的抗氧化活性最强,这是否与HCP-4的单糖组成丰富相关,还需要进一步探讨。本研究为巢脾多糖的构效关系研究及活性成分的有效开发利用提供了理论基础。
[1] 匡邦玉,匡海鸥.蜜蜂生物学[M].昆明:云南科学技术出版社,2003:140-141
[2]褚亚芳.蜜蜂巢脾抗氧化、抑菌和抗炎活性以及抗生素残留研究[D].杭州:浙江大学,2010:1-3
[3]闫亚美.蜜蜂巢脾挥发油及其治疗AR的药效学研究[D].福州:福建农林大学,2007:1-18
[4]国家药典委员会.中国药典[M].北京:化学工业出版社,2005:614
[5] 赵红霞,黄文忠,陈华生,等.蜜蜂巢脾提取物对小鼠免疫调节作用的影响[J].天然产物研究与开发,2016,28(1):125-130
[6] 朱俊彦,喻庆禄,邓必麟,等.蜂巢药效学研究[J].时珍国医国药,1999,10(3):168-169
[7] LI JW,LIU YF,FAN LP,et al.Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus Jujuba cv.Jinsixiaozao[J].Carbohydrate Polymers,2011,84(1):390-394
[8] HUANG F,ZHANG R,YI Y,et al.Comparison of physicochemical properties and immunomodulatory activity of polysaccharides from fresh and dried litchi pulp[J].Molecules,2014,4:3909-3925
[9] 于美汇,赵鑫,尹红力,等.碱提醇沉黑木耳多糖体外和体内降血脂功能[J].食品科学,2017,38(1):232-237
[10]王恒禹,刘明,姜猛,等.多糖在食品工业中的应用现状[J].食品科学,2013,34(21):431-438
[11]张淑杰,康玉凡.天然活性多糖研究进展[J].食品工业科技,2017,38(2):379-382
[12]王兆梅,李琳,郭祀远,等.活性多糖构效关系研究评述[J].现代化工,2002,22(8):18-21
[13]黄菲,郭亚娟,张瑞芬,等.不同干制方式的荔枝多糖理化特性和抗氧化活性比较[J].中国食品学报,2016,16(3):212-218
[14]OLAFSDOTTIR ES,INGOLFSDOTTIR K.Polysaccharides from lichens:structural characteristics and biological activity[J].Planta medica,2001,67(3):199-208
[15]RIZKOVA L,DURACKOVA Z,SANDULA J,et al.Anti-oxidative and anti-muta-genic activity of yeast cell wall mannansin vitro[J].Mutation Research-Genetic Toxicology and Enviromental Mutagenesis,2001,497(1/2):213-222
[16]JIAX,ZHANG C,QIU J,et al.Purification,structural characterization and anticancer activity of the novel polysaccharides from Rhynchosia minima root[J].Carbohydrate Polymers,2015,132(5):67-71
[17]李彬,陈向楠,张建法,等.产胞外多糖菌株的筛选及胞外多糖结构分析[J].生物技术通报,2016,32(5):165-171
[18]韩丽荣,程代,土莉蕊,等.灰树花胞外多糖的结构及免疫调节活性团[J].生物工程学报,2016,32(5):648-656
[19]CAI W,XU H,XIE L,et al.Purification,characterization and in vitro anticoagulant activity of polysaccharides from Gentiana scabra Bunge roots[J].Carbohydrate Polymers,2016,140(20):308-313
[20]梅光明,郝强,张小军,等.酸提香菇多糖的分离纯化及结构鉴定[J].现代食品科技,2014,30(9):79-84
[21]CHAI Y,ZHAO M.Purification,characterization and anti-proliferation activities of polysaccharides extracted from Viscum coloratum(Kom.)Nakai[J].Carbohydrate Polymers,2016,149(20):121-130

