大豆肽胶囊的安全性毒理学评价
杨晓,王畋,2,刘畅,黄莹
(1.武汉跃莱健康产业有限公司研究院,湖北武汉430090;2.中国保健协会,北京100142)
大豆作为我国的粮食经济作物,种植面积极为广泛,大豆中的大豆蛋白能够补充人体所需蛋白质,而且价格便宜,容易获取,但大豆蛋白具有一定的豆腥味,而且加热不容易凝固,遇酸会出现沉淀,不易溶于水等问题,将大豆蛋白进行深加工得到大豆肽能够明显改善这些问题[1]。大豆肽是一种比大豆蛋白更具有营养价值的植物蛋白,由大豆蛋白通过酶解法[2]或者微生物发酵法[3]得到,主要成分为3个~6个氨基酸组成的肽,且相对分子质量在300~700范围内[4]。研究表明大豆肽具有优良的生物活性[5-7],解酒[8]、降血脂[9]、提高免疫力[10-12]、抗氧化[13-15]、降低胆固醇[16]、促进脂肪代谢[17]、促进钙和微量元素的吸收[18-19]以及抗疲劳[20-21]等。
牛磺酸是一种含硫的β-氨基酸,作为人体的一种条件必须氨基酸,以游离氨基酸的形式普遍存在于机体组织细胞内,对机体的运动能力及抗疲劳都有一定的作用[22]。黄精始载于《名医别录》,别名为“仙人余粮”、“救命草”、“老虎姜”等,为合科黄精属多年生草本植物,有黄精、多花黄精和滇黄精等,在抗菌、解压抗疲劳、抗衰老和治疗心血管疾病、结核病、慢性肝炎等方面均有较好作用[23]。玛咖含有丰富的蛋白质、碳水化合物、脂肪酸、纤维、维生素和矿物质,具有较高的营养价值,有“南美人参”之誉[24-25],此外,玛咖含有玛咖酰胺、玛咖烯、生物碱、芥子油苷、甾醇和类固醇等主要次生代谢物,具有抗疲劳、增强免疫力、提高生育力、抗炎症、抗癌、抗氧化、抗病毒、降血压、缓解抑郁和治疗女性更年期综合征等多种作用[26-27]。枸杞属于茄科落叶灌木,其果实长1 cm~2 cm,为明亮的橙红色椭球浆果,具有抗衰老,保护神经,抗骨髓抑制,提高睡眠质量等生理作用[28]。
大豆肽胶囊以大豆肽为主要原料,并加以牛磺酸、黄精、玛咖、枸杞制成。试验证明这些物质以一定的比例配伍能够显著提高机体的抗疲劳能力,但配伍后得到大豆肽胶囊的安全毒理性有待进一步研究,本文通过急性毒理学试验、骨髓细胞微核试验、小鼠精子畸形试验、鼠伤寒沙门菌/哺乳动物微粒体酶试验(Ames试验)、30天喂养试验共5项食品安全性毒理学试验,研究大豆肽胶囊的安全性,为大豆肽胶囊开发成为保健食品提供理论依据。
1 材料与方法
1.1 受试样品
大豆肽胶囊由武汉跃莱健康产业有限公司提供。
1.2 试验对象
SPF级昆明种小鼠:上海杰思捷实验动物有限责任公司。实验动物生产许可证号:SCXK(泸)2013-0006;实验动物使用许可证号:SYXK(泸)2013-0008。根据试验所需选用相应体重和性别的小鼠。小鼠饲料由上海福贝宠物用品有限公司提供,登记证号:沪饲证(2014)04002。
1.3 主要仪器与药品
ACS-3A型电子天平:上海奕泰机电设备有限公司;JH5101型电子天平:上海天平仪器技术有限公司;ME403E型电子天平:深圳市力达信仪器有限公司;GNP-9270型隔水式恒温培养箱:上海知楚仪器有限公司;贝克曼AU680全自动生化分析仪:北京新邦天地医疗器械有限公司;希森美康XT-2000i血液分析仪:上海恺梵实业有限公司;ACS-3型电子称:上海大和衡器常厂;HM340E切片机、STP120脱水机、HM340E包埋机、Varistain Gemini染色机:华俊医疗器械有限公司;Nikon eclipse80i显微镜:上海衡浩仪器有限公司;血液分析仪和试剂:希森美康医用电子(上海)有限公司。
环磷酰胺:上海卓因生物医学技术有限公司;TA97、TA98、TA100、TA102:美国分子毒理有限公司;对硝基喹啉、甲基甲烷磺酸、2-氨基芴、1.8-二羟基蒽醌、S-9混合液:上海皓鸿生物医药技术有限公司。
1.4 试验方法
参照《保健食品检验与评价技术规范(2003年版)》毒理学检验方法进行[29]。分别进行如下试验:急性毒性试验[最大耐受量(Maximum Tolerance Dose:MTD)试验方法],小鼠畸形试验,骨髓细胞微核试验(Giemsa染色法),鼠伤寒沙门菌/哺乳动物微粒体酶试验(Ames试验)(平板掺入法),小鼠30天喂养试验。
1.5 数据处理
用SPPS21.0软件进行统计分析,先对数据进行正态性和方差性检验,若方差齐,采用单因素方差分析进行总体比较,发现差异再用Dunnett法进行多个剂量组与一个对照组均数间的两两比较。若方差不齐则进行适当的变量转换,仍不齐则改用秩和检验进行统计,若总体比较有差异,则采用不要求方差齐性的Dunnett T3检验进行两两比较。
2 结果与分析
2.1 急性经口毒性试验
大豆肽胶囊对雌雄性小鼠急性经口毒性试验结果见表1。

表1 大豆肽胶囊对雌雄性小鼠急性经口毒性试验结果Table 1 Acute oral toxicity test of soybean peptide capsules on male and female mice
试验期间各组小鼠饮食活动正常,生长良好,毛色光泽度好,未见任何中毒症状;试验结束后解剖小鼠,大体观察主要脏器均未见明显异常,由表1可知,雌雄性小鼠死亡数量和死亡率为0只和0%,大豆肽胶囊对雌雄性小鼠急性经口毒性试验的LD50均大于20 g/kg·BW,属无毒级。
2.2 骨髓细胞微核试验
小鼠骨髓嗜多染红细胞微核发生率见表2。

表2 小鼠骨髓嗜多染红细胞微核发生率Table 2 Micronucleus rate of polychromatic erythrocytes in bone marrow of mice
由表2可知,受试样品各剂量组PCE/NCE、微核率与阴性对照组比较差异不显著(P>0.05),阳性对照组的微核率与阴性对照组比较差异极显著(P<0.01),故受试样品的小鼠骨髓嗜多染红细胞微核试验结果为阴性;且各剂量组PCE占RBC总数的比例不小于对照组的20%,表明样品对小鼠骨髓细胞无抑制作用。
2.3 精子畸形试验
动物精子畸形发生率见表3。
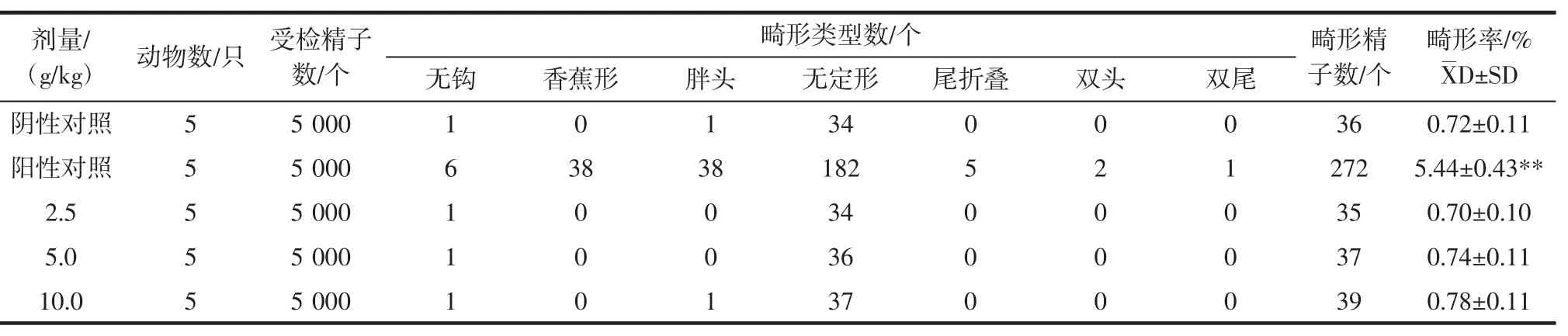
表3 动物精子畸形发生率Table 3 Sperm abnormality test in mice
由表3可知,受试样品的各剂量组小鼠精子畸形率为0.78%、0.74%和0.70%,阴性对照组为0.72%,阳性对照组为5.44%。受试样品的各剂量组精子畸形率与阴性对照组比较差异不显著(P>0.05),阳性对照组精子畸形率与阴性对照组比较差异极显著 (P<0.01)。由此可知,受试样品对小鼠精子畸形试验结果为阴性。
2.4 Ames试验
Ames试验见表4、表5。
由表4、5可以看出,受试样品的各剂量组和阴性对照组中空白对照组、溶剂对照组在加与不加S9活化系统的平板掺入法检测的回复菌落数均小于溶剂对照的2倍,而其他阳性对照组均超过自然回变菌落数的2倍以上。所以受试样品的Ames试验结果为阴性,即表明受试样品在试验剂量 8 μg/皿~5 000 μg/皿范围内未出现诱变作用。
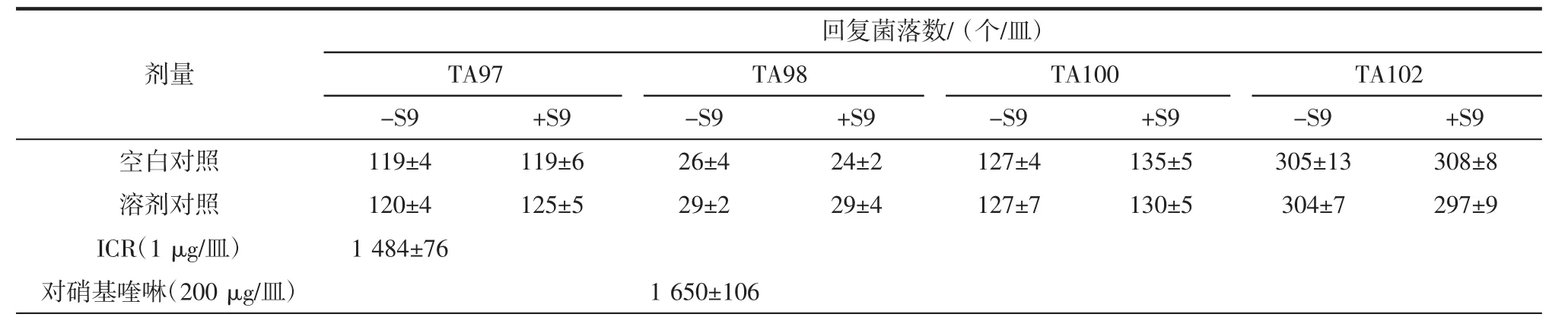
表4 Ames试验第一次试验结果Table 4 Results of first test in Ames

续表4 Ames试验第一次试验结果Continue table 4 Results of first test in Ames
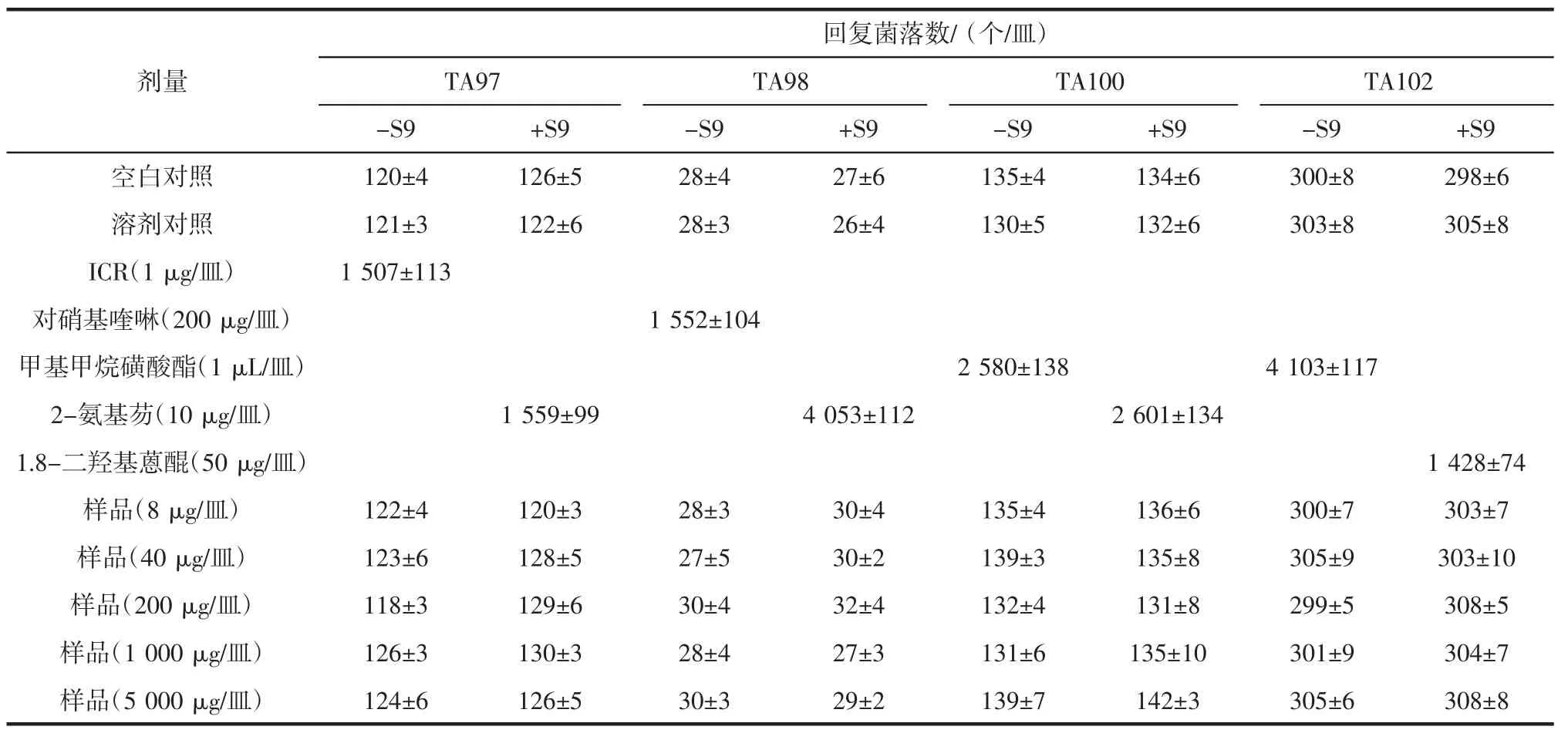
表5 Ames试验第二次试验结果Table 5 Results of second test in Ames
2.5 30天喂养试验
2.5.1 大鼠体重、摄食量、增重、食物利用率
大鼠体重、摄食量、增重、食物利用率见表6、表7。
由表6、表7可见,受试样品各剂量组大鼠的体重、摄食量、增重及食物利用率与对照组相比,差异均不显著(P>0.05),这表明受试样品在该试验条件下对大鼠的体重、摄食量、增重、食物利用率均无明显影响,各试验组的大鼠生长情况基本良好。
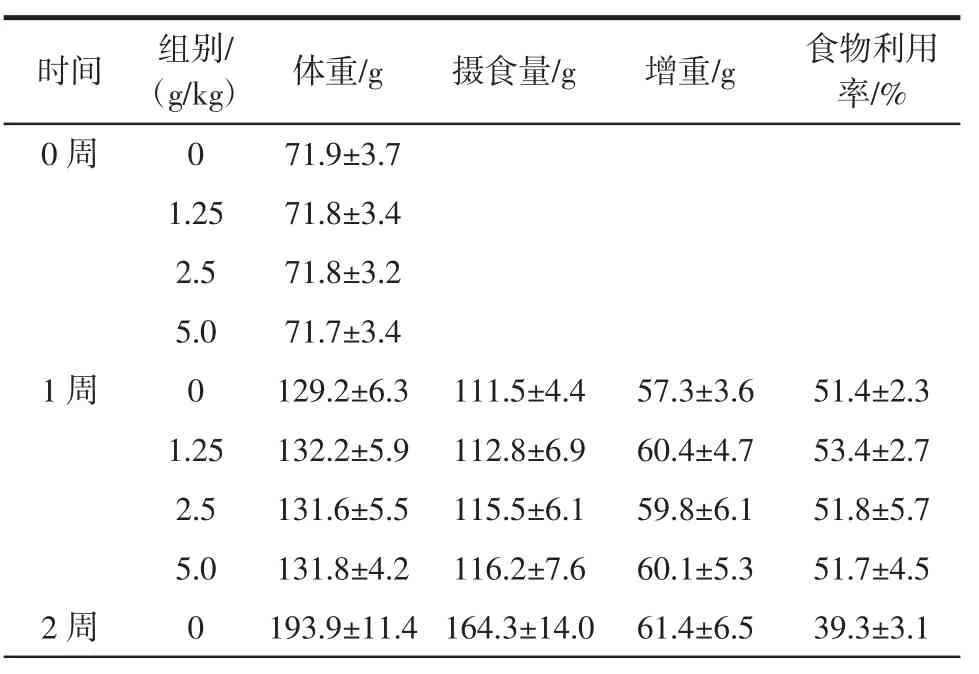
表6 雄性大鼠体重、摄食量、增重、食物利用率结果(X±SD,n=10)Table 6 Results of weight,weight gain,food intake and food utilization rates in male rats(X±SD,n=10)

续表6 雄性大鼠体重、摄食量、增重、食物利用率结果(X±SD,n=10)Continue table 6 Results of weight,weight gain,food intake and food utilization rates in male rats(X±SD,n=10)

表7 雌性大鼠体重、摄食量、食物利用率结果(X±SD,n=10)表 7 Results of body weight,weight gain,food intake and food utilization rates in female rats(X±SD,n=10)
2.5.2 大鼠脏器绝对重量、脏体比值
大鼠脏器绝对重量、脏体比值见表8、表9。
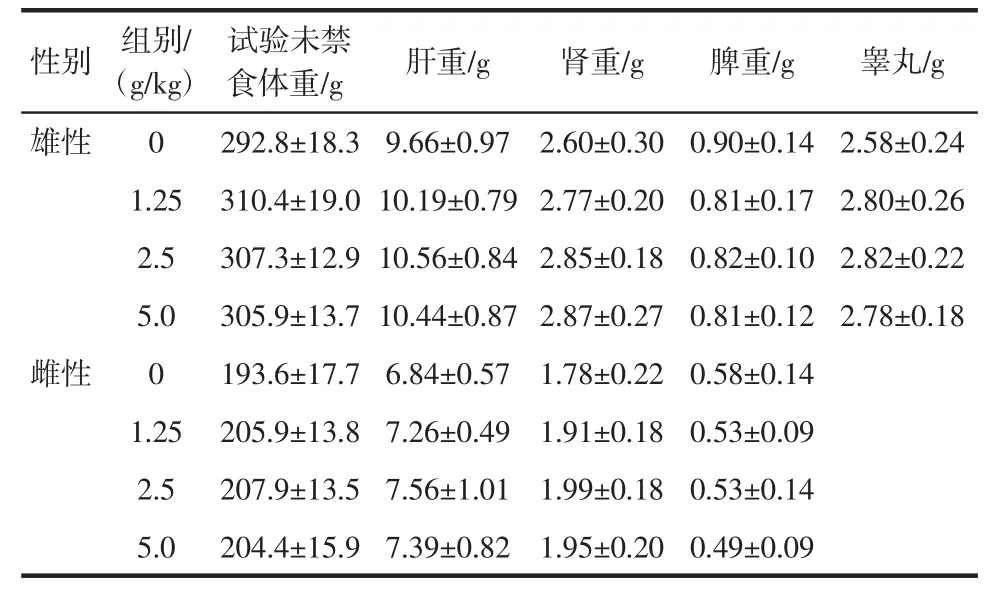
表8 大鼠脏器绝对重量(X±SD,n=10)Table 8 Absolute weight of organs in each group(X±SD,n=10)
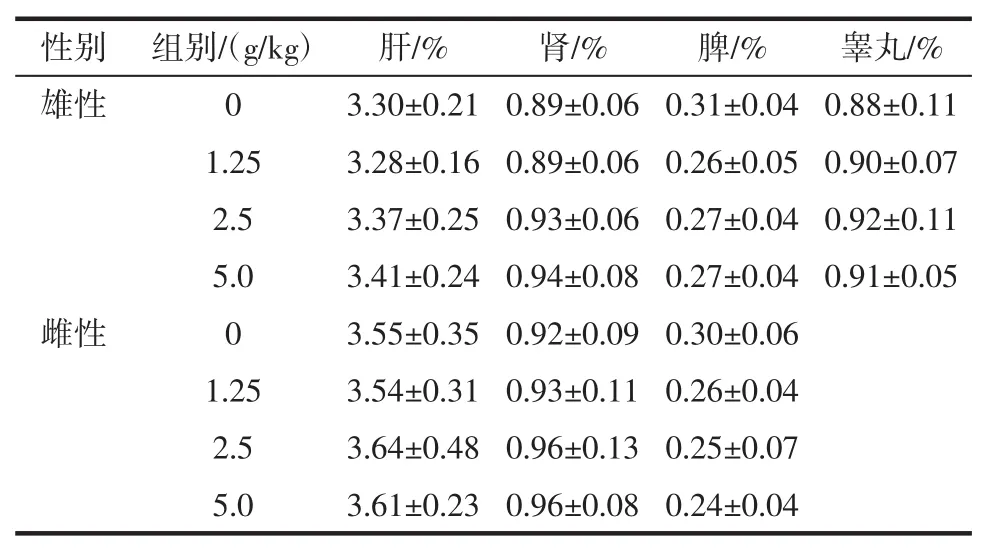
表9 大鼠脏体比值(X±SD,n=10)Table 9 Ratio of organ to body weight in each group(X±SD,n=10)
由表8、表9可见,样品各剂量组大鼠肝、肾、脾、睾丸的绝对重量和脏体比与对照组相比,差异不显著(P>0.05),说明受试样品在本试验条件下对动物的脏器重量和脏体比均无明显影响。
2.5.3 大鼠血液学检查结果
大鼠血液学检查结果见表10、表11。
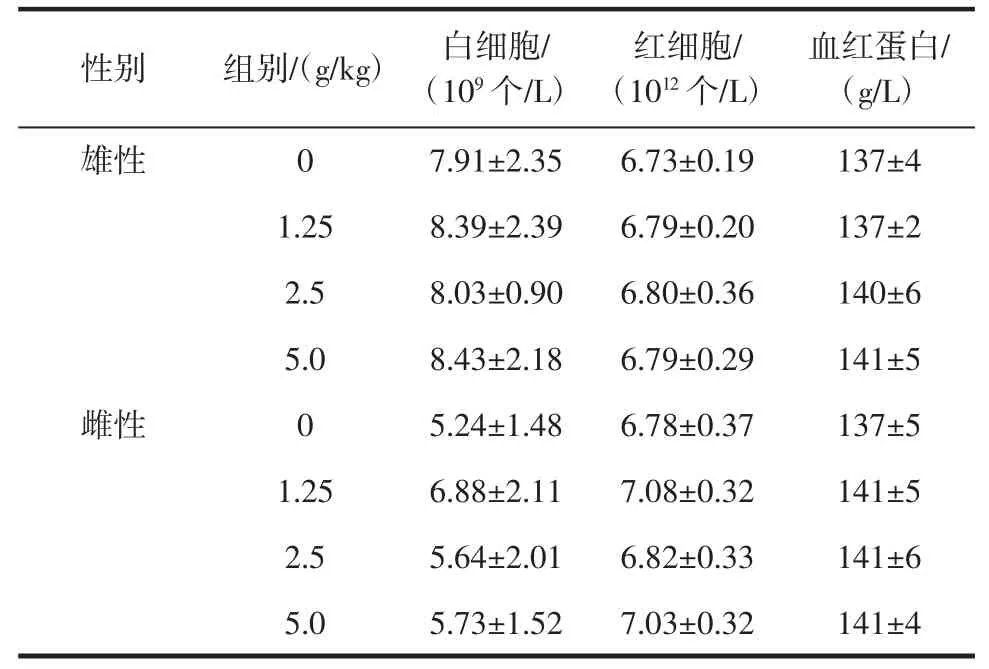
表10 大鼠血常规测定结果(X±SD,n=10)Table 10 Blood routine test result in rats(X±SD,n=10)
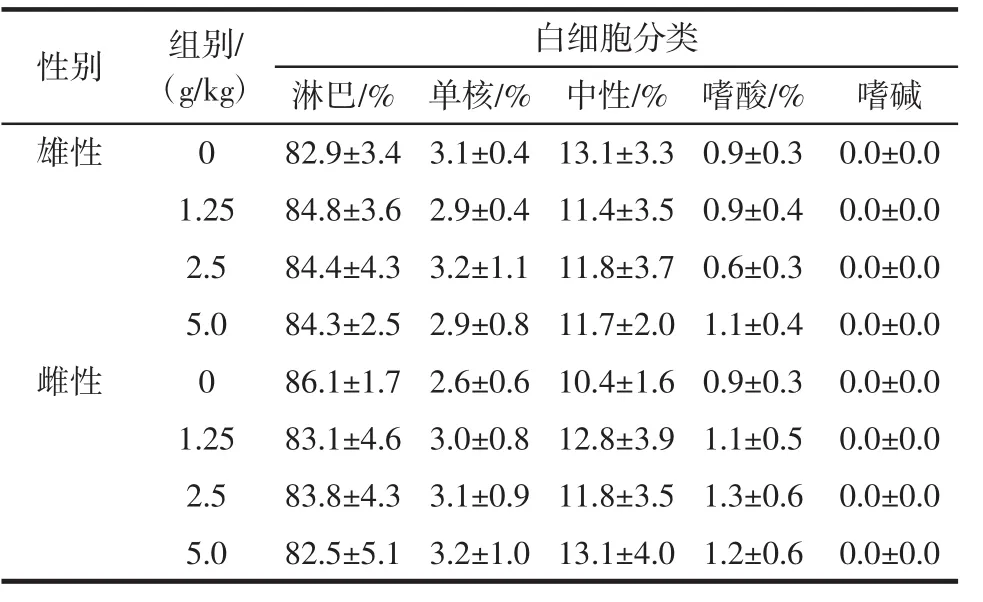
表11 大鼠血常规测定结果(X±SD,n=10)Table 11 Blood routine test result in rats(X±SD,n=10)
由表10、表11可见,各剂量组大鼠的血红蛋白、红细胞、白细胞计数及其分类与对照组相比,差异不显著(P>0.05),说明受试样品在该试验条件下对大鼠的血常规指标无明显影响。
2.5.3 大鼠生化学检查结果
大鼠生化指标测定结果见表12、表13。

表12 大鼠生化指标测定结果(X±SD,n=10)Table 12 Results of biochemical indexes in rats(X±SD,n=10)

表13 大鼠生化指标的影响(X±SD,n=10)Table 13 Results of biochemical indexes in rats(X±SD,n=10)
由表12、表13可见,与对照组相比,各剂量组雌雄大鼠的生化指标检测值与对照组相比,差异不显著(P>0.05)。说明受试样品在该试验条件下对大鼠的生化指标检测值无明显影响。
2.5.3 大鼠病理学检查结果
大鼠喂养30天后,进行大体解剖,肉眼观察各组大鼠的脏器变化,未发现明显病变,选择高剂量及对照组大鼠,通过显微镜观察进行组织病理学检查。检查结果如下:
肝脏:高剂量和对照组大鼠肝小叶结构清晰,肝索排列整齐;肝细胞大小一致,细胞核大小均一,核膜、核仁清楚,细胞质染色均匀。
肾脏:高剂量和对照组雄鼠分别有1例肾脏囊肿,其余大鼠肾皮、髓质界限清楚,肾单位结构正常,肾小球无炎性改变、纤维化、玻璃样病变等,肾小管亦未见明显病变。
脾脏:对照组雌鼠有1例红髓轻度扩张。其余动物红、白髓清楚,中央动脉位居脾小体中央,小体无明显萎缩,脾窦扩张,脾小梁正常。
胃、十二指肠:高剂量和对照组大鼠肠胃表面粘膜正常,无炎性改变和糜烂、溃疡形成。粘膜下、肌层、浆膜层均无炎性改变。
卵巢:高剂量和对照组大鼠卵巢内可见不同发育阶段的卵泡及排卵后形成的黄体、白体。
睾丸:高剂量和对照组大鼠精细胞发育正常。
由以上检查结果可知,本次试验未见由该受试样品引起的肝、肾、脾、胃、卵巢、睾丸等脏器引起的毒性病理改变。
3 结论
本实验从急性毒性试验、遗传毒性试验(Ames试验、小鼠骨髓细胞微核试验、小鼠精子畸形试验)和30天喂养试验对大豆肽胶囊的安全性毒理学进行了研究,大豆肽胶囊对雌雄性小鼠急性经口毒性试验的LD50均大于20 g/kg·BW,根据急性毒性分级标准规定,属无毒级;遗传毒性试验(Ames试验、小鼠骨髓细胞微核试验、小鼠精子畸形试验)结果均为阴性;30天喂养试验表明,以1.25、2.5、5 g/kg剂量的受试样品对大鼠进行30天喂养试验,结果表明各组大鼠生长发育良好,大鼠体重、增重、摄食量、食物利用率、脏器重量、脏体比、血液学指标、生化学指标与对照组比较均无显著性差异(P>0.05),大体解剖和组织病理学检查,脏器未见毒性病理改变。因此可以判定大豆肽胶囊具有较好的食用安全性,为其开发成为保健食品提供理论依据。
[1] 李文,陈复生,丁长河,等.大豆肽生理功能的研究进展[J].食品工业科技,2013,34(4):360-362
[2] 修立颖,单春乔,李晶晶,等.酶法制备大豆肽的研究[J].饲料工业,2015,36(18):44-47
[3]马静.微生物发酵豆粕产活性大豆肽饲料的研究进展[J].饲料工业,2016,37(8):27-31
[4]中华人民共和国国家质量标准监督检验检疫总局,中国国家标准化管理委员会.大豆肽粉:GB/T22492-2008[S].北京:中国标准出版社,2008:1
[5]王勇生,程宗佳.大豆肽的生理功能和制备工艺[J].饲料博览,2014(8):40-43
[6] 王立博,陈复生.大豆活性肽生理保健功能研究进展[J].食品与机械,2016,32(2):198-201
[7] 贾芳,陈复生,徐卫河.大豆肽的制备方法及其生理活性研究进展[J].粮食与油脂,2015,28(4):12-14
[8] 周勇,陈烨,王权,等.大豆肽的解酒作用及其机制研究[J].中药材,2014,37(6):1033-1036
[9] 孙青,王淑娥,付舒倩,等.大豆肽对实验性高脂血症大鼠血脂的影响及其机制[J].中国老年学杂志,2014,34(8):2169-2171
[10]Yimit D,Hoxur P,Amat N,et al.Effects of soybean peptide on immune function,brain function,and neurochemistry in healthy volunteers[J].Nutrition,2012,28(2):154-159
[11]富校轶,孙茂成,高永欣,等.大豆肽免疫调节作用的研究进展[J].大豆科技,2014(1):38-42
[12]卢连华,周连奎,谢玮,等.大豆肽粉对低白细胞大鼠白细胞及NK细胞的影响[J].食品与药品,2014,16(4):262-265
[13]焦宝利.大豆肽抗氧化性及其协同作用研究[D].河南工业大学,2015:3-5
[14]田少君,焦宝利,毛小平,等.大豆肽的超滤分离及其清除自由基活性研究[J].中国油脂,2015,40(4):18-21
[15]Takenaka A,Annaka H,Kimura Y,et al.Reduction of paraquat-induced oxidative stress in rats by dietary soy peptide[J].Bioscience,biotechnology,and biochemistry,2003,67(2):278-283
[16]Friedman M.Food Chemistry Nutritional value of proteins from different food sources.A review[J].Journal of Agricultural,1996,44(1):6-29
[17]Nagasawa A,Fukui K,Kojima M,et al.Divergent effects of soy protein diet on the expression of adipocytokines[J].Biochemical and Biophysical Research Communications,2003,311(4):909-914
[18]李迪,吕莹,郭顺堂.大豆肽钙复合物的溶解稳定性研究[J].食品工业科技,2011,32(4):94-96
[19]卢建国,孙强,孙洁心.富硒(Se)大豆肽胶囊的制备及其溶出度测定的研究[J].中国农学通报,2011,27(7):447-451
[20]高绿莎.大豆肽缓解体力疲劳活性研究与产品研制[D].吉林:吉林大学,2015:1-9
[21]尹军杰.大豆肽分子量与缓解疲劳作用关系的研究[J].粮食与油脂,2017,30(7):42-44
[22]柯杰兵.牛磺酸代谢及其抗疲劳机理[J].解放军体育学院学报,1999,18(3):43-47
[23]Branco A C,Achour-Frydman N,Kadoch J,et al.In vitro fertilization and embryo transfer in seminatural cycles for patients with ovarian aging[J].Fertility and sterility,2005,84(4):875-880
[24]余龙江,金文闻.玛咖(Lepidium meyenii)干粉的营养成分及抗疲劳作用研究[J].食品科学,2004,25(2):164-166
[25]余龙江,金文闻,吴元喜,等.玛咖的植物学及其药理作用研究概况[J].天然产物研究与开发,2002,14(5):71-74
[26]余龙江,金文闻,李为,等.南美植物玛咖的研究进展[J].中草药,2003,34(2):105-107
[27]Del Valle M J,Pumarola T,Gonzales L A,et al.Antiviral activity of maca(Lepidium meyenii)against human influenza virus[J].Asian Pacific Journal of Tropical Medicine,2014,71(6):415-420
[28]如克亚·加帕尔,孙玉敬,钟烈州,等.枸杞植物化学成分及其生物活性的研究进展[J].中国食品学报,2013,15(8):161-172
[29]中华人民共和国卫生部.保健食品检验与评价技术规范(2003年版)[M].北京:中华人民共和国卫生部,2003:177-179

