体外模拟消化对蓝莓皮渣粗提物抗氧化成分及其活性的影响
周笑犁,吴珊珊,林栋,杜斌,陈敏,张婷
(1.贵阳学院食品与制药工程学院,贵州贵阳550005;2.贵州省果品加工工程技术研究中心,贵州贵阳550005)
在生物体内,活性氧和抗氧化防御系统总是处在一个动态平衡的过程中,一旦这个平衡被破坏,那些具有高反应活性的活性氧基团能够直接造成人体生物膜系统的损伤,从而导致正常细胞的裂解死亡[1-2];过剩的自由基还会诱导氧化应激现象,氧化体内的蛋白质、脂肪和核酸等[3],抗氧化物质则能在一定程度上保护生物机体免遭活性氧基团的破坏。蓝莓为杜鹃花科(Ericaceae)越橘属(Vaccinium.spp)植物,主要分布于我国山东、吉林、辽宁、江苏、贵州等地区;据报道蓝莓果实能够减缓衰老,预防脑神经老化,增强记忆力,预防心血管病,增强自身免疫力等功效[4-6]。蓝莓果实中含有丰富的花色苷、多酚,它们作为一种良好的抗氧化剂,能有效抑制氧自由基的产生或清除氧自由基,已有较多的研究证明了其活性[7-8]。
近年来,利用体外消化模型研究生物活性物质越来越受到国内外的关注。相对于研究物质体内的消化,体外模拟消化是一种较为简单、有效的模拟消化过程,不仅可以在某种程度上反映物质在体内的变化情况,而且体外研究法消耗财力少,还具有易于操控等优势[9-10]。但目前关于蓝莓果实中活性物质在体内消化过程中的变化情况我们还了解甚少,特别是对于富含活性成分的果皮渣这一加工副产物。本文尝试通过体外模拟胃肠消化方法,评价蓝莓果皮渣粗提物在消化过程中活性物质的变化规律,及其抗氧化活性,以期对蓝莓及其加工副产物的抗氧化活性进行更全面科学的评价,为蓝莓加工副产物-果皮渣在医药、营养及保健食品中的应用提供一些参考。
1 材料与方法
1.1 试验原料
蓝莓皮渣干粉是在贵州省果品加工工程技术研究中心经蓝莓鲜果制作果汁后所剩的皮渣副产物,再经干燥粉碎;α-淀粉酶(3 700 U/g,生化试剂)、胃蛋白酶(3 000 U/g,生化试剂)、胰酶(4 000 U/g,生化试剂):上海金穗生物科技有限公司;胆汁(生化试剂):Ruibio;氯化钙、氯化钾、福林酚、无水乙醇、磷酸氢二钠、磷酸二氢钠、铁氰化钾、碳酸钠、硝酸铝、碳酸氢钠、三氯乙酸、三氯化铁、硫酸亚铁、水杨酸、双氧水均为分析纯。
1.2 仪器设备
UV-2550紫外分光光度计:日本岛津公司;TDL-16RH离心机:上海安亭科学仪器厂;烘箱:天津市泰斯特仪器有限公司;PHS-3C pH计:上海雷磁;SHB-III循环水真空泵:上海亚荣生化仪器厂;SHA-B数显水浴恒温振荡器:常州澳华恩斯仪器有限公司。
1.3 试验方法
1.3.1 蓝莓皮渣粗提物
称取50 g的蓝莓皮渣干粉,用100 mL 95%乙醇-0.1%HCl溶液(1∶1,体积比)作为提取液,在40℃下超声提取,冷却后进行抽滤,再将滤渣进行重提两次,合并滤液即为皮渣粗提物。
1.3.2 体外模拟消化[11]
体外模拟消化试验,包含体外模拟胃消化和肠消化两部分。体外模拟肠消化是在唾液和胃消化的基础上,再进行肠消化。
1.3.2.1 消化液的配制[9-10]
体外模拟胃液:称取135mg胃蛋白酶(3000U/mL)加入500 mL胃电解质溶液,混合均匀,用1 mol/L HCl调pH值至2。
体外模拟肠液:向90 mL肠电解质溶液中加入90 mL胰酶和胆汁溶液,摇晃均匀,用1 mol/L NaHCO3调节pH值至7。
胃电解质溶液:称取 3.1 g NaCl、1.1 g KCl、0.15 g CaCl2、0.6 g NaHCO3用去离子水溶解并定容至1 L。
肠电解质溶液:称取 5.4 g NaCl、0.65 g KCl、0.33 g CaCl2用去离子水溶解并定容至1 L。
1.3.2.2 模拟胃消化
取一定量蓝莓皮渣粗提物,分别稀释2、5、10倍,即为高、中、低浓度粗提液。分别取3种浓度的粗提液加入α-淀粉酶/CaCl2溶液(模拟唾液),混合均匀,在37℃水浴恒温振荡器里消化10 min;然后加入体外模拟胃液(对照组为不添加胃蛋白酶的胃电解质溶液),并调节样品组和对照组pH2.0,避光于37℃和100 r/min摇床中模拟胃消化培养,分别在消化0.5、1、2 h后取样品,6 000 r/min下离心10 min,取上清液于-20℃冻存,以备后面分析用。
1.3.2.3 模拟肠消化
经过唾液和胃消化后的消化液中加入体外模拟肠液(对照组为不添加胰酶和胆汁的肠电解质溶液),此时即为模拟肠消化前。然后用1 mol/L NaHCO3调节样品组和对照组pH值至7.2,继续置于100 r/min,37℃的摇床中模拟肠消化培养,分别在消化 0.5、1、2、3、4 h后取样品,在6 000 r/min下离心10 min,取上清液于-20℃冻存,以备后面分析用。
1.3.3 消化液抗氧化成分分析
1.3.3.1 花色苷含量的测定[8]
将消化液分别用NaAc缓冲液和KCl缓冲液稀释,于黑暗处静置20 min后在分光光度计上分别测定样品在510 nm和710 nm处的吸光度进行计算:A=(A510-A700)pH1.0-(A510-A700)pH4.5;则粗提物样品液中花色苷的浓度为:C/(mg/mL)=(A×MW×DF)/(ε×1)。
式中:MW为样品中主要花色苷的分子量,MW=449.2;DF为稀释因子;ε为样品中主要花色苷的摩尔吸收率,ε=26 900。
1.3.3.2 多酚含量测定
参考福林法[8],移取模拟胃、肠消化液1 mL于比色管中,各加入福林酚试剂3 mL,摇匀后避光放置30 s,再各加入12%Na2CO3溶液6.0 mL,以没食子酸为标准品,在760 nm处测定吸光度。
1.3.3.3 黄酮的测定
取0.5 mL模拟胃、肠消化液,各加入0.4 mL 5%Na2CO3溶液,摇匀,放置5 min后加入0.4 mL的10%Al(NO3)3溶液,定容至10 mL。室温下放置15 min,在波长510 nm处测定吸光值。以芦丁为标准品,采用硝酸铝-亚硝酸钠比色法测定总黄酮含量[12]。
1.3.4 消化液抗氧化活性分析
1.3.4.1 还原能力的测定
采用普鲁士蓝法[13],移取1 mL模拟胃、肠消化液,依次加入0.2 mol/L磷酸盐缓冲液(pH6.6)2.5 mL和质量分数1%六氰合铁酸钾溶液2.5 mL,放入50℃水浴20 min,快速冷却,再加入10%三氯乙酸2.5 mL,3 000 r/min下离心10 min,移取上清液2.5 mL,依次加入2.5 mL蒸馏水,0.5 mL 0.1%三氯化铁溶液,充分摇匀,静置10 min后,在波长为700 nm处测定其吸光值。
1.3.4.2 清除羟自由基(·OH)活性
在带塞试管中依次加入2 mL 9 mmol/L FeSO4、2 mL 9 mmol/L水杨酸和3 mL模拟胃、肠消化液,最后分别加入2 mL 8.8 mmol/L H2O2启动反应,在37℃水浴中反应1 h,于波长510 nm处测量吸光值[14],清除率/%=[A0-(Ai-Ai0)]/A0×100。
式中:A0为样品浓度为0 mg/mL时的吸光值;Ai为加入样品时的吸光值;Ai0为对应样品中无显色剂时的吸光值。
1.3.5 试验数据分析与统计
数据用平均值±标准差表示。用SPSS17.0进行统计分析,以p<0.05作为差异显著性判断标准。
2 结果与分析
2.1 体外模拟消化过程中蓝莓皮渣粗提物抗氧化成分的变化
2.1.1 花色苷
蓝莓皮渣粗提物模拟胃肠道消化过程中花色苷含量的变化如图1所示。

图1 体外模拟胃肠消化对蓝莓皮渣粗提物花色苷释放量的影响Fig.1 Effect of in vitro simulated gastric and intestinal digestion on anthocyanin released from digested crude extract of blueberry pomace
由图1可知,较消化前,不同浓度的粗提物经胃消化后花色苷均有了显著的提高(p<0.05);在模拟胃消化过程中,花色苷含量均显著增加再减少,在胃消化30 min时各组含量呈现最大峰值;并比相应浓度的对照组(未加胃蛋白酶消化)花色苷含量也显著增加(p<0.05),而3个不同剂量的对照组花色苷释放量在模拟消化前后均无显著变化(p>0.05)。
模拟胃消化2 h结束后进行肠消化,各组花色苷含量迅速且显著降低(p<0.05),直到模拟肠道环境消化2 h左右,高、中、低浓度的粗提物花色苷含量轻微增加,但均低于消化前的含量,且随着消化时间的延长又逐渐减少,而3个不同剂量的对照组花色苷释放量在模拟肠道消化前后均显著减少(p<0.05)。蓝莓皮渣粗提物在模拟胃环境中花色苷含量的提高可能是胃蛋白酶消化的酸性环境(pH2.0)引起的,在该环境下添加的酶促进了花色苷的释放,可能花色素与蛋白质复合物中的蛋白质在胃蛋白酶的作用下水解从而失去了束缚被释放;而对照组中花色苷由于酸性条件下较为稳定,变化不显著(p>0.05);但在模拟肠道环境中花色苷含量有所降低可能由于所存在的一些酶或是pH值变化使得花色苷含量和存在形式发生变化。有研究表明葡萄在肠胃消化后会损失90%的花色苷[15],而杨梅最高会损失59.3%[16],这与本试验的结果较一致,蓝莓皮渣粗提物经胃消化后其中花色苷可增加一倍,而经肠道消化后比消化前损失了近50%,与其他几种活性成分相比,花色苷在胃肠消化后的损失更加显著。
2.1.2 多酚
多酚化合物普遍存在于水果、蔬菜、坚果和谷物中[17],是广泛存在于植物中的次级代谢产物,可以有效清除自由基、抑制脂质过氧化,具有抗氧化、抗菌等多种生物活性[18-19]。模拟胃肠道消化过程中蓝莓皮渣粗提物多酚含量的变化如图2所示。


图2 体外模拟胃肠消化对蓝莓皮渣粗提物多酚释放量的影响Fig.2 Effect of in vitro simulated gastric and intestinal digestion on phenolics released from digested crude extract of blueberry pomace
由图2可知,3组不同剂量的粗提物经胃消化后多酚含量呈先上升,在30 min时其含量达到最大,随之含量略有下降并趋于稳定;模拟胃消化过程中高、中、低浓度提取物组多酚的最大释放量分别为胃消化0 h的 2.8、3.9、4.3倍(p<0.05);对照组的多酚含量在模拟胃消化2.0 h内的变化没有显著性差异(p>0.05),表明胃蛋白酶的消化使蓝莓皮渣粗提物中的多酚物质进一步释放出来。李俶报道了由于酚类化合物单体之间形成一定的相互作用,增加了其在胃肠液内的稳定性[20]。在黑枸杞体外消化过程中发现酶解和pH值的变化更能够让酚酸从结合态分解为自由态[11]。
而经模拟肠道消化时,蓝莓皮渣粗提物中多酚随着消化时间的增加而逐渐增大,高、中浓度组在2 h~3 h时达到最大后趋于稳定,而低剂量组则较早(1 h~2 h)达到最大多酚量后趋于稳定。在胃消化和肠消化阶段蓝莓皮渣多酚比消化前和对照组均显著增加(p<0.05),可能是模拟消化液中的消化酶(淀粉酶、胃蛋白酶与胰酶)逐步破坏了食物基质的细胞壁,促进了游离酚类的逐步释放[21-22]。至于肠消化阶段的多酚含量较胃消化阶段显著降低,这与麸皮体外消化多酚的变化情况较一致,却不同于全麦和精面多酚的释放规律[2];也有关于葡萄进行体外消化的研究发现,酚酸、花青素和白藜芦醇在肠液条件下降解[3,15]。因此在本试验肠道模拟消化环境,胰酶可能继续使结合态多酚释放为游离态,但酚酸和花青素对消化酶或者肠道环境敏感产生不稳定而发生降解,因而肠液消化组的多酚含量没有表现出明显的增加。
2.1.3 黄酮
体外模拟胃肠消化过程中蓝莓皮渣粗提物黄酮释放量的变化情况如图3所示。

图3 体外模拟胃肠消化对蓝莓皮渣粗提物黄酮释放量的影响Fig.3 Effect of in vitro simulated gastric and intestinal digestion on flavonoid released from digested crude extract of blueberry pomace
与模拟胃消化0 h相比,3组不同剂量蓝莓皮渣粗提物的黄酮释放量在0.5 h内显著升高(p<0.05),随之下降,可能是随着消化时间的延长,稳定性差的组分发生了降解,消化1 h后黄酮释放量趋于稳定,对照组的黄酮释放量在模拟胃消化过程中也有一定的增加,这表明胃蛋白酶和胃酸对黄酮的释放均具有一定的作用,这与芒果、苹果中黄酮经胃消化后的释放趋势一致[3,23]。
经模拟肠道环境消化后,肠消化组中蓝莓皮渣粗提物的黄酮含量逐渐上升,2 h后黄酮含量达最大值,是胃0 h黄酮含量的4.63倍,是肠消化前(胃消化反应但未进行肠消化)的3.2倍。空白组的黄酮含量在模拟肠消化过程中无显著变化(p>0.05),表明在模拟肠消化过程中,黄酮类植物化学物释放增加的主要贡献来自胰酶和胆汁的作用。黄酮类物质也属于多酚中具有抗氧化活性很高的一类物质,而本试验中黄酮的变化和多酚略有差异,说明在体外消化过程中,不同的多酚物质在pH值和酶的作用下发生了不同的变化。并且黄酮与上述两种活性成分在模拟胃肠道的释放量相比,在肠道环境中更为稳定。
2.2 体外模拟消化过程中蓝莓皮渣粗提物抗氧化活性的变化
2.2.1 还原能力
体外模拟胃肠消化对蓝莓皮渣粗提物还原能力的影响见图4。

图4 体外模拟胃肠消化对蓝莓皮渣粗提物还原能力的影响Fig.4 Effect of in vitro simulated gastric and intestinal digestion on reducing power from digested crude extract of blueberry pomace
从图4可以看出,蓝莓皮渣粗提物在模拟胃消化后,其还原能力在初始消化的30 min最大,随着胃消化时间的延长,其还原能力逐渐下降,尤其是高浓度组在30 min时的还原能力显著高于消化1 h和2 h,也显著高于其他各组(p<0.05)。模拟肠道消化环境中,随着消化时间的延长,各组还原能力呈先增加再减少,在消化2 h~3 h时,各组样品均能呈现较强的还原能力;模拟肠道消化的蓝莓皮渣粗提物的还原能力均低于模拟胃液中的还原能力。这可能与胃消化后蓝莓皮渣粗提物中花色苷、多酚的含量显著增加有关,而肠道环境处于中性使得花色苷等活性成分的结构发生变化,从而导致活性的降低。无论在模拟胃液或模拟肠液中,随着蓝莓皮渣粗提物浓度的下降,其还原能力也随之减小。
2.2.2 清除羟自由基能力
体外模拟胃肠消化对蓝莓皮渣粗提物羟自由基的影响见图5。
从图5可以看出,模拟胃肠道消化过程中,高浓度提取物组的羟自由基清除率均高于低浓度组。蓝莓皮渣粗提物胃液消化组羟自由基清除率在消化0.5 h内达到最大,在消化1 h~2 h保持稳定,这和其他抗氧化成分的变化基本一致;蓝莓皮渣粗提物经胃肠消化组分的抗氧化能力提高,其原因可能与经胃肠消化后组分中多酚和花色苷含量的显著增加有关。模拟人体肠环境中,各组羟自由基清除率有所降低,消化过程中呈先上升,2 h后基本趋于平缓的变化趋势,可能经过模拟人体肠环境处理后花色苷、多酚等活性成分发生大量损失使得活性降低;抗氧化活性是所有活性成分发挥协同和拮抗作用的结果,胃肠环境的变化可能影响了活性成分的结构和相互作用[3]。
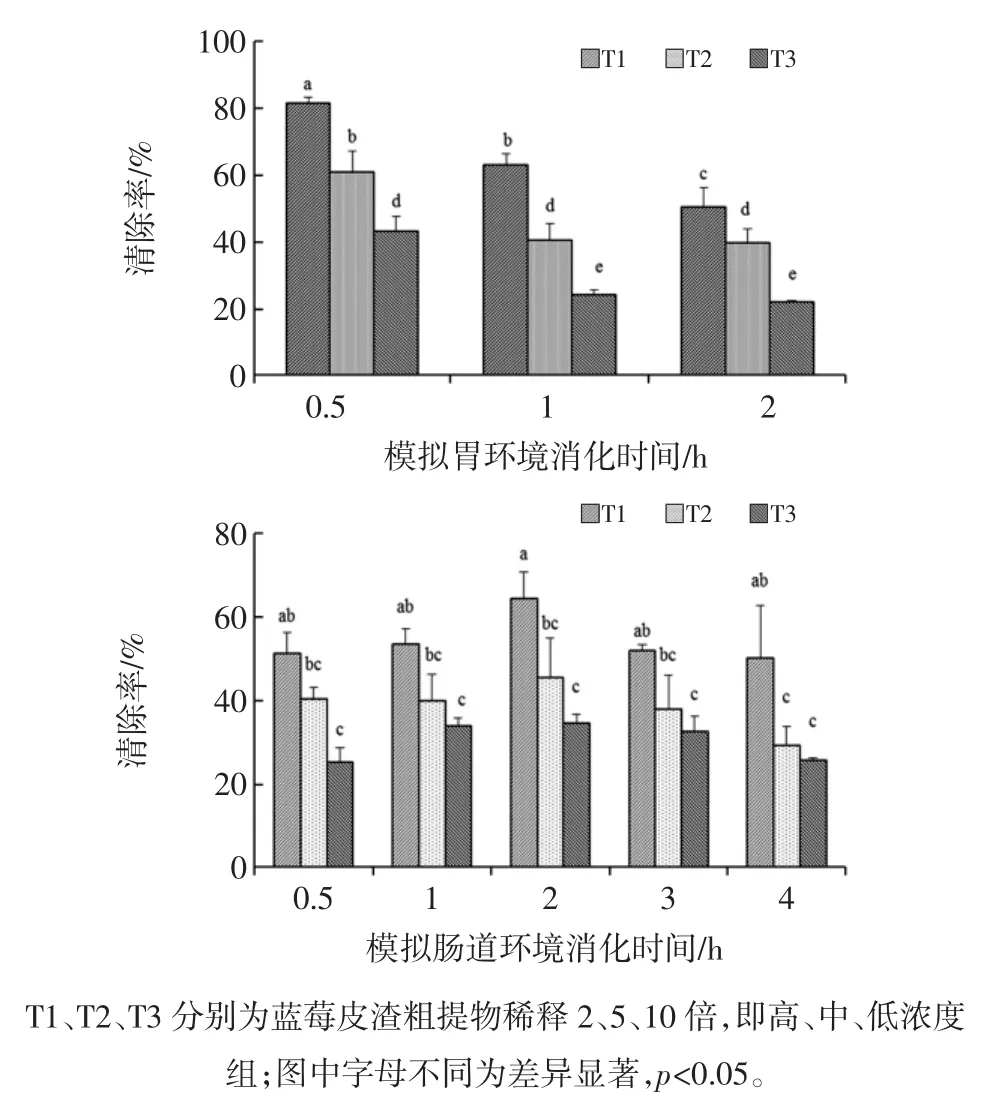
图5 体外模拟胃肠消化对蓝莓皮渣粗提物羟自由基的影响Fig.5 Effect of in vitro simulated gastric and intestinal digestion on the hydroxyl free radical scavenging activity from digested crude extract of blueberry pomace
3 结论
消化系统是生物体的营养摄入系统,食物与消化液之间的相互作用极其复杂。从一方面来说,消化液会破坏细胞结构,促进食物中活性物质的释放;从另一方面来讲,消化液同时也会对活性物质本身造成一定程度的破坏[2-3,21]。由于研究胃肠道消化吸收对食物的影响存在很多困难,因此通过体外模拟胃肠道消化成为研究食品在胃肠消化吸收常用的手段之一[10,20]。目前对于蓝莓生物活性研究,包括黄酮、色素、多酚等,均采用传统的有机溶剂提取法,但此种方法测定的活性成分含量与人体消化吸收的含量之间存在着较大的差异,不足以准确反映蓝莓营养成分的实际价值,郑影已对不同提纯度的蓝莓模拟消化后的抗氧化进行了研究[4]。任何一种生物活性物质在发挥其作用之前,都要经过人体的胃肠道消化,而消化也会对多酚化合物的生物活性产生影响。尤其是蓝莓皮渣中的活性成分丰富,因此本文采用了体外消化法对蓝莓皮渣活性成分和抗氧化活性进行了研究。
本研究结果表明,多酚、花色苷等活性成分经胃消化后含量显著升高,3个不同剂量样品组中多酚、花色苷和黄酮释放量在消化0.5 h内显著升高,这可能是由于部分蛋白质在胃蛋白酶的作用下水解为小分子多肽,从而被大分子蛋白质包围的多酚被释放出来;或胃蛋白酶减弱了部分酚酸与细胞壁间的酯键,使酚酸从细胞壁中脱离;也可能是胃蛋白酶破坏了多酚—蛋白质结构,使得多酚脱离了蛋白质分子的束缚[22]。对照组中的花色苷和多酚活性成分消化前后无显著差异,可见酸碱环境对他们的释放无明显影响,胃蛋白酶和胃酸对黄酮的释放均具有一定的作用。而从酸性的胃环境过渡到温和的碱性肠道环境中,由于pH值的变化,会造成生物可利用多酚,尤其是花色苷减少。模拟肠道环境的酶可能作用于结合态的酚类物质,中性或偏碱性多酚可以在肠液介质中稳定存在(如槲皮素),而酸性多酚大量降解或异构为其它碱性条件下稳定的形式,在肠道中各活性成分的多少也就取决于其释放量和降解量的高低。本试验中蓝莓皮渣粗提物中黄酮比多酚和花色苷在肠液中稳定,没有出现显著的降低,虽然黄酮仍属于多酚,但没有在多酚中表现出来,有可能是消化过程中释放的黄酮类物质占多酚的总含量比较少,或者黄酮降解、转化产生的物质不影响多酚含量的测量。粗提物在模拟消化过程中抗氧化活性的变化规律与多酚的释放规律基本一致,虽然肠道中黄酮的量较高,但可能其在消化过程中的释放增加不足以引起抗氧化活性的显著变化。由于原材料本身物质的不同,各活性成分含量及抗氧化活性在模拟消化过程中的变化情况不完全一样。但为了能深入分析蓝莓皮渣经胃肠消化后释放出的活性成分否被人体吸收,还需要利用细胞模型和动物模型来做进一步的研究。
[1] Neal O,Liu RH.Health benefits of whole grain phytochemicals[J].Critical Reviews in Food Science and Nutrition,2010,50:193-208
[2] 刘冬,万红霞,赵旭,等.小麦不同部位在体外模拟消化过程中抗氧化活性的变化规律[J].现代食品科技,2016,32(4):94-99
[3] 彭梦雪,从彦丽,刘冬.模拟胃肠消化评价苹果多酚、黄酮及抗氧化活性的相关性[J].现代食品科,2016,32(1):122-129
[4] 郑影,何玉龙,郑洪亮,等.蓝莓花色苷体外及模拟人体胃肠环境的抗氧化活性研究[J].食品与生物技术学报,2014,33(7):736-740
[5] 李颖畅,李冰心,孟良玉,等.圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性[J].食品科学,2012,33(9):105-109
[6] 陈介甫,李亚东,徐哲.蓝莓的主要化学成分及生物活性[J].药学学报,2010,45(4):422-429
[7] 周笑犁,杜斌,周艳,等.蓝莓皮渣花色苷粗提物的抗氧化性[J].食品与发酵工业,2017,43(6):181-186
[8] 周笑犁,陈丽,王瑞,等.蓝莓不同部位常规营养成分及活性物质的比较分析[J].食品工业科技,2016,37(8):283-289
[9] BLANQUET S,EVELIJIN Z,BEYSSAC E,et al.A dynamic artificial gastrointestinal system for studying the behavior of orally administered drug dosage forms under various physiological conditions[J].Pharmaceutical Research,2004,21(4):585-591
[10]闵芳芳,聂少平,万宇俊,等.青钱柳多糖在体外消化模型中的消化与吸收[J].食品科学,2013,34(21):24-29
[11]楼舒婷,林雯雯,孙玉敬,等.黑果枸杞中多酚的体外消化及其抗氧化性研究[J].食品工业科技,2015,36(11):66-70
[12]Kim IS,Yang MR,Lee OH,et al.Antioxidant activities of hot water extracts from various spices[J].International Journal of Molecular Sciences,2011,12(6):4120-4131
[13]齐美娜.紫色马铃薯中花色苷的提取、产品研制及其抗氧化活性的研究[D].哈尔滨:东北农业大学,2013
[14]李颖畅,孟宪军.蓝莓花色苷抗氧化活性的研究[J].食品与发酵工业,2007,33(9):61-64
[15]Tagliazucchi D,Verzelloni E,Bertolini D,et al.In vitro bioaccessibility and antioxidant activity of grape polyphenols[J].Food Chemistry,2010,120(2):599-606
[16]Huang HZ,Sun YJ,Lou ST,et al.In vitro digestion combined with cellular assay to determine the antioxidant activity in Chinese bayberry(Myrica rubra Sieb.et Zucc.)fruits:A comparison with traditional methods[J].Food Chemistry,2014,146:363-370
[17]Costa P,Grevenstuk T,Costa AMRD,et al.Antioxidant and anticholinesterase activities of Lavandula viridis L’Hér extracts after in vitro gastrointestinal digestion[J].Industrial Crops&Products,2014,55:83-89
[18]Roleira FMF,Tavares-Da-Silva EJ,Varela CL,et al.Plant derived and dietary phenolic antioxidants:anticancer properties[J].Food Chemistry,2015,183:235-258
[20]李俶,王谢祎,翟宇鑫,等.多酚化合物体外模拟消化的稳定性分析[J].食品科学,2016,37(13):1-5
[21]Gumienna M,Lasik M,Czarnecki Z.Bioconversion of grape and chokeberry wine polyphenols during simulated gastrointestinal in vitro digestion[J].International Journal of Food Science and Nutrition,2011,62(3):226-233
[22]熊云霞.体外模拟消化对苹果和梨的抗氧化活性及抗癌细胞增殖活性影响的研究[D].广州:华南理工大学,2013
[23]胡义东,文良娟.体外模拟胃肠消化对芒果抗氧化成分及其活性的影响[J].南方农业学报,2014,45(9):1652-1656

