鸡真核生物翻译起始因子2α的原核表达与多克隆抗体的制备
袁晓琴,陈仕怡,刘梦茜,李春燕,许丽惠,周五朵,吴异健,王全溪
(福建农林大学 动物科学学院,福建 福州 350002)
真核翻译起始因子(eukaryotic translation initiation factors,eIFs)普遍存在于真核细胞中,是蛋白质翻译所必需的蛋白,并且其可以保证mRNA在核糖体上经过正确编码而形成复合物的一类蛋白质。eIF2、eIF3、eIF4、eIF5 4种是我们目前研究较多的真核翻译起始因子。eIF2复合物主要由σ、B、Y三个亚基构成,是GTP中比较具有代表性的结合蛋白,eIF2可以和GTP、Met.tRNAi二者结合,形成Met.tRNAi-elF2α-GTP三元复合物,mRNA的5’端就是与该复合物和核糖体的40 S小亚基相结合的复合物结合[1],从而进行真核生物蛋白质的合成。eIF2α在蛋白质翻译的过程中有重要作用,如peIF2α能抑制蛋白质翻译,使内质网应激早期蛋白质的合成减少,从而减少内质网内折叠蛋白的来源,使未折叠蛋白和错误折叠的蛋白在内质网中的堆积减少,进而减轻内质网的负担[2]。当发生内质网应激时,内质网会激活一些伴侣蛋白进行细胞的自我保护,例如PERK可以通过发生自身磷酸化从而使真核翻译起始因子eIF2α上第51位的丝氨酸也发生磷酸化,eIF2α磷酸化后会抑制翻译起始复合物中GDP与GTP的交换,进而抑制蛋白质的翻译和合成,导致细胞周期的停滞[3-4]。
目前已知,禽类病毒感染可以引起宿主细胞发生内质网应激。为了更加深入的研究内质网应激在禽类病毒性传染病致病机理中的作用,急需制备禽类eIF2α的抗体,为之后的研究工作提供基础。
1 材料与方法
1.1 试料与试剂
DH5α和E.coliBL 21(DE3) 感受态细胞(北京全式金生物技术有限公司);健康新西兰黄兔(福建农林大学派尼尔兔园);pET-32a(+)原核质粒(本实验室保存);T4连接酶(美国Promega公司);EcoRIQuickCut 和SalIQuickCut限制酶(大连宝生生物技术公司)等。
1.2 eIF2α基因的扩增
根据NCBI中的鸡eIF2α蛋白(登录号:NM_001006477.1)基因的CDs区,设计一对特异性引物eIF2α-F:AGAATTCATGCCAGCACTAAGCTGTAGG eIF2α-R:GGTCGACCTACCTTGCAAGCTCAGTCTC(划线处为EcoRI和SalI酶的酶切位点)。以上、下游引物F和R作为扩增引物,提取的鸡总RNA经反转录后合成的cDNA为模板,对eIF2α基因进行PCR扩增。最后PCR扩增产物用1%琼脂糖凝胶电泳鉴定,经鉴定正确后切胶回收纯化[5]。
1.3 pET-32a(+)-eIF2α重组质粒的构建
将准备好的pET-32a(+)原核表达载体与纯化后的目的片段分别用EcoRI和SalI进行双酶切反应,双酶切反应结束后,以目的片段与载体摩尔比例为7∶1于4 ℃过夜进行连接反应。
1.4 重组质粒pET-32a(+)-eIF2α 的鉴定及其表达鉴定
将连接后的重组质粒,转化至DH5α感受态细胞进行扩增,提取质粒,进行PCR、酶切及测序鉴定。将鉴定正确的重组质粒转至BL21,挑取单克隆菌落接种于液体培养基,加入终浓度为1 mmoL/LIPTG诱导蛋白表达,同时设pET-32a(+)空质粒组。培养8 h后取部分菌液,n收集菌群,用PBS缓冲液重悬,变性后于水中煮沸,对其进行蛋白SDS-PAGE电泳分析。
1.5 eIF2α蛋白诱导表达体系优化及纯化
将保存的阳性克隆菌复苏,加入IPTG使其终浓度一致,分别在0,4,6,8,10 h取样,确定最佳诱导时间。在最佳诱导时间并且IPTG终浓度相同的条件下,分别在4,25,37,45 ℃温度下培养,确定最佳的诱导温度。在最佳诱导温度和培养时间基础上,分别加入IPTG诱导剂0,0.2,0.4,0.6,0.8,1.0,1.2,1.5 mmoL/L进行诱导,最终确定最佳的诱导浓度。将蛋白分别置于40,80,120,160,200,240,280 mmoL/L咪唑洗脱液下洗脱,确定咪唑的最佳纯化浓度。
1.6 兔抗eIF2α蛋白多克隆抗体的制备鉴定和其血清效价
在免疫前,分离部分血清作为阴性对照。以eIF2α蛋白为抗原,第一次注射每只以1 mg抗原溶液与等体积的不完全弗氏佐剂充分乳化后注射于一只新西兰黄兔的皮下组织,14 d后二次免疫,方法同上,二次免疫后采集血液分离血清,将纯化后的eIF2α蛋白作为抗原,以兔血清为一抗,HRP-羊抗兔为二抗进行Western blot鉴定,鉴定正确后加强免疫,7 d后心脏采血并分离血清。同时将纯化后的重组蛋白(浓度20 mg/mL)作为抗原包被于96孔酶标板,将采取到的兔血清按比例稀释7次后分别作为一抗,HRP-羊抗兔为二抗,应用间接ELISA法测定血清的抗体效价。
2 结 果
2.1 目的基因的扩增和pET-32a(+)-eIF2α重组质粒的构建
对eIF2α基因进行PCR扩增,获得约为834 bp的特异性条带(图1A)。对阳性菌群进行PCR鉴定发现以上游引物F和下游引物R进行PCR鉴定,可扩增出一条约为834 bp的特异性条带,用载体通用引物T7可扩增一条约为1 574 bp的条带(图1B)将引物互换之后分别可扩增1 000 bp和1 419 bp的条带。将质粒进行酶切鉴定,单酶切可见一条约6 734 bp的条带,双酶切可见两条分别为834 bp和5 900 bp的条带(图1C)。经测序鉴定(图1D)表明,该序列与鸡源系列具有较高的同源性。
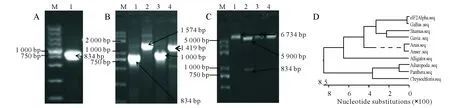
A:eIF2α基因PCR扩增结果;M:Trans2KTMPlus DNA Maker;1:eIF2α 。B:重组质粒PCR鉴定;M:Trans2KTMPlus DNA Maker;1:eIF2α;2:T7;3:eIF2α上游+T7下游;4:eIF2α下游+T7上游。C:重组质粒酶切鉴定;M:Trans2KTMplus DNA Maker;1:重组质粒;2:EcoRI和SalI限制酶双酶切;3:SalI限制酶单酶切;4:EcoRI限制酶单酶切。D:eIF2α基因核苷酸序列同源性比对分析
A:Results of eIF2α gene by PCR;M:Trans2KTMPlus DNA Maker;1:eIF2α gene。B:recombinant plasmid PCR identification results;M:Trans2KTMPlus DNA Maker; 1:eIF2α gene;2:T7 Primer;3:eIF2α F+T7R;4:eIF2α R+T7F。C:Double and single enzyme identification of recombinant plasmid;M:Trans2KTMPlus DNA Maker;1:recombinant plasmid was not cut;2:double enzyme;3:SalIsingle enzyme;4:EcoRIsingle enzyme。D:eIF2α gen nucleotide sequence homolopy analysis
图1 目的基因的扩增和pET-32a(+)-eIF2α重组质粒的构建
Fig.1 Target gene amplification and pET-32a(+)-eIF2α constrution
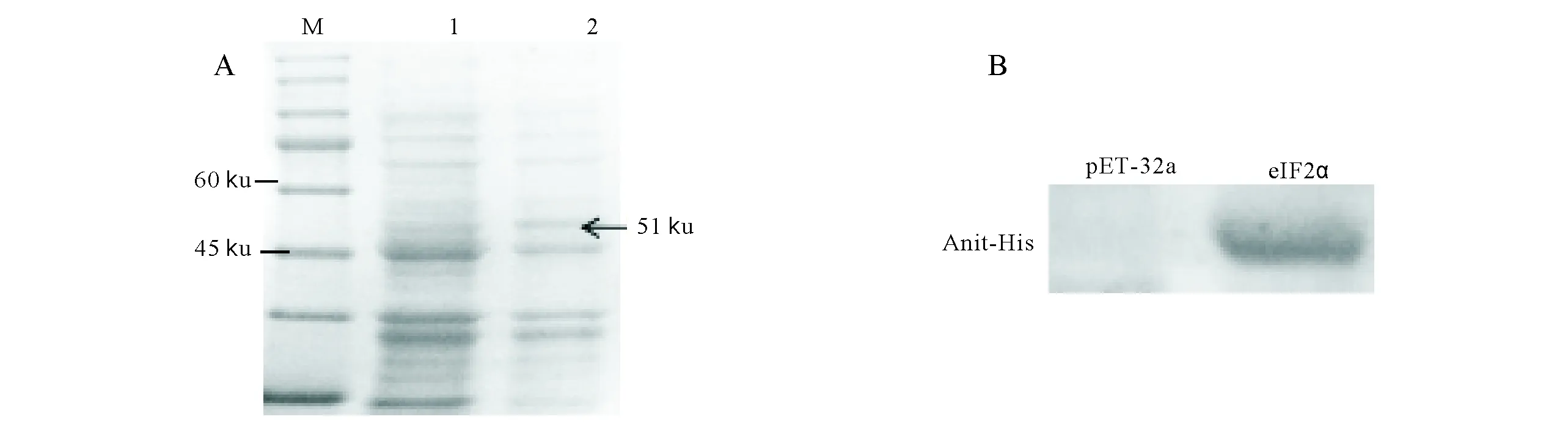
A:重组蛋白的表达;B:重组蛋白的Western-blot鉴定A:Expression of recombinant proteins;M:Protein marker;1:Blank control;2:pET-32a(+)-eIF2α;B:Results of recombinant protein expression图2 pET-32a(+)-eIF2α蛋白的SDS-PAGE和Western-blotFig.2 SDS-PAGE and Western-blot of recombinant protein
2.2 eIF2α蛋白的SDS-PAGE鉴定结果
将鉴定正确的重组质粒转BL21后,收集菌液取上清溶液进行蛋白SDS-PAGE电泳分析(图2.A)和Western-blot鉴定(图2B),发现约51 ku大小条带,其为目的条带。
2.3 eIF2α蛋白诱导表达条件的优化结果及纯化结果
在IPTG终浓度一致的培养条件下,在不同诱导时间蛋白的表达量不同,发现在诱导时间为10 h时重组蛋白的表达量最佳(图3A)。在诱导时间与IPTG终浓度均一致的培养条件下,发现不同温度蛋白表达量不同,确定最佳的诱导温度为45 ℃(图3B)。在诱导温度和培养时间相同的条件下,分别加入不同终浓度的IPTG诱导剂,发现1.5 mmoL/L时,其蛋白表达量多于其他诱导浓度(图3C)。用不同浓度的咪唑洗脱液洗脱重组蛋白发现200 mmol/L时,洗脱的蛋白较多并且杂带较少(图3D)。
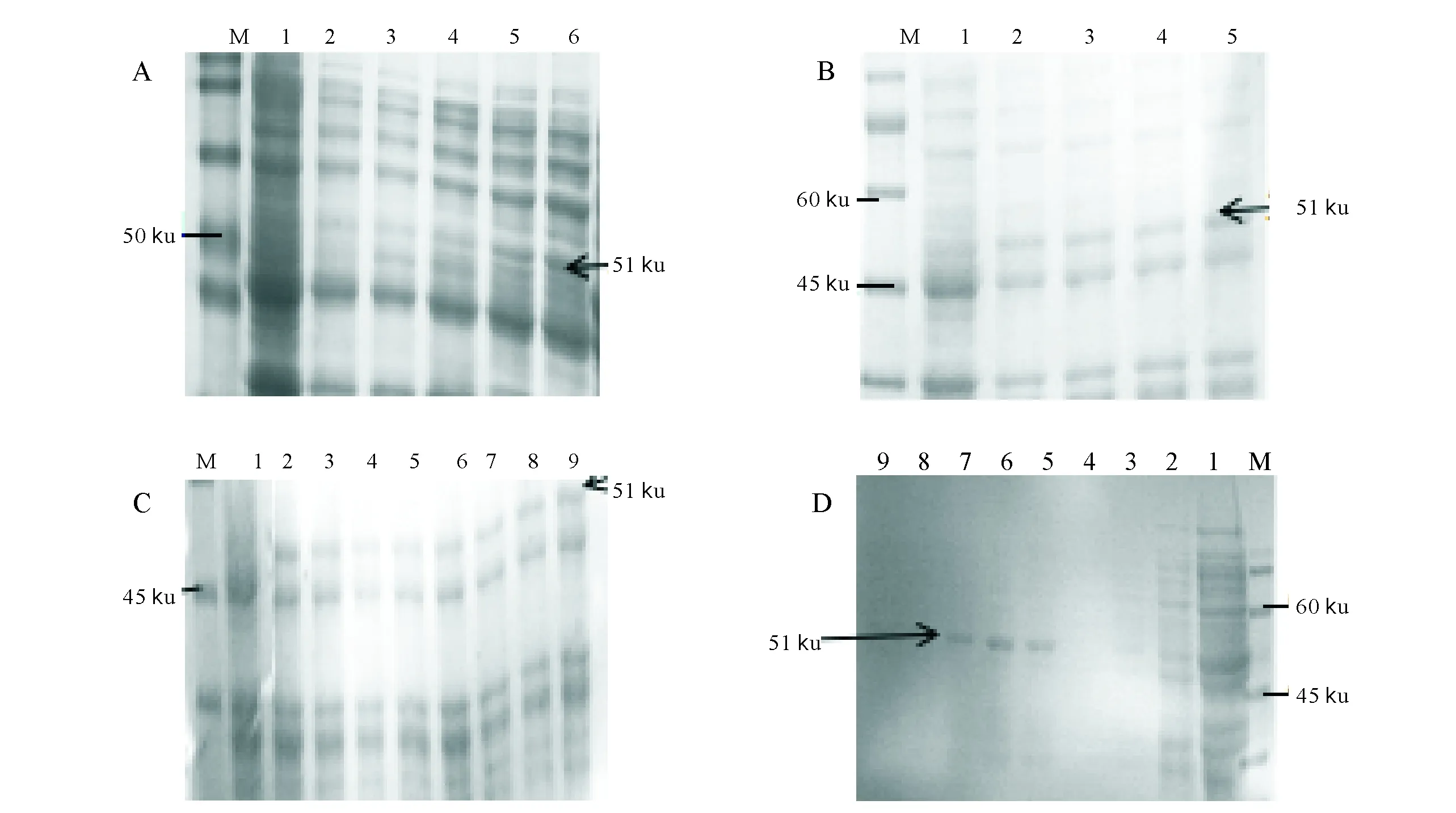
A:重组蛋白诱导时间的优化;M:marker;1:空质粒;2:0 h;3:4 h;4:6 h;5:8 h;6:10 h。B:重组蛋白诱导温度的优化;M:marker;1:空质粒;2:4 ℃;3:25 ℃;4:37 ℃;5:45 ℃;C:重组蛋白诱导浓度的优化;M:marker;1:空质粒;2~9分别为1.5,1.2,1.0,0.8,0.6,0.4,0.2 和0 mmoL/L IPTG诱导的pET-32a(+)-eIF2α重组质粒。D:pET-32a(+)-eIF2α蛋白纯化;M:marker;1:纯化前蛋白溶液;2:流出液 3~9分别为40,80,120,160,200,240,280 mmol/L等不同浓度的咪唑洗脱液A:Optimization of recombinant proteins induction by differ hours;M:Protein marker;1:pET-32a;2-6:pET32a-eIF2α in BL21(DE3) was respectively induced by IPTG at 0,4,6,8,10 h。B:Optimization of recombinant proteins induction by temperature;M:Protein marker;1:pET-32a;2-5:pET32a-eIF2α in BL21(DE3) was respectively induced by IPTG at 4,25,37,45 ℃。C:Optimization of recombinant proteins induction by IPTG;M:Protein marker;1:pET-32a;2-9:pET32a-eIF2α in BL21(DE3) was respectively induced by IPTG at 1.5,1.2,1.0,0.8,0.6,0.4,0.2,0 mmol/L。D:Analysis of protein pET32a-eIF2α by Purification;M:Protein marker;1:Unpurified Protein sample;2:outflow 3-9:Liquid was washed by respectively urea in 40,80,120,160,200,240,280 mmol/L图3 重组蛋白的诱导表达条件优化和纯化结果Fig.3 Results of optimization and Purification of recombinant protein expression
2.4 兔抗pET-32a(+)-eIF2α多克隆抗体的Western-blot鉴定结果及血清效价
对获得的eIF2α多克隆抗体进行Western blot分析结果显示(图4.A),证明该抗体为预期的目的蛋白。间接ELISA结果表明(图4.B),通过该免疫程序制备的兔多克隆抗体的效价可达到1∶8 000。

A:eIF2α阳性血清;B:兔多克隆血清的抗体A:EIF2 alpha positive serum;B:Rabbit polyclonal serum antibody图4 重组蛋白的Western blot鉴定结果及血清效价Fig.4 Results of recombinant protein identification by Western blot and Serum tilter
3 讨 论
eIF2α可以激活细胞凋亡的过程,也可以增加一些如肝脏和脂肪组织中JNK、葡萄糖调节蛋白(GRP94)、内质网伴侣蛋白GRP78/Bip等内质网应激过程中的标志蛋白的表达水平,尤其是其可以调节内质网应激中的蛋白表达水平,在目前对内质网的研究中尤其重要。磷酸化的PERK可以使elF2α也发生磷酸化,eIF2α通过磷酸化变为p-eIF2α发挥作用,一方面使内质网伴侣分子蛋白如GRP78、GRP94表达水平提高,另一方面p-eIF2α可以活化死亡蛋白caspase-12,启动细胞凋亡程序[6]。
有研究发现甘草酸就可以通过内质网应激中PERK-eIF2α在不引起凋亡的情况下诱导细胞周期停滞在G1期[7-8]。在研究心力衰竭的试验中也发现了PERK的磷酸化并且上调eIF2α及其磷酸化[9]。当肾组织缺10 min就可以引起肾小管上皮细胞发生内质网应激,此时内质网激酶PERK分子被激活,磷酸化的eIF2 alpha可以增加20多倍[10]。除此之外,当机体受到氧化应激、缺血缺氧、营养不良、病毒感染和钙平衡失调等病理生理因素影响时,最终均会引起内质网应激,近年来随着对内质网应激研究的不断深入,发现内质网应激无论在肿瘤、肝脏等疾病还是在细胞凋亡方面都有重要的作用,临床实践上用内质网应激来解释疾病也越来越多,而PERK/eIF2α是内质网应激先发生变化的蛋白,为了更好的研究禽类疾病获得其多克隆抗体十分必要[11-13]。
大肠杆菌具有生长快、培养经济方便、表达水平高、可选载体和宿主多及遗传性状清晰等优点,因此在本试验通过将eIF2α 构建到常用的 pET32a(+ )载体中,在大肠杆菌中得到高效表达。本试验中重组融合蛋白中His标签的存在有利于该蛋白的纯化,但仍有轻微杂带,其原因可能是超声上清中存在带有His标签的其他蛋白或对Ni2+更具亲和力的杂质。
[1] 魏群,曹江.真核翻译起始因子与肿瘤[J].中国细胞生物学学报,2007,29(2):197-201.
Wei Q,Cao J.Eukaryotic translation initiation factor and tumor[J].Chinese Journal of cell biology,2007,29(2):197-201.
[2] 庄娟.内质网应激[J].生物学教学,2012,37(12):2-4.
Zhuang J.Teaching of endoplasmic reticulum stress[J].Biology Teaching,2012,37(12):2-4.
[3] Blais J D,Filipenko V,Bi M,et al.Activating transcription factor 4 is translationally regulated by hypoxic stress[J].Molecular & Cellular Biology,2004,24(17):7469-7482.
[4] 薛欣,赵京元,李玉梅.肿瘤坏死因子α诱导PERK-eIF2α介导的未折叠蛋白反应[J].毒理学杂志,2011(2):100-103.
Xue X,Zhao J Y,Li Y M.TNFα induces PERK-eIF2α-mediated unfolded protein response[J].Toxicol,2011(2):100-103.
[5] 曾文斌,刘悦欣,谢巧,等.副猪嗜血杆菌hhdA克隆、抗原表位预测和表达[J].江西农业大学学报,2015,37(3):512-516.
Zeng W B,Liu Y X,Xie Q,et al.Cloning and expression of the gene fragment encoding epitopeof protein hhdA from Haemophilus parasuis[J].Acta Agriculturae Universitatis Jingxiensis,2015,37(3):512-516.
[6] 刘芳,邹萍,陈敏,等.Caspase-12短发夹状RNA在内质网应激性凋亡中的作用[J].中华实验外科杂志,2005,22(12):1568-1570.
Liu F,Zou P,Chen M,et al.Mechanism of apoptpsis induced by ER stress through siRNA against caspase-12[J].Chin J Exp Surg,2005,22(12):1568-1570.
[7] Zhu J,Chen M,Chen N,et al.Glycyrrhetinic acid induces G1phase cell cycle arrest in human nonsmall cell lung cancer cells through endoplasmic reticulum stress pathway[J].International Journal of Oncology,2015,46(3):981-988.
[8] 朱洁.甘草次酸通过内质网应激途径诱导非小细胞肺癌细胞G1期阻滞的作用机制研究[D].南京:南京中医药大学,2014.
Zhu J.Glycyrrhetinic acid through endoplasmic reticulum stress pathway to induce G1 phase arrest in non-small cell lung cancer cells[D].Nanjing:Nanjing University of Chinese Medicine,2014.
[9] Fu H Y,Okada K,Liao Y,et al.Ablation of C/EBP homologous protein attenuates endoplasmic reticulum-mediated apoptosis and cardiac dysfunction induced by pressure overload[J].Circulation,2010,122(4):361-369.
[10] Sindram D,Rüdiger H A,Upadhya A G,et al.Ischemic preconditioning protects against cold ischemic injury through an oxidative stress dependent mechanism[J].Journal of Hepatology,2002,36(1):78-84.
[11] Wang W A,Groenendyk J,Michalak M.Endoplasmic reticulum stress associated responses in cancer[J].Biochimica et Biophysica Acta(BBA)-Molecular Cell Research,2014,1843(10):2143-2149.
[12] 关丽英,许彩民,潘华珍.内质网应激介导的细胞凋亡[J].生物化学与生物物理进展,2007,34(11):1136-1141.
Guan L Y,Xu C M,Pan H Z.Endoplasmic reticulum stress mediated apoptosis[J].Biophysics in and Biochemistry,2007,34(11):1136-1141.
[13] 郭有,高艳芳,胡恭华.内质网应激与肝脏脂质代谢关系的研究进展[J].毒理学杂志,2015(3):231-234.
Guo H,Gao Y F,Hu G H.The research progress on the relationship between endoplasmic reticulum stress and liver lipid metabolism[J].Journal of Toxicology,2015,29(3):231-234.
——疾病防治的新靶标

