扁桃种皮组织结构和超微结构观察
张宏平,张晋元,吴国良,赵彦华
(1.山西晋城职业技术学院,山西 晋城 048026;2.河南农业大学 园艺学院,河南 郑州 450002;3.山西农业科学院 果树研究所,山西 太原 030031)
扁桃(AmygdaluscummunisL.)是世界重要的干果,产量居四大干果之首[1-2]。扁桃食用部位为种子。种皮是种仁营养输送的部位,影响着扁桃种子的质量和产量。目前,系统研究扁桃种皮组织结构和超微结构尚未报道,主要集中在遗传育种和栽培管理方面[2-3]。在种皮微观领域方面,桃和核桃上有所报道[4-6]。本试验以扁桃种皮为材料,系统观察其不同时期组织结构和超微结构的特点,达到丰富干果类种皮微观领域研究;通过观察扁桃种皮韧皮部SE/CC复合体与周围薄壁细胞的细胞学联系,对其糖卸载方式作出初步判断,为提高扁桃的质量和产量提供一定的理论参考。
1 材料与方法
1.1 试验材料
本试验材料取自运城万荣县董谋为果园。扁桃进入盛花期后,于4月初每隔10 d取材1次,直到9月中旬扁桃果实成熟。切片材料于中国农业大学和南京农业大学的电镜室进行观察。
1.2 试验方法
1.2.1 透射电镜样品制备方法 透射电镜组织包埋块的制作方法在吴国良[5]的基础上稍做改动。扁桃种皮维管束组织用双面刀切成2~3 mm3小块后,在4 ℃下用2.5%的戊二醛(浓度为2 mol/L的磷酸缓冲液配制,pH 7.2)固定7 h,抽气直到切块完全下沉。用1 mol/L的磷酸漂洗液进行漂洗,4 ℃下1%锇酸固定过夜后,用1 mol/L磷酸缓冲液漂洗3次,每次15 min;4 ℃下,将材料置于体积分数为50%、70%、90%的乙醇中分别脱水20 min;纯丙酮室温过渡,分3次,每次15 min;Spurr(Dow Chemical co,USA )包埋,68 ℃下聚合8 h。修块后,用切片机(型号LKB-8800)切成70 nm厚的小片,醋酸双氧铀和柠檬酸铅双染法染色,电镜观察(型号为JEOL-1230和日立H-7650)。
1.2.2 半薄切片样品制备方法 在透射电镜做好包埋块的基础上,用超薄切片机(型号KLB—V)进行半薄切片,厚度0.4 μm。载玻片上滴入水滴,挑入薄片,在60 ℃温台上烘干,使切片很好地贴于载玻片上。用亚甲蓝/天青A(pH6.9)/番红(pH9.1)进行染色[7],水洗去多余染料,加拿大树胶封片,Olympus显微镜下进行拍照观察。
2 观察结果
2.1 不同时期扁桃种皮组织结构观察
扁桃种皮从早期到末期可明显的分为3层结构,在不同时期各层细胞特征变化相当明显。在发育早期,扁桃种皮可以明显的辨别出细胞层数,外种皮为3层细胞组成,中种皮为18~20层细胞,内种皮由1层细长形细胞组成。扁桃外种皮细胞较小,过渡层与外种皮相邻,细胞排列整齐,细胞体积小。中种皮细胞排列比较凌乱,细胞间隙较大,并出现为数不少的含酚细胞,中种皮细胞层数最多,其面积占到了整个种皮横截面的4/5还多。维管束分布于中种皮靠近内种皮一侧,其中导管和筛管几乎成并列排列,属于并列维管束类型。在维管束周围有大量的厚壁细胞存在。与扁桃种皮其他各层相比,扁桃内种皮细胞体积巨大,排列不整齐,细胞大小悬殊,细胞内含物较少(图1,a)。

a.早期扁桃种皮组织结构;b.中期扁桃种皮组织结构;c.为b的放大图像;d.后期扁桃种皮组织结构;e.末期扁桃种皮组织结构;f.为e的放大图像。E.外种皮;T.过渡层;M.中种皮;EN.内种皮;C.导管;ST.筛管;TC.传递细胞。a.The early almond seed capsule tissue structure;b.The middle almond seed capsule tissue structure;c.It is the figure b magnified image;d.The middle-last almond seed capsule tissue structure;e.The last almond seed capsuletissue structure;f.It is the e magnified image.E.Episperm;T.Transition layer;M.Mesosperm;EN.Endopleura;ST.Sieve tube;TC.Transfer cell.图1 扁桃种皮组织结构Fig1. The almond seed capsule tissue structure
扁桃种皮发育到中期,外种皮细胞最外层已经木质化成硬皮,内部2层细胞透明化,细胞质少,只能看到细胞核。过渡层细胞变化不明显,只是细胞壁加厚(图1,b)。中种皮普通薄壁细胞进一步发育,细胞质充满了整个细胞,细胞排列紧密,胞间隙变小(图1,b、c)。中种皮的维管束发育完全,筛管中的伴胞染色较深,导管呈规则的圆形(图1,b、c)。内种皮细胞进一步增大,根据细胞特征可以分为2种类型:开始出现发达内嵴的传递细胞和内含很丰富的薄壁细胞,二者在体积上都进一步增大(图1,b)。
扁桃种皮发育到后期时,外种皮细胞进一步木质化成为一个整体,外种皮最外层细胞木质化加重,内部2层细胞被染成蓝色。过渡层细胞也木质化,邻近外种皮的中种皮细胞已经完全解体成为空腔状,其他中种皮细胞没有解体,细胞体积明显缩小,细胞排列更紧凑。内种皮的细胞变化是:出现的传递细胞内嵴进一步发达,另一类细胞壁也有加厚的趋势。与中期相比,中后期整个种皮的体积收缩变小,木质化程度加重(图1,d)。
扁桃种皮发育到末期,外种皮木质化更加严重,2层木质化的细胞染成黑色,镶嵌在外种皮中。过渡层细胞显著的特点是从中后期到末期融为一个整体,已经看不出过渡层。中种皮细胞大部分解体,仅有靠近内种皮的2层细胞存在;内种皮普通薄壁细胞中的细胞内含物减少,空泡化明显,但是细胞壁次生加厚的特殊细胞已经完全表现出传递细胞的特征(图1,e、f)。
2.2 扁桃种皮超微结构观察
2.2.1 扁桃种皮薄壁细胞超微结构 在扁桃种皮发育的早期,细胞质浓厚,高尔基体、线粒体等大量存在,在细胞之间存在于大量的胞间连丝(图2,a)。不同类型的囊泡在扁桃种皮早期出现,如规则的同心圆囊泡、边缘加厚的同心囊泡等(图2,a)。在扁桃种皮发育的中期,最突出的特点就是细胞中增加了大量线粒体,细胞核大而清晰,内质网、各种细胞器散布在细胞质中,细胞之间的胞间连丝较为发达(图2,b)。在末期,扁桃细胞中的细胞器开始部分出现降解,线粒体也开始降解,但细胞之间的胞间连丝还很发达,扁桃外种皮细胞已完全木质化,黑色物质充满了整个细胞,细胞壁木质化,成为种子很好的保护层(图2,c、d)。

a.早期扁桃种皮薄壁细胞;b.中期扁桃种皮薄壁细胞;c.末期扁桃种皮薄壁细胞;d.末期扁桃外种皮木质化细胞。CW.细胞壁;M.线粒体;N.细胞核;PD.胞间连丝;Ve.囊泡;G.高尔基体;L.木质化;BS.黑色物质。a.The early almond seed capsule ultrastructure;b.The middle almond seed capsule ultrastructure;c.The late almond seed capsule parenchyma cells;d.The late almond seed capsule lignified cells.CW.Cell wall;M.Mitochondria;N.Nucleus;PD.Plasmodesma;Ve.Vesicles;G.Gologiosome;L.Lignification;BS.Black substance.图2 扁桃种皮超微结构图版Fig.2 The almond seed capsule ultrastructure
2.2.2 扁桃种皮SE/CC复合体结构 扁桃种皮韧皮部SE/CC复合体中,SE细胞器较少,CC中的细胞质浓,颜色较深,拥有大量的线粒体和细胞核。2~3个比较大的囊泡存在扁桃种皮CC的细胞中,扁桃种皮中期的液泡代替了CC早期的囊泡位置(图3,c、d、g)。在末期时,扁桃种皮SE细胞中出现了大量淀粉粒,SE与SE的筛孔和筛板明显,并且筛孔未被胼胝质堵塞(图3,f)。扁桃种皮SE/CC复合体是典型结构,在二者之间的胞间连丝构造属于常见的类型,即SE一边为单通道结构,CC一边为多通道结构(图3,d、g)。在末期,SE/CC复合体中细胞壁变厚占据了大量的细胞间隙(图3,h),胞间连丝出现堵塞的现象,在扁桃种皮SE/SE细胞之间,部分胞间连丝是相通的,部分被胼胝质堵塞(图3,e、f),可见SE/CC、SE/SE复合体由胞间连丝和胼胝质共同调控物质运输和信息交流。
2.3 扁桃种皮维管束SE/CC复合体与周围韧皮薄壁细胞之间的细胞学联系
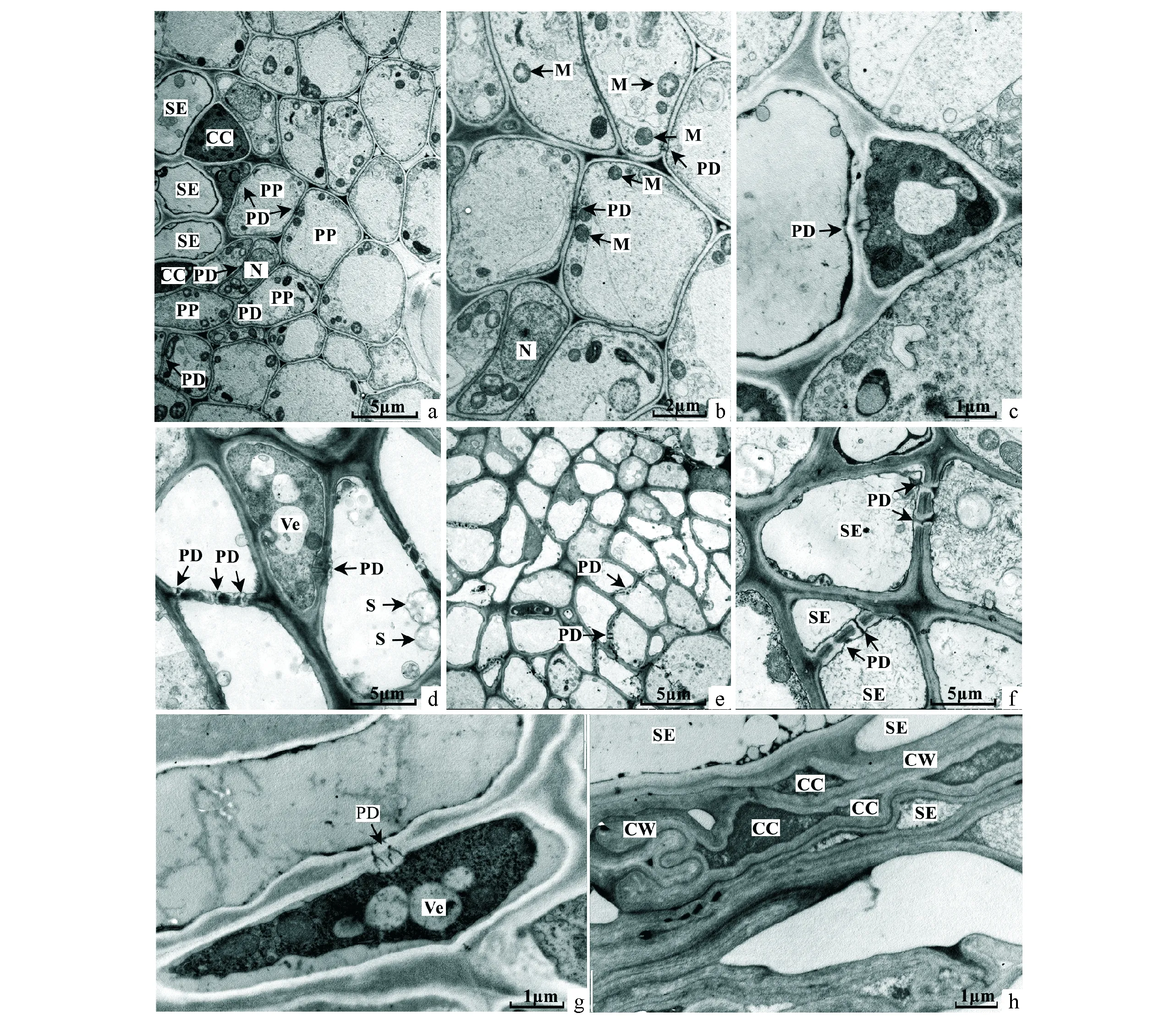
a.早期的扁桃种皮维管束;b.为a的放大图像;c.早期的扁桃种皮SE/CC复合体;d.中期扁桃种皮SE/CC复合体;e.末期扁桃种皮维管束;f.末期扁桃种皮SE/SE;g.早期扁桃种皮SE/CC复合体纵切图;h.末期扁桃种皮SE/CC。CC.伴胞;CW.细胞壁;M.线粒体;N.细胞核;PD.胞间连丝;PP.韧皮部周围薄壁细胞;S.淀粉颗粒;SE.筛管;Ve.囊泡。a.The early almond seed capsule vascular bundle ultrastructure;b.It is the figure a magnified image;c.The early almond seed capsule SE / CC complex;d.The middle almond seed capsule SE/CC complex;e.The last almond seed capsule vascular bundle ultrastructure;f.The last almond seed capsule SE /SE ultrastructure;g.The early almond seed capsule SE / CC complex slippery image;h.The last almond seed capsule SE/CC complex.CC.Companion cell;CW.Cell wall;M.Mitochondria;N.Nucleus;PD.Plasmodesma;PP.Phloem parenchyma cell;S.Starch;SE.Sieve element;Ve.Vesicles.图3 扁桃种皮维管束结构图版Fig.3 The almond seed capsule vascular bundle ultrastructure
在扁桃种皮SE/CC复合体与周围薄壁细胞联系的观察中可看到:SE/CC复合体与韧皮部周围薄壁细胞间存在胞间连丝,并且相当丰富,韧皮部中大量的薄壁细胞之间胞间连丝很发达(图3,a、b、c),故其存在密切的共质体联系。在扁桃果皮中同时观察到SE和SE之间也存在胞间连丝,并分布于细胞壁加厚处(图3,d、e、f)。在扁桃种皮后期,SE/CC扭曲折叠,细胞壁增厚,占据了大量的胞间隙,但SE/CC之间胞间连丝没有堵塞(图3,h)。扁桃种皮维管束中的SE/CC复合体比较典型(图3,d、g)。在同一个SE和SE之间的有的胞间连丝相通,有的是堵塞(图3,d、e、f)。
3 结论与讨论
3.1 扁桃种皮组织结构
扁桃种皮分为内、中、外3层细胞,外种皮由3层细胞组成,中种皮有18~20层细胞,内种皮由1层细胞组成。这与已报道的桃种皮不一样,外种皮最为明显,桃外种皮有11~13层[6]。扁桃外种皮细胞小;发育至中期,外层细胞木质化;在末期外种皮细胞完全木质化。中种皮由薄壁细胞和维管束组成,细胞间隙比较大;细胞层数较多,中种皮面积占到了整个种皮的4/5多,在后期中种皮解体严重,在末期中种皮细胞全部解体。内种皮细胞在3层细胞中体积最大,有细胞壁特殊增厚的传递细胞出现,分布有大量的次生壁加厚明显的传递细胞。与桃种皮的细胞发育特点相比,差异较大[6]。
3.2 扁桃种皮薄壁细胞超微结构
扁桃种皮薄壁细胞发育特点与张宏平等[6]报道的相似。在扁桃种皮早期细胞质浓,存在大量的高尔基体、线粒体和不同类型的囊泡。中期细胞核大而清晰,内质网多、各种细胞器散布在细胞中,胞间连丝发达,显示了细胞之间物质及能量交换活动旺盛。末期部分细胞器降解,但胞间连丝还很发达。外种皮细胞已完全木质化,黑色物质充满了整个细胞,细胞壁木质化,这种现象在桃种皮、核桃种皮中曾有报道[5-6]。
3.3 扁桃种皮SE/CC复合体及卸载方式
扁桃种皮SE/CC复合体之间胞间连丝在SE一侧为多通道,在CC一侧为单通道,如葡萄[8-9]、苹果[10-12]、核桃[5]一样。胞间连丝不仅是转运有机营养的通道,而且也是调节物质和信息流的通道。在核桃SE与SE之间也可以看到被胼胝质堵塞的筛板的胞间连丝,形状如面包[5],在扁桃也观察到一些SE/SE之间有胞间连丝被堵塞的现象。这些复杂的胞间连丝结构上还有大量的蛋白,也包括细胞骨架的组成成份,单一的胞间连丝和分枝状的胞间连丝在作用上有很大的不一样[13],近些年来已被证实[13]。所有这些SE/CC复合体、SE/SE之间的复杂胞间连丝的关系及具体作用需要进一步研究。
在扁桃种皮韧皮部薄壁细胞与SE/CC复合体之间存在发达的胞间连丝,可见共质体系联系密切,由此初步推断扁桃种皮糖卸载的方式为共质体,通过浓度梯度压力[14-15],扩散到扁桃胚中,提供种子所需的营养。另外,超微结构观察确定韧皮部卸载方式还是不够的,仍需要酸性转化酶胶体金定位和活体组织荧光示踪试验来验证结果。
3.4 扁桃种皮细胞衰老方式
植物细胞衰老机制和假说主要分为6种[16],但是在组织结构和超微结构水平上的变化表现为2种:第一类是常见的细胞软化,即细胞壁解体,细胞膜的粘性变化[19],细胞器降解,更进一步囊泡化和空泡化,细胞器模糊[18-19];另外一类是细胞木质化,包括细胞质解体,细胞壁加厚,细胞扭曲变形,细胞被黑色致密的物质等充满并木质化。以果肉为食用部位的,大部分属于第一类细胞衰老方式,如:苹果、葡萄、草莓、李、杏;而食用部位为种子的果实大都属于第二类。本试验研究的扁桃种子细胞衰老方式属于第二类,以上结果通过本试验组织结构和超微结构观察验证(图1,d、f、f;图2,c、d)。
[1] 张倩茹,尹蓉,王红宁,等.扁桃种质资源及其开发利用研究进展[J].农产品加工月刊,2016,15(8):49-51.
Zhang Q R,Yin R,Wang H N,et al.Research progress of the germplasm gesources and the exploitation and utilization of almond[J].Farm Products Processing,2016,15(8):49-51.
[2] 王琳,姜喜,李志军.中国扁桃种质资源研究进展[J].北方园艺,2013,37(20):178-181.
Wang L,Jiang X,Li Z J.Research progress on germplasm resources of China almond[J].Northern Horticulture,2013,37(20):178-181.
[3] 申烨华,李聪,张萍,等.扁桃研究进展[J].食品科学,2007,28(2):359-362.
Shen Y H,Li C,Zhang P,et al.Research progress in almond[J].Food Science,2007,28(2):359-362.
[4] 兰秒,杨瑞,胡晓,等.桃种皮细胞的超微结构观察及生长素结合蛋白ABP1亚细胞定位[J].电子显微学报,2016,35(1):42-48.
Lan M,Yang R,Hu X,et al.Observation of cellular ultrastructure and subcellular localization of ABP1 in seed coat of peach fruit[J].Journal of Chinese Electron Microscopy Society,2016,35(1):42-48.
[5] Wu Guoliang,Zhang Xiaoyan,Zhang Lingyun,et al.Phloem unloading in developing walnut is symplasmic in the seed pericarp and apoplasmic in the fleshy pericarp[J].Plant Cell Physiol,2004,45(10):1461-1470.
[6] 张宏平,张晋元,吴国良.桃种皮组织结构和超微结构观察[J].山西农业大学学报(自然科学版),2012,32(2):140-145.
Zhang H P,Zhang J Y,Wu G L.Observation on the structure and ultrastructure of peach seed coat[J].Shanxi Agric Univ Jou(Natural Science Edition),2012,32(2):140-145.
[7] 李兵,李登弟,张杰,等.植物树脂半薄切片染色方法的改进[J].植物生理学报,2011,47(12):1207-1212.
Li B,Li D D,Zhang J,et al.Modification of resin semithin section staining method in plant tissues[J].Plant Physiology Journal,2011,47(12):1207-1212.
[8] Xia G H,Zhang D P.Intercellular symplastic connection and isolation of the unloading zone in flesh of the developing grape berry[J].Acta Botanica Sinica,2000,42(9):898-904.
[9] Yao Y,Xu G,Mou D,et al.Subcellular Mn compartation,anatomic and biochemical changes of two grape varieties in response to excess manganese[J].Chemosphere,2012,89(2):150-157.
[10] 谢红江,陶炼,杨文渊,等.川藏高海拔不同生态区苹果叶肉细胞叶绿体超微结构的比较[J].果树学报,2016,33(2):164-171.
Xie H J,Tao L,Yang W Y,et al.Comparison of chloroplast ultrastructure of ‘Golden Delicious’apple leaves in different ecological regions of high attitude areas in Sichuan-Ti-bet[J].Journal of Fruit Science,2016,33(2):164-171.
[11] Zhang D P,Lu Y M,Wang Y Z,et al.Acid invertase is predominantly localized to cell walls of both the practically symplasmically isolated element/companion cell complex and parenchyma cells in developing apple fruits[J].Plant Cell Environ,2001,24:691-702.
[12] Zhang L Y,Peng Y B,Travier S P,et al.Evidence for apoplasmic phloem unloading in developing apple fruit[J].Plant Physiology,2004,135(1):574-586.
[13] Kumar D,Kumar R,Hyun T K,et al.Plasmodesmata and phloem-based trafficking of macromolecules[J].Springer New York,2013(1):183-216.
[14] 岳胜钱,贾燕,杨秋生.植物光合同化物韧皮部卸载途径研究进展[J].河南农业科学,2016,45(4):1-6.
Yue S Q,Jia Y,Yang Q S.Research progress on phloem unloading pathway of plant photoassimilate[J].Journal of Henan Agricultural Sciences,2016,45(4):1-6.
[15] Chen C,Yuan Y,Zhang C,et al.Sucrose phloem unloading follows an apoplastic pathway with high sucrose synthase in Actinidia fruit[J].Plant Science an International Journal of Experimental Plant Biology,2017,255:40
[16] 陈睿.植物衰老机理研究进展探讨[J].绿色科技,2012,50(5):6-9.
Chen R.Advances in research on plant senescence mechanism[J].Journal of Green Science and Technology,2012,50(5):6-9.
[17] 韩英群,郭丹,魏鑫,等.果实采后软化生理机制及调控技术研究进展[J].北方园艺,2017,41(5):30-38.
Han Y K,Guo D,Wei X,et al.Research advances on softening physiological mechanisms and its regulation in postharvest fruit[J].Northern Horticulture,2017,41(5):30-38.
[18] 李秀杰,韩真,李晨,等.根域限制对‘巨峰’葡萄果实可溶性糖含量及韧皮部超微结构的影响[J].植物生理学报,2016,52(10):1546-1554.
Li X J,Han Z,Li C,et al.Effects of root restriction on soluble sugar contents and ultrastructure of phloem tissues in ‘Kyoho’ grape berry[J].Plant Physiology Journal,2016,52(10):1546-1554.
[19] 韩贻仁.分子细胞生物学[M].4版.北京:北京大学出版社,2012.
Han Y R.Molecular cell biology[M].4th.Beijing:Beijing University Press,2012.

