水稻OsXCP2基因表达载体及RNAi载体构建
张 磊,孙晓棠,唐子清,叶梦斐,崔汝强
(江西农业大学 农学院,江西 南昌 330045)
水稻作为世界范围内种植的主要粮食作物之一,其产量受多种病原物影响。在水稻抗病过程中,筛选和利用水稻抗病基因尤为重要。木质部半胱氨酸蛋白酶为植物与病原物互作中重要的酶类,而植物基因组大约编码140种半胱氨酸蛋白酶,划分为15个家族,属木瓜蛋白酶同源酶类[1]。木质部半胱氨酸蛋白酶2(XCP2)为半胱氨酸蛋白酶CA家族成员,是植物管状细胞凋亡(PCD)过程中重要的自溶酶[2-3]。基于木材具有重要的经济价值,早期对XCP蛋白酶的研究主要集中在植物调节木质部分化、管状分子PCD机制、次生壁及木质素生物合成上,且研究成果较少[4-6]。但近期相关研究表明半胱氨酸蛋白酶在植物响应病害侵染中也具有重要作用[1],其中较为典型的是番茄与枝孢菌(Cladosporiumfulvum)互作[7],玉米与玉蜀黍黑粉菌(Ustilagomaydis)亲和互作[8],再者是其参与本氏烟超敏反应抵抗多种病原细菌,如梨火疫病菌(Erwiniaamylovora)和丁香假单胞菌(Pseudomonassyringae)[9]。作为调控植物抵抗活体营养型病原侵染的重要途径,水杨酸(SA)信号转导途径能强烈诱导XCP蛋白表达,且渗透实验表明该蛋白酶能诱导植物PR1基因表达[10]。Zhang等[11]通过突变体技术、酵母双杂交、免疫共沉淀等技术研究拟南芥与青枯病菌(Ralstoniasolanacearum)互作,发现该病菌可通过与拟南芥PRN2蛋白互作,抑制拟南芥XCP2蛋白降解,使拟南芥易受青枯病菌侵染。可见,木质部半胱氨酸蛋白酶为植物与病原物互作中重要的蛋白,而目前在水稻抗性基因的研究中对该基因的研究鲜有报到,仅严秀蕊等[12]进行过相关研究,对XCP2蛋白在水稻与病原物互作中的作用进行阐述,可为开发利用水稻半胱氨酸蛋白酶类抗病资源奠定基础。
本实验室利用水稻潜根线虫侵染抗感品种而获得具有表达量明显上调的OsXCP2基因,为进一步研究其相关的功能,本研究将“酶切-连接”克隆技术与Gateway技术相结合构建了水稻OsXCP2基因过表达载体和RNAi载体,为后续探究该基因在水稻与病原物互作中的作用奠定基础。
1 材料与方法
1.1 试验材料
试验用水稻样品采自本实验室室内种植的R155(霸王鞭)水稻根部组织;质粒提取试剂盒、感受态大肠杆菌DH5a、pEASY-T3克隆载体购自北京全式金公司;植物过表达载体pCAMBIA1302(含mGFP5、his tags)、Gateway入门载体pGWc和植物RNAi载体pB7GWIWG2(II)由中国农业科学院作物研究所范成明老师惠赠。植物RNA提取试剂盒购自QIAGEN公司、LR重组酶购自invitrogen公司;T4DNA 连接酶、rTaq酶、反转录试剂盒均购自TaKaRa公司;胶回收试剂盒购自AXYGEN公司;KOD-plus-NEO高保真酶、限制性内切酶BglII、SpeI、Eam1105 I购自NEB(北京)。
1.2 试验方法
1.2.1OsXCP2基因orf克隆 参照植物RNA提取试剂盒操作说明从水稻根部组织中提取总RNA。以oligo(dT)n为引物,在AMV反转录酶作用下合成cDNA第一条链。将本实验室水稻转录组测序得到OsXCP2基因EST序列提交至水稻基因组数据库(http://rice.plantbiology.msu.edu/)进行blast,获得OsXCP2开放阅读框(orf)序列信息,根据该orf序列设计特异性引物XCP2-F/R。采用25 μL PCR反应体系进行扩增,PCR组分如下:2.5 μL 10×PCRKOD-plus-NEO高保真酶用缓冲液、2.5 μL dNTP (2 mmol/L)、 1.5 μL MgSO4(25 mmol/L)、2 μL 反转录产物、引物XCP2-F/R(10 mmol/L)各0.5 μL、1 μLKOD-plus-NEO高保真酶(5 U/μL)、加ddH2O至25 μL;PCR扩增条件如下:94 ℃ 2 min,98 ℃ 10 s,65 ℃ 30 s,68 ℃ 1 min,共35个循环,68 ℃孵育10 min,除退火温度有所变化,下文PCR扩增体系均参照上述体系进行。扩增产物经10 g/L琼脂糖凝胶电泳检测后,参考胶回收试剂盒说明书进行纯化回收。将回收产物连接到pEASY-T3载体后,转化感受态大肠杆菌DH5a,以M13通用引物进行菌落PCR鉴定,鉴定出的阳性克隆送苏州泓讯公司测序,抽提测序正确的重组质粒T3:XCP2,并于-80 ℃保存菌株。
1.2.2 植物过表达载体构建 用OsXCP2基因特异性引物XCP2O-F/R(两端带有限制性酶切位点BglII和SpeI)进行PCR扩增;用限制性内切酶BglII和SpeI酶切PCR产物与植物过表达载体pCAMBIA1302,酶切体系如下:5 μL 10×NEB 3.1 buffer、10 μL PCR产物/pCAMBIA1302载体、BglII、SpeI各1 μL、加ddH2O至50 μL,37 ℃酶切过夜后,分别胶回收酶切产物。IMPLEN微量核算分析仪检测回收产物浓度后,调整目的片段与线性化载体的浓度为3∶1。参照T4DNA连接酶说明书连接目的基因与pCAMBIA1302载体,利用冻融法将连接产物转化进入感受态大肠杆菌DH5a后,用特异性引物pCA-F/R进行菌落PCR鉴定,扩繁并抽提阳性质粒,用BglII和SpeI进行双酶切鉴定,体系参照上文酶切体系。鉴定为阳性的克隆测序验证,抽提测序正确的重组质粒pCAMBIA1302:XCP2,并于-80 ℃保存菌株。
1.2.3 植物RNAi载体构建 提交OsXCP2序列至NCBI进行Blast,获该基因特异性序列,根据该序列设计特异性引物Ri-F/R,以T3:XCP2质粒为模板,用该引物进行PCR扩增,回收纯化扩增产物与Eam1105 I酶切处理的入门载体pGWc,利用T4DNA连接酶将OsXCP2基因的RNAi片段与酶切后的pGWc连接,连接产物转化感受态大肠杆菌后,用M13通用引物进行菌落PCR鉴定和测序。参展质粒提取试剂盒说明抽提阳性重组质粒pGWc:XCP2与pB7GWIWG2(II)质粒;参照invitrogen LR重组酶操作说明配制反应体系后,于25 ℃进行LR重组反应。重组产物转化进入感受态大肠杆菌DH5a后,涂布于含50 mg/L Spe(壮观霉素)的LB平板上,37 ℃培养12 h,将根据35 s启动子与终止子序列设计的特异性引物FX-F/R与Ri-R组合使用,鉴定靶片段插入方向,抽提靶片段以反向重复方式插入的阳性克隆质粒,送上海祥音公司测序,测序正确的克隆命名为pB7GWIWG2:XCP2,菌株-80 ℃保存备用。
1.2.4 重组质粒转化农杆菌GV3101 参展细菌感受态细胞制备方法制备土壤农杆菌GV3101感受态细胞,利用冻融法将2种重组质粒导入感受态农杆菌GV3101中,分别在含50 mg/L Rif(利福平)和50 mg/L Kan(卡那霉素)的YEP平板与含50 mg/L Rif、50 mg/L Spe(壮观霉素)的YEP平板上28 ℃培养36~48 h,以特异性引物pCA-F/R和Ri-F/R分别进行菌落PCR鉴定,鉴定出的阳性克隆用30%甘油保存在-80 ℃冰箱备用。

表2 PCR扩增所用引物
2 结果与分析
2.1 OsXCP2基因过表达载体构建
用含BglII和SpeI酶切位点的特异性引物扩增T3:XCP2质粒获得大小为1 100 bp左右的OsXCP2 cds序列(两端含酶切位点);用T4DNA连接酶将酶切纯化后cds片段与植物过表达载体pCAMBIA1302进行连接,利用冻融法将连接产物转化进入感受态大肠杆菌DH5a,用pCA-F/R进行菌落PCR鉴定阳性克隆,PCR产物约2 490 bp,与预计一致。扩繁阳性克隆后抽提重组质粒,用限制性内切酶BglII和SpeI进行双酶切鉴定,预计产生1个10 550 bp大小片段和1个1 100 bp大小片段,与电泳结果一致(图2)。
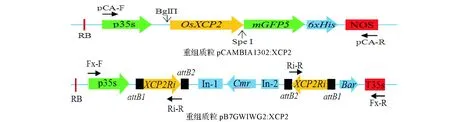
图1 重组质粒示意Fig.1 The structure of recombinant plasmids
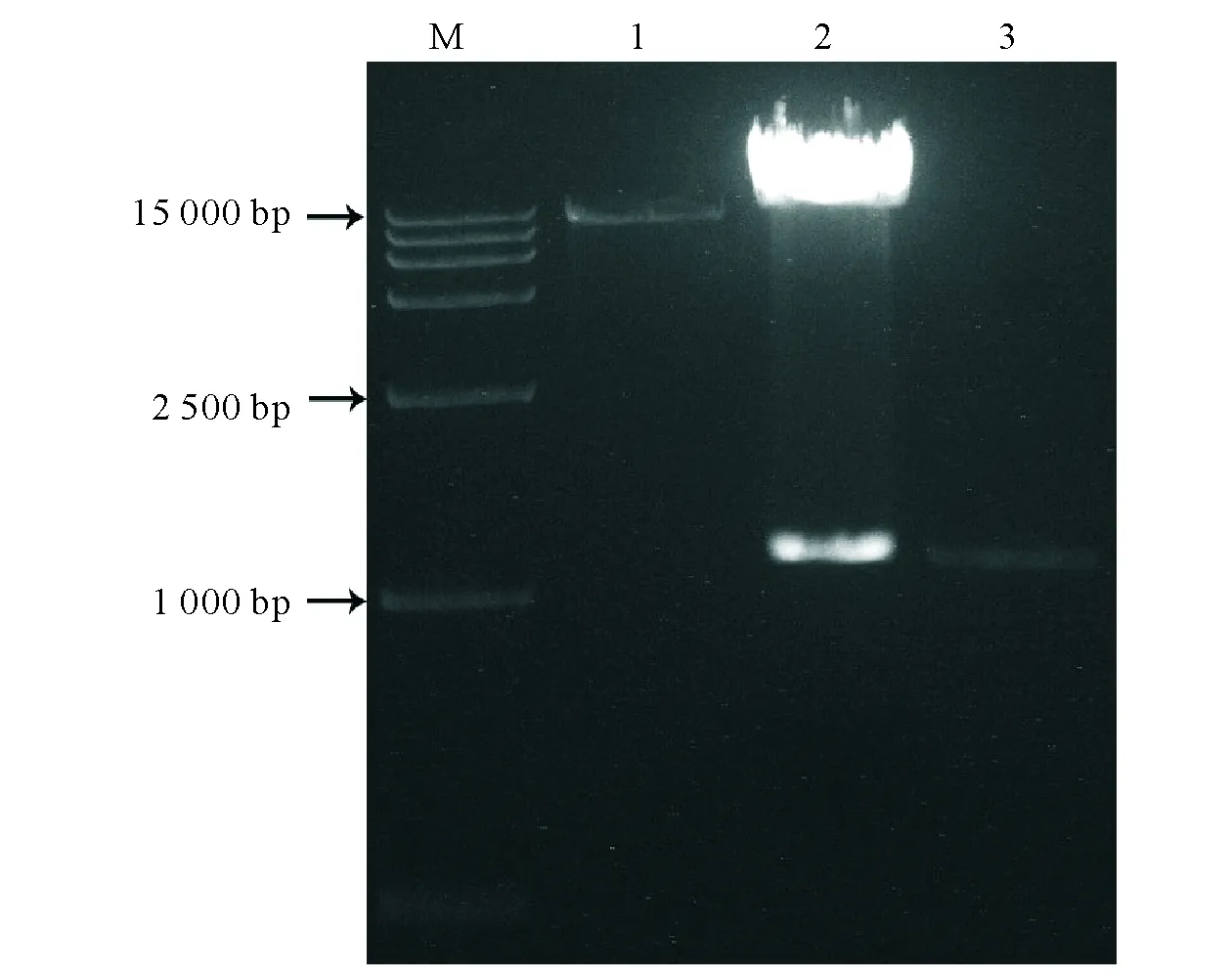
M:marker DL 15000;1: pCAMBIA302载体;2:双酶切产物;3: 基因cds序列M:DNA marker DL15000;1:pCAMBIA1302 vector;2:enzyme digest;3:XCP2 CDS fragment图2 重组过表达质粒双酶切鉴定 Fig.2 Double enzyme digesting of recombinant overexpression plasmid

M:marker DL 2000;1:Ri-F/R扩增结果;2:FX-F/Ri-R扩增结果;3:FX-R/Ri-R扩增结果M:molecular marker of DL 2000;1,2,3:PCR assay used by primer Ri-F/R,FX-F/Ri-R,FX-R/Ri-R图3 重组RNAi PCR鉴定Fig.3 PCR assay of recombinant RNAi plasmid
2.2 OsXCP2基因RNAi载体构建
利用OsXCP2 RNAi片段特异性引物与限制性内切酶Eam1105 I以T3:XCP2质粒为模板,将RNAi靶片段克隆进入Gateway入门载体pGWc后,在LR重组酶作用下将靶片段通过位点特异性重组反向重复插入到植物RNAi载体pB7GWIWG2中,以引物FX-F/Ri-R、FX-R/Ri-R、Ri-F/R进行菌落PCR鉴定(图3),并对鉴定出的阳性克隆进行测序,结果显示靶片段成功重组到该RNAi载体中。

M:marker DL 5000;2、11:阳性克隆M:molecular marker of DL 5000; 2、11:positive clones图4 重组过表达质粒转化GV3101鉴定Fig.4 PCR assay of recombinant overexpression plasmid transforming into GV3101

M:marker DL 2000;除10外均为阳性克隆M:molecular marker of DL 2000;Execept 10:positive clone图5 重组RNAi质粒转化GV3101鉴定Fig.5 PCR assay of recombinant RNAi plasmid transforming into GV3101
2.3 重组质粒转化GV3101
参照质粒提取试剂盒抽提两种重组质粒,利用冻融法将其转化进入感受态土壤农杆菌GV3101,分别用特异性引物pCA-F/R、Ri-F/R进行菌落PCR鉴定。电泳结果(图4、5)与预计的2 490 bp和450 bp。表明重组质粒已成功转化入土壤农杆菌GV3101。
3 结论与讨论
本试验首先利用特异性引物获得该基因两端含BglII和SpeI酶切位点的编码区序列,然后在2种限制性内切酶和T4DNA连接酶作用下将目的片段重组进入植物表达载体pCAMBIA1302(含GFP、his tags)。再者,在NCBI中比对获得该基因特异性序列信息,并设计引物获得该序列。由于未在该序列中添加用于BP重组反应的特异性位点,先利用内切酶Eam1105 I将该片段重组到入门载体pGWc中,再进行LR重组反应获得重组质粒pB7GWIWG2:XCP2。由于pGWc载体中AhdI酶切位点经酶切后产生的平末端难以进行连接,选用其同尾酶Eam1105 I进行切割,连接反应相对容易进行。
早期对XCP编码基因的研究主要集中在植物细胞分化及细胞凋亡,虽然近期对其在植物抗病机制中的作用进行了阐述,但局限于玉米,番茄、拟南芥等,对其在水稻与病原互作中的作用并无相关报道。水稻作为重要的粮食作物,病原物的侵染不仅会导致水稻产量下降,也会引起水稻细胞程序性死亡,如潜根线虫的侵染[13]。因属活体营养型的潜根线虫不导致水稻细胞凋亡,水稻的这种细胞凋亡被认为是水稻的自我保护机制之一。水杨酸(SA)信号转导途径在水稻抵抗病原侵染中发挥重要作用[14-15],早期对玉米XCP2的研究表明SA信号途径可通过与其作用诱导植物防卫反应[9-10],同时对拟南芥XCP2的研究表明青枯病菌可以通抑制XCP2的降解使水稻易受该病菌侵染[11],此虽说明XCP2在植物与病原物互作中发挥重要作用,但目前水稻中关于该基因的报道甚少,对其具体作用机制和在水稻与病原物互作中的作用了解不足。构建水稻OsXCP2基因植物表达载体(含GFP、his tag)和RNAi载体为后续进行该基因亚细胞定位、互作蛋白研究、转基因水稻株系获取提供条件,可进一步阐明半胱氨酸蛋白酶在植物细胞凋亡、组织分化及在水稻抗病中的作用。
[1] Van D H,R A L.Plant proteases:from phenotypes to molecular mechanisms[J].Annual Review of Plant Biology,2008,59(1):191-223.
[2] Petzold H E,Zhao M,Beers E P.Expression and functions of proteases in vascular tissues[J].Physiologia Plantarum,2012,145(1):121-129.
[3] Bollhoner B,Prestele J,Tuominen H.Xylem cell death:emerging understanding of regulation and function[J].Journal of Experimental Botany,2012,63(3):1081-1094.
[4] Zhao C,Johnson B J,Kositsup B,et al.Exploiting secondary growth in Arabidopsis.construction of xylem and bark cDNA libraries and cloning of three xylem endopeptidases[J].Plant Physiology,1999,123(3):1185-1196.
[5] Funk V,Kositsup B,Zhao C,et al.The Arabidopsis xylem peptidase XCP1 is a tracheary element vacuolar protein that may be a papain ortholog[J].Plant Physiology,2002,128(1):84-94.
[6] Avci U,Earl Petzold H,Ismail I O,et al.Cysteine proteases XCP1 and XCP2 aid micro-autolysis within the intact central vacuole during xylogenesis in Arabidopsis roots[J].The Plant Journal,2008,56(2):303-315.
[7] Van E H P,Van'T Klooster J W,Bolton M D,et al.TheCladosporiumfulvumvirulence protein Avr2 inhibits host proteases required for basal defense[J].The Plant Cell Online,2008,20(7):1948-1963.
[8] Van D L K,Hemetsberger C,Kastner C,et al.A Maize cystatin suppresses host immunity by inhibiting apoplastic cysteine proteases[J].The Plant Cell,2012,24(3):1285-1300.
[9] Gilroy E M,Hein I,van der Hoorn R,et al.Involvement of cathepsin B in the plant disease resistance hypersensitive response[J].The Plant Journal,2007,52(1):1-13.
[10] Hemetsberger C,Herrberger C,Zechmann B,et al.TheUstilagomaydiseffector Pep1 suppresses plant immunity by inhibition of host peroxidase activity[J].PLoS Pathog,2012,8(5):e1002684.
[11] Zhang B,Tremousaygue D,Denanc N,et al.PIRIN2 stabilizes cysteine protease XCP2 and increases susceptibility to the vascular pathogenRalstoniasolanacearumin Arabidopsis[J].The Plant Journal,2014,79(6):1009-1019.
[12] 严秀蕊,张大生,梁婉琪,等.水稻半胱氨酸蛋白酶OsCP2的特征分析及其原核表达与纯化[J].上海交通大学学报,2010,28(2):140-146.
Yan X R,Zhang D S,Liang W Q,et al.Characterization,prokaryotic expression and purification of a Rice cysteine proteaseOsCP2[J].Journal of Shanghai Jiaotong University,2010,28(2):140-146.
[13] Kyndt T,Denil S,Haegeman A,et al.Transcriptional reprogramming by root knot and migratory nematode infection in rice[J].New Phytol,2012,196(3):887-900.
[14] Kyndt T,Nahar K,Haegeman A,et al.Comparing systemic defence-related gene expression changes upon migratory and sedentary nematode attack in rice[J].Plant Biology,2012,14(1):73-82.
[15] Bari R,Jones J D G.Role of plant hormones in plant defence responses[J].Plant Molecular Biology,2009,69(4):473-488.

