细梗香草皂苷联合吉西他滨对胰腺癌细胞BxPC-3抑制作用的研究
于贤金 何亚红 张筱凤
近年来,胰腺癌的发病率及死亡率在全球范围内逐年上升。美国2017年预计胰腺癌新发53 670例,死亡43 090例,排在所有肿瘤死亡原因的第4位[1],预计到2020年,将排在所有肿瘤死亡原因的第2位[2]。大部分胰腺癌患者确诊时已属于晚期,仅有10%~15%的患者有根治手术机会[3]。因此,以吉西他滨(gemcitabine,GEM)为基础的化疗成为进展期胰腺癌患者的重要治疗方法[4]。GEM可显著提高疾病无进展时间及3~5年生存率,但在中位生存期及1年生存率方面提高仍不明显[5]。细梗香草又名满山香、香排草,为报春花科珍珠菜属植物,民间将细梗香草用于治疗感冒咳嗽、风湿痹痛、抗肿瘤等,该植物中的主要成分皂苷有较强的抗肿瘤作用[6]。相关体外实验证实,皂苷对于肺癌、乳腺癌、胃癌、前列腺癌等癌症均有一定的抑制作用[7-8]。本研究观察了细梗香草皂苷(lysimachia capillipes,LC)单独及与GEM联用对胰腺癌BxPC-3细胞增殖和凋亡的影响,并初步研究了LC抗胰腺癌的作用机制,为探讨临床LC联用GEM治疗胰腺癌的可行性提供依据。
1 材料和方法
1.1 材料 BxPC-3细胞株由上海长海医院中心实验室提供。LC由浙江大学生物医学工程学系实验室提供。GEM(健择/Gemzar)由美国礼来公司提供(规格200mg),保存于4℃冰箱。RPMI-1640培养基、Trypsin-EDTA(0.25%)胰蛋白酶、FBS、青霉素-链霉素抗生素购于美国GIBCO公司。MTS细胞增殖试剂盒(MTS法)购于美国艾美捷科技有限公司。Annexin V-FITC/PI双染法细胞凋亡检测试剂及细胞周期检测试剂购于杭州联科生物技术有限公司。抗多聚(ADP-核糖)聚合酶(PARP)抗体、抗半胱氨酸蛋白酶-3(Caspase-3)抗体购于英国abcam公司。
1.2 方法
1.2.1 细胞培养 人胰腺癌细胞株BxPC-3培养于含10%FBS、1%青霉素-链霉素的RPMI-1640培养基中。培养条件为37℃、5%CO2、饱和湿度。细胞单层贴壁生长,至70%~80%时胰蛋白酶消化传代。取复苏传代后生长状态良好的细胞进行后续实验。
1.2.2 细胞增殖抑制率检测 将BxPC-3细胞以5×103个/孔接种于96孔培养板中,培养24h后分别加入0、2、4、8、16、32、64、100μg/ml 的 LC 和 0、1.25、2.5、5、10、20、40μmol/L的GEM,继续培养48h。采用MTS法检测细胞增殖抑制率,吸弃原来的培养基,加入新培养基100μl/孔,再加入 MTS 试剂 20μl/孔,继续培养 1h,用酶标仪测定490nm处的吸光度(OD)。细胞增殖抑制率=(1-观察组OD490/对照组OD490)×100%,细胞存活率=100%-细胞增殖抑制率。再以药物浓度为横坐标,细胞存活率为纵坐标,绘制量效曲线,得到半抑制浓度(IC50)。1.2.3 药物联用实验 将BxPC-3细胞以5×103个/孔接种于96孔培养板中,培养过夜后联合加入LC与GEM(根据细胞增殖抑制试验结果调整浓度梯度:LC为5、10、15、20、25μg/ml,GEM 为 1、3、5、10、30μmol/L,并分别配对)。采用MTS法检测并计算出各药物浓度下细胞增殖抑制率,计算出药物联合作用指数(combined index,CI)。CI判断两种药物的协同性,CI=DA/ICX,A+DB/ICX,B(A和B代表两种不同药物,ICX,A和ICX,B是两种药物单独使用使增殖抑制率达X时的药物浓度,DA和DB是两种药物联合作用使增殖抑制率达X时的药物浓度)。本实验运用Calcusyn 2.0软件计算LC与GEM联用的CI值。CI值大于、等于和小于1,分别对应了两种药物具有拮抗、叠加和协同作用,当CI值<1时,数值越小,协同作用越大[9]。
1.2.4 细胞处理与分组 选取对数生长期的BxPC-3细胞,以3×105个/孔接种于6孔板中,培养24h细胞贴壁后加入不同浓度药物,分为(1)对照空白组:不加药物干预(A 组);(2)GEM 1μmol/L 组(B 组);(3)LC 15μg/ml组(C 组);(4)GEM 1μmol/L+LC 15μg/ml组(D 组)。
1.2.5 流式细胞仪检测细胞凋亡率 根据1.2.4处理与分组细胞后,继续培养48h后用不含EDTA的胰酶消化、收集细胞。用预冷的PBS洗涤细胞2次,收集(1~5)×105细胞。加入100μl 1×Binding Buffer重悬细胞。加入5μl Annexin V-FITC 和 5μl PI Staining Solution,轻轻混匀。避光、室温反应 10min。加入 400μl 1×Binding Buffer,混匀,样品在1h内用流式细胞仪检测细胞凋亡率。
1.2.6 Western blot法检测PARP、Caspase-3蛋白表达水平 根据1.2.4处理与分组细胞后,继续培养48h后提取总蛋白。二喹啉甲酸(BCA)法测定蛋白浓度,制备10%SDS-PAGE凝胶。每孔加入20μg样品进行电泳,半干法转膜,将蛋白转至硝酸纤维素膜上,5%脱脂奶粉液封闭 1h,分别加入相应一抗(1∶1 000 稀释),4℃孵育过夜,TBST洗膜 3次,二抗(1∶5 000稀释)室温孵育 1h,应用ECL化学发光显色,以β-肌动蛋白(β-Actin)为内参,检验试验准确性。Band Leader软件进行条带灰度半定量分析。
1.3 统计学处理 采用SPSS 19.0统计软件。计量资料以表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度的LC和GEM对BxPC-3细胞的增殖抑制率 不同浓度的LC和GEM干预BxPC-3细胞并培养 48h后,8~64μg/ml的 LC 及 1.25~20μmol/L 的 GEM均对BxPC-3细胞的增殖有抑制作用,且呈浓度依赖性, 其IC50分别为16.55μg/ml和1.27μmol/L,见图1-2。
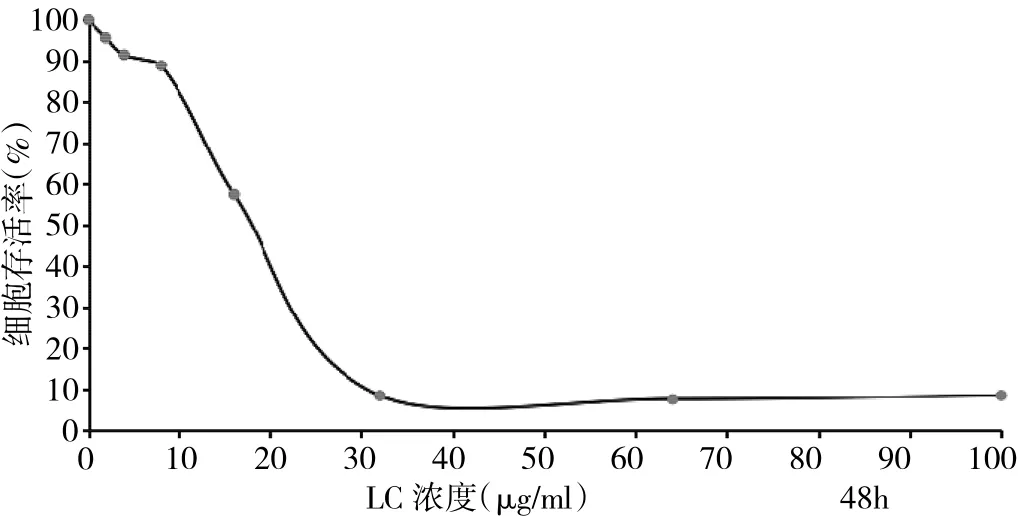
图1 LC对BxPC-3细胞的增殖抑制作用

图2 GEM对BxPC-3细胞的增殖抑制作用
2.2 药物联合实验结果 通过Calcusyn 2.0软件计算出 15μg/ml与 20μg/ml的 LC与各浓度 GEM 的 CI值均<1,具有协同作用。其中15μg/ml的LC与各个浓度的GEM协同作用最强,CI值为0.53~0.65,见表1。结合两种药物的IC50值结果,实验选取单用GEM 1μmol/L,LC 15μg/ml,联用药物 GEM 1μmol/L+LC 15μg/ml的浓度进行后续研究。
2.3 药物对BxPC-3细胞凋亡的影响 药物作用于BxPC-3细胞 48h后,A、B、C、D 组早期凋亡率分别为(0.8±0.22)%、(16.0±0.33)%、(64.5±0.29)%、(93.2±0.29)%,晚期凋亡率分别为(1.9±0.50)%、(12.3±0.58)%、(9.7±0.50)%、(2.8±0.24)%,见图 3。B、C、D 组的早、晚期凋亡率与A组比较差异均有统计学意义(均P<0.01),且D组与B、C组的早期凋亡率比较差异均有统计学意义(均 P<0.01)。
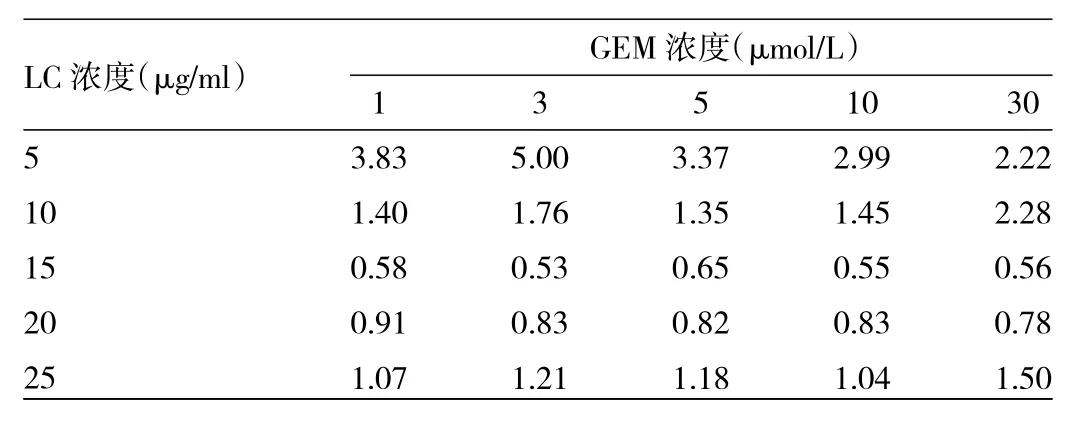
表1 各浓度LC与GEM联合用药的CI值
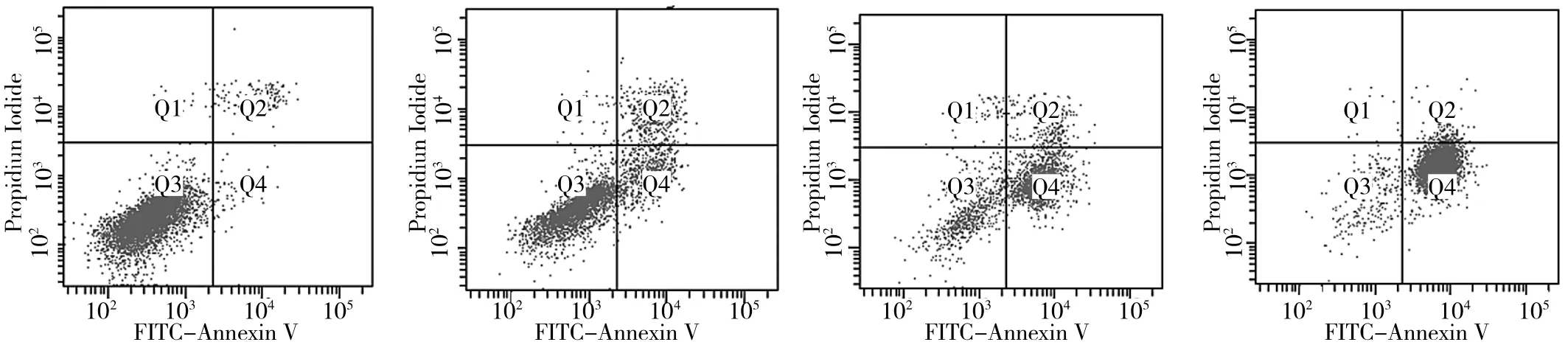
图3 细胞凋亡流式分析图
2.4 4组PARP和Caspase-3蛋白表达水平比较 C、D组与A组比较,PARP蛋白表达水平明显降低(均P<0.05);B、C、D 组与 A 组比较,Caspase-3蛋白表达水平增加(均 P<0.05),见图 4-5。
3 讨论
目前胰腺癌病因尚不明确,可能的危险因素有年龄、吸烟、酒精摄入、肥胖、慢性胰腺炎、基因改变和饮食等[10],发病机制的不明确造成了治疗进展停滞不前。胰腺癌早期诊断极其困难,只有少部分患者发现后有机会进行根治性手术治疗。GEM是胰腺癌的标准化疗药物[4]。GEM可显著提高疾病无进展时间及3~5年生存率,但在中位生存期及1年生存率方面提高不明显[5]。而GEM联合其他药物或放疗,治疗效果也未见显著优势,联合化疗还可能增加细胞毒性反应[11-15]。其他治疗如内镜治疗包括内镜下化疗、冷冻疗法、光动力和射频消融等方法,但没有临床证据支持其疗效优于标准疗法[16]。
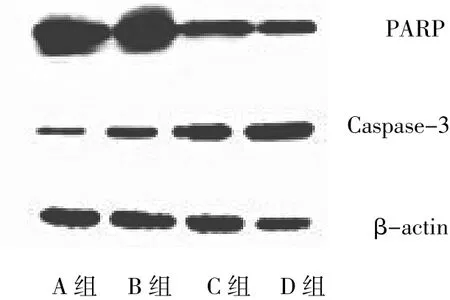
图4 4组PARP和Caspase-3蛋白表达电泳图

图5 4组PARP和Caspase-3蛋白表达水平比较(注:与A组相比,*P<0.05)
在我国,传统中医对于疾病的观点及治疗有着显著的特色,其在肿瘤的治疗方面也取得了不少突破。晚期肿瘤患者以中医药为主治疗可明显提高生活质量,延长生存期。而且中药与化疗伍用还具有较为显著的增效减毒作用。有研究表明中药可以直接杀伤肿瘤细胞、诱导肿瘤细胞凋亡与分化以及中药逆转多药耐药效应[17]。LC已在体外试验中被证实对多种肿瘤具有抑制作用。
本实验采取MTS法检测LC单独及与GEM联用对BxPC-3细胞增殖的影响,结果显示LC、GEM对人胰腺癌BxPC-3细胞有增殖抑制作用,且呈浓度依赖性。本研究发现15μg/ml的LC与1μmol/L的GEM的CI值为0.58,有高度协同作用。此时两药浓度都小于各自的IC50浓度,说明LC可增加GEM抗肿瘤疗效。
细胞凋亡是机体正常细胞受到生理和病理性刺激后自发的程序性死亡,可及时清除机体内受损伤和异常的细胞,维持组织器官的稳定性。它的启动与进行受到精确而复杂的信号系统调控。影响细胞凋亡信号的转导途径,诱发细胞凋亡,是抗肿瘤药物抑制肿瘤的一条重要作用机制。Caspase基因家族在细胞凋亡过程中起着至关重要的作用,在胰腺癌细胞的凋亡中起到极其重要的作用,许多研究表明胰腺癌的致病机制及靶点均通过Caspase家族起作用[18-20],其中Caspase-3处于凋亡有序级联反应的下游,是最重要的效应型关键凋亡执行蛋白酶,在各种因素启动的凋亡程序中起后枢纽作用[21],大多数触发细胞凋亡的因素,最终均需要通过Caspase-3介导的信号传递途径导致细胞凋亡,很多肿瘤组织中Caspase-3表达量较正常组织明显降低。另外,PARP能通过识别结构损伤的DNA片段而被激活,被认为是DNA损伤的感受器,能参与修复受损 DNA、保持染色体结构完整性。Caspase-3能特异性分解PARP使其失去结合DNA的能力,抑制其修复DNA[22]。
本实验结果表明LC、GEM单药及联合用药作用于人胰腺癌BxPC-3细胞可促进细胞凋亡,联合用药组凋亡率明显高于单药组。另外,笔者观察到LC单药组与LC、GEM联合用药作用于BxPC-3细胞后,细胞内Caspase-3蛋白表达明显增加,PARP蛋白表达减少。LC及其联合用药抑制胰腺癌细胞质增殖及促进胰腺癌细胞凋亡的机制可能是通过Caspas-3和PARP途径来实现。至于是通过哪种细胞信号通路和信号分子激活这两种酶,有待进一步深入研究。
综上所述,本研究证实了LC对人胰腺癌细胞具有抑制作用,LC与GEM具有高度协同作用,联合用药可提高疗效。LC可能是通过激活Caspase-3,分解PARP,诱导胰腺癌细胞凋亡。为进一步研究LC抗胰腺癌的信号通路机制及LC用于胰腺癌临床研究提供一定实验依据。
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2017[J].CA Cancer J Clin,2017,67(1):7-30.doi:10.3322/caac.21387.
[2] Ko AH.Progress in the treatment of metastatic pancreatic cancer and the search for next opportunities[J].J Clin Oncol,2015,33(16):1779-1786.doi:10.1200/JCO.2014.59.7625.
[3]Stathis A,Moore MJ.Advanced pancreatic carcinoma:current treatment and future challenges[J].Nat Rev Clin Oncol,2010,7(3):163-172.doi:10.1038/nrclinonc.2009.236.
[4] Oettle H,Post S,Neuhaus P,et al.Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer:A randomized controlled trial[J].JAMA,2007,297(3):267-277.doi:10.1001/jama.297.3.267.
[5] Neuhaus P,Riess H,Schramm H,et al.CONKO-001:Final results of therandomized,prospective,multicenter phase III trial of adjuvant chemotherapy with gemcitabine versus observation in patients with resected pancreatic cancer(PC)[J].J Clin Oncol,2008,26(Suppl):Abstr LBA4504.doi:10.1200/jco.2005.23.16_suppl.lba4013.
[6] 田景奎,邹忠梅,徐丽珍,等.细梗香草化学成分的研究[J].中国药学杂志,2006,41(3):171-173.doi:10.3321/j.issn:1001-2494.2006.03.004.
[7] 费正华,陈云亮,马胜林.细梗香草总皂苷诱导肺癌细胞H460凋亡及其机制的研究[J].浙江医学,2014,36(9):742-746.
[8] 徐燕,荣语媚,刘小保,等.细梗香草总皂苷的抗肿瘤活性研究[J].中国药理学通,2012,28(4):545-549.doi:10.3969/j.issn.1001-1978.2012.04.024.
[9] Wang D,Wang Z,Tian Y,et al.Two hour exposure to sodium butyrate sensitizes bladder cancer to anticancer drugs[J].Int J Urol,2008,15(5):435-441.doi:10.1111/j.1442-2042.2008.02025.x.
[10] Zhang Q,Zeng L,Huang K,et al.Pancreatic cancer epidemiology,detection,and management[J].Gastroenterol Res Pract,2016,2016:1-10.doi:10.1155/2016/8962321.
[11] Von Hoff DD,Ervin T,Arena PF,et al.Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine[J].N Engl J Med,2013,369(18):1691-1703.doi:10.1056/NEJMoa-1304369.
[12] Ueno H,Ioka T,Ikeda M,et al.Randomized phase Ⅲ study of gemcitabine plus S-1,S-1 alone,or gemcitabine alone in patients with locally advanced and metastatic pancreatic cancer in Japan and taiwai:GEST study[J].J Clin Oncol,2013,31(13):1640-1648.doi:10.1200/JCO.2012.43.3680.
[13] Altwegg R,Ychou M,Guillaumon V,et al.Second-line therapy for gemcitabine-pretreated advanced or metastatic pancreatic cancer[J].World J Gastroenterol,2012,18(12):1357-1364.doi:10.3748/wjg.v18.i12.1357.
[14] Reni M,Cereda S,Milella M,et al.Maintenance sunitinib or observation in metastatic pancreatic adenocarcinoma:a phase II randomised trial[J].Eur J Cancer,2013,49(17):3609-3615.doi:10.1016/j.ejca.2013.06.041.
[15]LeeHS,ParkSW.Systemicchemotherapyinadvancedpancreatic cancer[J].Gut Iver,2016,10(3):340-347.doi:10.5009/gnl 15465.
[16] Vincent A,Herman J,Goggins AM,et al.Pancreatic cancer[J].Lancet,2011,378(9791):607-620.doi:10.1016/S0140-6736(10)62307-0.
[17] 李峨,陈信义,王玉芝.九种中药活性成分抗耐药肿瘤细胞体外研究[J].北京中医药大学学报,2004,27(2):24-26.doi:10.3321/j.issn:1006-2157.2004.02.008.
[18] Srivastava SK,Bhardwaj A,Singh AP,et al.MicroRNA-345 induces apoptosis in pancreatic cancer cells through potentiation of caspase-dependent and-independent pathways[J].BrJCancer,2015,113(4):660-668.doi:10.1038/bjc.2015.252.
[19] Geisen U,Zenthoefer M,Kalthoff H,et al.Molecular mechanisms by which a fucus vesiculosus extract mediates cell cycle inhibition and cell death in pancreatic cancer cells[J].Mar rugs,2015,13(7):4470-4491.doi:10.3390/md13074470.
[20] Jakubowska K,Guzińska-Ustymowicz K,Pryczynicz A,et al.Reduced expression of caspase-8 and cleaved caspase-3 in pancreatic ductal adenocarcinoma cells[J].Oncol Lett,2016,11(3):1879-1884.doi:10.3892/ol.2016.4125.
[21] 葛建彬,顾锦华,李梅,等.银杏内酯A对小鼠脑缺血/再灌注损伤的保护作用及其抑制NF-κB信号通路下调p53、Caspase-3表达的机制[J].中国药理学通报,2012,28(8):1105-1110.
[22]Germain M,Affar EB,D'Amours D,et al.Cleavage of automodified poly(ADP-ribose)polymerase during apoptosis.Evidence for involvement of caspase-7[J].J Biol Chem,1999,274(40):28379-28384.doi:10.1074/jbc.274.40.28379.

