不同浓度的完全弗氏佐剂影响大鼠疼痛行为的观察
贾欣 代洁琼 乔巧玉 赵欣 王志华 关晓雅 杜振莹 张宇

【摘要】 目的:观察脚掌注射不同浓度完全弗氏佐剂(complete Freunds adjuvant,CFA)产生的不同强度的伤害刺激对大鼠痛感受和痛情绪反应程度的影响。方法:福尔马林诱导的条件性位置回避(conditioned place avoidance,CPA)的行为测试近来被用于评估痛情绪反应。本实验采用另一种炎性致痛物质CFA在大鼠的脚掌皮下注射使之产生持续性炎性痛,诱导大鼠产生条件性位置回避(conditioned place avoidance,C-CPA)反应。根据在大鼠的脚掌皮下注射不同浓度的CFA将大鼠分为正常(Naive)组,生理盐水(NS)组,1/5 CFA组,1/3 CFA组,1/2 CFA组,之后分别检测各组大鼠的热缩足潜伏期(paw withdrawal latency,PWL)和C-CPA反应。结果:1/3 CFA组和1/2 CFA组匹配后热缩足潜伏期与匹配前比较,均明显减小,即痛阈下降,且两组匹配前与匹配后的差值与生理盐水组相比,差异均有统计学意义(P<0.05);1/3 CFA组的下降值小于1/2 CFA组(P<0.05);1/2 CFA组在匹配后痛侧停留的时间明显缩短,且回避分数与生理盐水组比较,差异有统计学意义(P<0.05)。结论:CFA所诱导的PWL反应和CPA反应的程度与CFA的注射浓度有关,从行为上证实大鼠痛情绪与痛感受的产生存在不同的机制。
【关键词】 完全弗氏佐剂; 条件性位置回避; 前扣带皮层; 痛情绪
doi:10.3969/j.issn.1674-4985.2018.29.001
慢性疼痛是一个世界性的医疗难题,它既是与大多数疾病相伴生的临床症状,同时本身也是一种疾病[1]。患者除了遭受疼痛造成的肉体伤害之外,其导致的心理、精神伤害和社会并发症也成了一个重大的负担[2-3]。国际疼痛协会对疼痛的最新定义为“疼痛是一种与组织损伤或潜在的组织损伤相关的感觉、情感、认知和社会维度的痛苦体验”[4]。这一定义将疼痛分为感觉、情感、认知和社会四个维度,其中痛感觉主要感受疼痛刺激的性质、位置、强度等,痛情绪则指伤害性刺激引起的焦虑、恐惧、厌恶等情绪反应[5]。痛情绪可分两个阶段:一是痛不愉快感(feeling of unpleasantness),它是对痛刺激的即时反应,又称原发性不愉快(primary unpleasantness);二是继发性不愉快(secondary unpleasantness),是一种疼痛长期作用引起的情绪反应,它和接受疼痛刺激时所处的环境、疼痛对将来生活的影响、慢性疼痛引发的焦虑恐惧等密切相关,其涉及疼痛、认知、学习记忆等因素,需要大脑的高级中枢对这些信息进行整合[6]。与痛感受相比,介导痛情绪的神经传导通路及其产生的中枢机制大为不同。
研究表明躯体感觉皮质(S1和S2)和岛叶皮层被认为是编码痛感觉,包括性质(刺痛、灼热痛或心绞痛)、定位和强度[7-9]。前额区域和边缘系统(ACC、PFC、杏仁核、VTA和伏隔核)编码情绪和动机反应,并且和痛的情感和联系方面是有关联的[7,10-12]。和临床研究相反,在动物实验中很难去评价痛情绪。最近,各种各样的方法已经被应用评价持续性疼痛,在这些方法中,条件性位置回避(CPA)能够去评价大鼠的痛情绪[13]。在此基础上笔者实验室通过使用自制的CPA装置来检测大鼠的痛情绪,使用不同浓度的完全弗氏佐剂(CFA)作为炎性致痛物质来诱导大鼠产生慢痛反应,以此来观察脚掌注射不同浓度CFA产生的不同强度的伤害刺激对大鼠痛感受和痛情绪反应程度的影响,现报道如下。
1 材料与方法
1.1 实验动物与材料
1.1.1 实验动物与分组 体重250~270 g的成年雄性Sprague-Dawley(SD)大鼠,购于北京海淀兴旺实验动物养殖场。大鼠分笼饲养于动物房,每笼4只,动物房室温维持在(22±1)℃,相对湿度40%~60%,大鼠能够自由进食、进水,昼夜循环光照,各12 h,大鼠領养回来适应1周后进行实验。根据大鼠左侧后脚掌注射不同浓度的CFA/NS,将大鼠分为5组:正常(Naive)组(7只),生理盐水(NS)组(6只),1/5 CFA组(6只),1/3 CFA组(7只),1/2 CFA组(7只)。
1.1.2 实验仪器与试剂 热板刺激仪(life science),条件性位置回避装置(自制),完全弗氏佐剂(CFA,sigma),啮齿类动物固定装置,NeuroMotive软件(USA),ANY-maze软件(USA)。
1.2 实验方法
1.2.1 建立大鼠持续性疼痛模型 配制不同浓度的CFA:CFA原液与0.9%氯化钠注射液分别按照0.25︰1、0.5︰1、1︰1的体积比混合成乳化状态。将大鼠固定于啮齿类动物固定装置上,抽取上述配好的混合液0.08 mL皮下注射于大鼠的左侧后脚掌。同时左侧后脚掌注射0.08 mL的0.9%氯化钠注射液作为对照。
1.2.2 痛行为和痛情绪的检测 (1)检测大鼠对热痛刺激的脚掌回缩潜伏期(PWL)。使用热板刺激仪进行测定,根据实验目的在脚掌注射CFA的前1 d和第2天条件性位置回避(CPA)行为测完后进行。先将大鼠放入热板刺激仪的有机玻璃罩内适应30 min,后取出,将热板升温至50 ℃,再次将大鼠放入有机玻璃罩内,从大鼠脚掌接触热板开始计时,大鼠出现舔后足或抬起即缩足反应时计时停止,此时间即为大鼠脚掌回缩潜伏期(paw withdraw latency,PWL)。每只大鼠测量3次,中间间隔15~20 min,之后取3次的平均值。(2)CPA反应的检测。通过条件性位置回避实验来反映大鼠的痛情绪反应。条件性位置回避的建立与检测:①自制条件性位置回避装置[14-15],在进行条件性位置回避诱导时,随机设置其中一侧为非CFA匹配室即非痛环境,而另一侧则与致痛剂CFA注射进行耦合,称之为CFA匹配室,即痛环境。②CPA的检测:分三天进行,第一天,称重:选取符合体重的SD雄性大鼠(250~270 g),测CPA的基础值(baseline):暗室适应30 min,后放入CPA装置自由活动
10 min,用軟件分析大鼠在两侧的停留时间。第二天:暗室适应30 min,后与非痛环境耦合30 min,左侧后脚掌皮下注射不同浓度的CFA/NS;CFA注射后休息120 min,之后置于暗室适应30 min,再进行痛环境耦合30 min。第三天:同第一天,暗室适应30 min,后放入CPA装置自由活动10 min,用软件分析大鼠在痛环境和非痛环境的停留时间。第三天痛侧停留的时间减去第一天痛侧停留时间即为回避分数,值越大代表回避程度越大,大鼠产生的痛情绪越明显。该方法的流程图见图1。
1.3 统计学处理 采用SPSS 17.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组内比较采用配对t检验,两组间比较采用t检验,符合正态分布的采用单因素方差分析,不符合正态分布的采用非参数检验,用GraphPad Prism 5.0软件绘制统计图。以P<0.05为差异有统计学意义。
2 结果
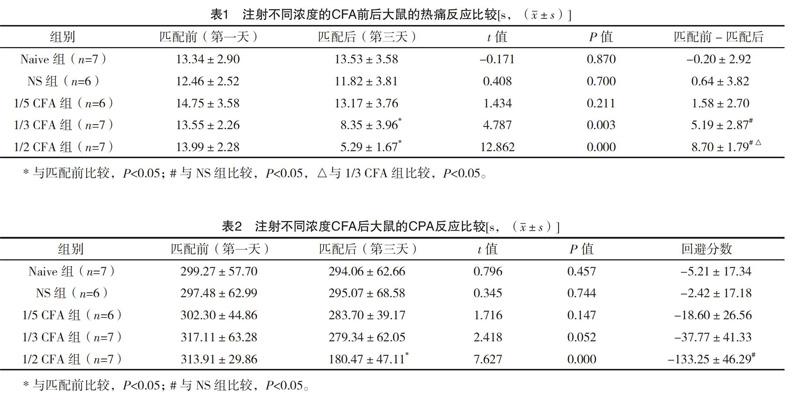
2.1 注射不同浓度的CFA后大鼠的热痛反应比较 Naive组、NS组和1/5CF A组第一天和第三天的脚掌回缩潜伏期比较,差异均无统计学意义(P>0.05),1/3 CFA组和1/2 CFA组第一天与第三天的脚掌回缩潜伏期比较,差异均有统计学意义(P<0.05),且第三天均显著减小,即热痛阈降低。1/3 CFA组和1/2 CFA组匹配前与匹配后的差值与NS组比较,差异均有统计学(P<0.05),且1/3 CFA组下降值明显小于1/2 CFA组,差异有统计学意义(P<0.05)。见图2、表1。
2.2 注射不同浓度的CFA后大鼠的CPA反应 大鼠左侧脚掌注射不同浓度的CFA使得大鼠在痛环境匹配前后痛侧环境的停留时间发生变化,Naive组、NS组、1/5 CFA组和1/3 CFA组匹配前在痛侧环境的停留时间和匹配后的停留时间比较,差异均无统计学意义(P>0.05),1/2 CFA组匹配前在痛侧环境的停留时间和匹配后的停留时间比较,差异有统计学意义(P<0.05),且匹配后在痛侧停留的时间明显缩短。1/2 CFA组的回避分数与NS组比较,差异有统计学意义(P<0.05),Naive组、NS组、1/5 CFA组和1/3 CFA组的回避分数比较,差异无统计学意义(P>0.05)。见表2、图3。
3 讨论
慢性持续性疼痛作为一种对经济、社会产生重大影响的疾病,一直备受关注。长久以来慢性疼痛给患者带来的不仅是难以忍受的疼痛感受,而且还会产生更为严重的影响人们身心健康的负性情绪[16]。Harkines等[17]采用Eysenek and Eysenek问卷法对105个肌筋膜疼痛功能障碍(MPD)患者进行研究,分别观察两种相反的性格对痛感觉、痛情绪的影响,结果显示痛感觉和痛情绪可能存在分离、并行和序次的神经网络通路。上行传导束有两大系统其一是由脑干内测区上行的,经过旧脊丘束、脊髓中脑束、脊髓臂旁-杏仁束、脊髓臂旁-下丘脑束和脊髓下丘脑束,它们主要传递痛情感信息;另一个是位于脑干外侧区的,经过新脊丘束、脊颈束和脊髓背侧柱,主要传递痛的感觉分辨信息[18]。人们对痛感觉的研究在多个方面都取得了进展,但对痛情绪的研究却相对较慢。痛感觉诱发痛情绪有着比较明确的解剖结构基础和共同的物质基础[19]。在此基础上笔者所在实验室通过使用自制的CPA装置来检测大鼠的痛情绪,由于CPA能检测到与痛直接相关的情绪改变,并且没有进一步的伤害性刺激,因此越来越多的研究者认同这一行为学实验方案[15]。实验室前期证实了CFA与NS按照体积比为1︰1混合,皮下注射入大鼠左侧后脚掌后,可以诱导大鼠产生CPA反应,即使大鼠对痛环境产生厌恶,也使得大鼠的痛行为发生改变。因此本实验主要探讨脚掌注射不同浓度CFA产生的不同强度的伤害刺激对大鼠痛感受和痛情绪反应程度的影响。
在实验中,实验者通过给大鼠的左侧后脚掌注射不同浓度的CFA,检测大鼠的热缩足潜伏期及CPA反应。痛感觉检测的结果显示,1/3 CFA组、1/2 CFA组与其他组相比,热痛阈都明显下降,1/2 CFA组的下降值更明显,说明这两个浓度的CFA可以使大鼠对热刺激的敏感性增加;痛情绪结果发现高浓度组即1/2 CFA组与其他组相比,产生了CPA反应,即引起了大鼠的痛情绪反应。1/3 CFA组虽然产生了痛感觉,但其强度不足以引起痛情绪,但更高浓度CFA的作用能同时诱导痛感受和痛情绪的发生。说明痛感受的程度与伤害性刺激的程度相关,痛情绪的强弱也与伤害性刺激的程度有关,而同样的伤害性刺激,痛感受和痛情绪产生的阈值是不同的。这也从另一个角度说明,痛感受和痛情绪反应虽然都来源于同样的伤害性刺激,但它们却是通过不同的传导途径和机制产生的。
致谢:本实验在山西医科大学基础医学院生理学系完成,感谢各位老师和同学们在实验中对我的帮助。
参考文献
[1] Xiao X,Zhang Y Q.A new perspective on the anterior cingulate cortex and affective pain[J].Neuroscience and Biobehavioral Reviews,2018,90:200-211.
[2] Almeida J G D,Braga P E,Neto F L.Chronic Pain and Quality of Life in Schizophrenic Patients[J].Revista Brasileira De Psiquiatria,2013,35(1):13-20.
[3] Gureje O.Comorbidity of pain and anxiety disorders[J].Current psychiatry reports,2008,10(4):318-322.
[4] Williams A C,Craig K D.Updating the definition of pain[J].Pain,2016,157(11):2420.
[5]马洋,秦国华,王锐,等.CFA诱导的大鼠条件位置逃避模型的观察[J].中国医学创新,2017,14(29):5-8.
[6]温存,邵晓梅,方剑乔,等.前扣带皮层PKMζ在慢性痛伴发痛情绪中的作用研究进展[J].中国疼痛医学杂志,2017,23(5):366-370.
[7] Leknes S,Tracey I.A common neurobiology for pain and pleasure[J].Nature Reviews Neuroscience,2008,9(4):314.
[8] Holstege G.The periaqueductal gray controls brainstem emotional motor systems including respiration[J].Prog Brain Res,2014,209:379-405.
[9] Craig A D.A new view of pain as a homeostatic emotion[J].Trends in Neurosciences,2003,26(6):303-307.
[10] Liang M,Mouraux A,Hu L,et al.Primary sensory cortices contain distinguishable spatial patterns of activity for each sense[J].Nature Communications,2013,4(3):1979.
[11] Becker S,Gandhi W,Schweinhardt P.Cerebral interactions of pain and reward and their relevance for chronic pain[J].Neuroscience Letters,2012,520(2):182.
[12] Bushnell M C,?eko M,Low L A.Cognitive and emotional control of pain and its disruption in chronic pain[J].Nature Reviews Neuroscience,2013,14(7):502-11.
[13] Zhang R X,Zhang M,Li A,et al.DAMGO in the central amygdala alleviates the affective dimension of pain in a rat model of inflammatory hyperalgesia[J].Neuroscience,2013,252(16):359-366.
[14]張肖怡,兰坤,冯晓璞,等.痛情绪反应量化方法的探索[J].中国医学创新,2014,11(18):45-48.
[15] Zhang Y,Meng X Z,Li A H,et al.Electroacupuncture alleviates affective pain in an inflammatory pain rat model[J].European Journal of Pain,2012,16(2):170-181.
[16]汪伟伟,刘菊,蒋雪丽,等.不同伤害性刺激致大鼠痛感觉与痛情绪的比较[J].生命科学研究,2014,18(5):411-417.
[17] Harkines S W,Price D D,Braith J.Effects of extraversion and neuroticism on experimental pain,clinical pain,and illness behavior[J].Pain,1989,36(2):209-218.
[18]闫娅霞.杏仁核内μ-阿片受体等介导电针缓解神经痛大鼠痛感觉和情绪成分的研究[D].北京:中国中医科学院,2016.
[19]王佳玲,陈勤,沈醉,等.痛感觉诱发痛情绪的研究现状及针灸干预的可能性[J].浙江中医杂志,2016,51(7):543-545.
(收稿日期:2018-05-07) (本文编辑:张爽)

