MRI 评估进展期直肠癌术前新辅助治疗后T、N 分期准确性的效果分析*
王 雪
(北京市顺义区医院放射科 北京 101300)
直肠癌是消化道常见恶性肿瘤之一, 目前临床多主张进展期直肠癌患者行根治术前应进行辅助放化疗,以降低肿瘤分期,使患者获得更好预后[1]。 弥散加权成像(diffusion weighted imaging,DWI)是目前临床较为成熟的MRI 影像检查技术,而常用的DWI主要是平面回波扩散加权成像(echo-plane diffusion weighted imaging,EPI-DWI),长期以来被推荐为评估直肠癌分期的首选影像学检查方法[2]。 但近年来有报道显示,仅单独采用EPI-DWI 扫描,其结果与手术病理报告结果仍存一定偏差, 一定程度上影响其诊断效能[3]。分段读出平面回波扩散加权成像(readout segmentation of long variable echo-trains diffusion weighted imaging,RESOLVE-DWI) 基于回波平面成像序列,并利用2D 导航回波矫正和分段采样技术提高图像质量,其优势已在头颈部肿瘤、乳腺癌中获得证实[4-5]。DWI 的定量参数即表观弥散系数(apparent diffusion coefficient,ADC)值,独立于磁场强度,可定量反映组织中水分子扩散的快慢。 目前DWI 也逐渐应用于对直肠癌诊断及新辅助化疗疗效监测中[6]。本研究通过回顾性分析60 例进展期直肠癌患者的临床资料,探讨RESOLVE-DWI 技术评估进展期直肠癌术前新辅助治疗后T、N 分期准确性的效果,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2015 年8 月至2017 年8 月本院收治的经盆腔MRI 检查显示有明确病灶并经术前电子肠镜病理结果确诊的60 例进展期直肠癌患者的临床资料。 所有患者均接受术前新辅助放化疗+全直肠系膜切除术,新辅助放化疗结束后4 w 行平面回波扩散加权成像(EPI-DWI)和分段读出平面回波扩散加权成像(RESOLVE-DWI)扫描。60 例患者中男性32 例,女性28 例;年龄(52.37±16.84) 岁; 体 重 指 数 (body mass index,BMI)为(21.07±3.35) kg/m2。
1.2 纳入及排除标准 纳入标准:(1) 入院后行常规MRI 和电子结肠镜检查, 参照第7 版AJCC 肿瘤分期标准[7],并且病理活检证实为进展期直肠癌(T3~4或N+);(2)术前均接受FOLFOX4 化疗+三维适形 放 疗 (three dimensional conformal radiation therapy,3D-CRT);(3)未经治疗的原发直肠癌患者;(4)病历资料完整。 排除标准:(1)术前诊断为非直肠恶性肿瘤者;(2)姑息性手术患者。
1.3 术前新辅助治疗方案 3D-CRT 放疗采用Varian Eclipse 系统勾画放疗计划靶区, 包括直肠及系膜、 淋巴引流区、 骶前及会阴区,6MV-X 射线照射,采用一后两侧野照射,剂量比2:1:1,总照射剂量45~50.4 Gy,1.8~2.0 Gy/次,5 次/w,25~28 次完成。放疗同时开始进行FOLFOX4 化疗:第1 d,静滴奥沙利铂85 mg/m2,2 h 滴完; 第1~2 d, 静滴亚叶酸钙200 mg/m2,2 h 内滴完;第1~2 d,静脉推注5-氟尿嘧啶400 mg/m2,以后持续滴入22 h,600 mg/m2。14 d为1 个周期, 共2 个周期。 术前新辅助治疗结束后6~8 w 接受腹腔镜全直肠系膜切除术。 手术标本经福尔马林固定24 h,沿横轴切开,以肿瘤中心取材,石蜡包埋切片,随后HE 染色,并于显微镜下观察。
1.4 MRI 检查 在术前新辅助治疗结束后第4 w进行MRI 检查,检查前0.5 h 予开塞露塞肛,进行清洁灌肠。 患者检查前12 h 予内禁止行直肠指诊、内镜超声检查(EUS)及肠镜等检查。 MRI 检查时患者取仰卧位,采用德国西门子3.0 T 超导型磁共振成像系统,48 通道相控阵表面线圈扫描, 以横轴面垂直于病灶的长轴为扫描划线标准,分别进行常规DWI 和RESOLVE-DWI 序列扫描, 常规DWI 为平面回波(echo planar imaging,EPI)DWI,即EPI-DWI,序列为矢状位T2WI、 横轴面T1WI 及冠状位T2WI。RESOLVE-DWI 序列扫描横轴面,扫描层面与T2WI序列相同。 两种扫描方法具体参数见表1。 阅片由2名具有5 年以上工作经验的影像科医师进行盲法阅片,利用后处理软件分析RESOLVE-DWI 扫描的图像数据,生成ADC 图后,与T2WI 图像病灶对照,在ADC 图像中,避开坏死区域,选取肠壁结构清晰、病灶实质部分最大的层面, 手工选取感兴趣区(region of interest,ROI),测量ADC 值,选取3 处病灶区域,勾画ROI,测量ADC 后取平均值。 肿瘤分期判断标准参照AJCC 第7 版分期标准[7],T1期:肿瘤侵及黏膜及黏膜下层;T2期:肿瘤侵及肠壁固有肌层;T3期:肿瘤侵及肌层穿入浆膜下, 或侵及无腹膜覆盖的肠旁组织;T4期:肿瘤穿透腹膜脏层或直接侵犯或粘连于周围器官或结构。术后病理N 分期:无淋巴结转移为N0期;N+期为有转移性淋巴结(1~4 枚区域性淋巴结转移为N1期,超过4 枚为N2期)
1.5 ADC 测量 通过软件Body Diffusion Toolbox计算ADC,感兴趣区域参照相应的T2加权像于轴位ADC 图上沿肿瘤边缘面取整个肿瘤组织,由两位放射科医生达成一致意见后取感兴趣区域。 若治疗后无肿瘤残余或肿瘤退缩十分明显, 特别是新辅助治疗后获得病理完全缓解者, 则治疗后的感兴趣区域是以治疗前所选择的区域为对照, 以相应增厚肠壁或正常残留直肠为范围进行绘制。
表1 两种扫描方式参数
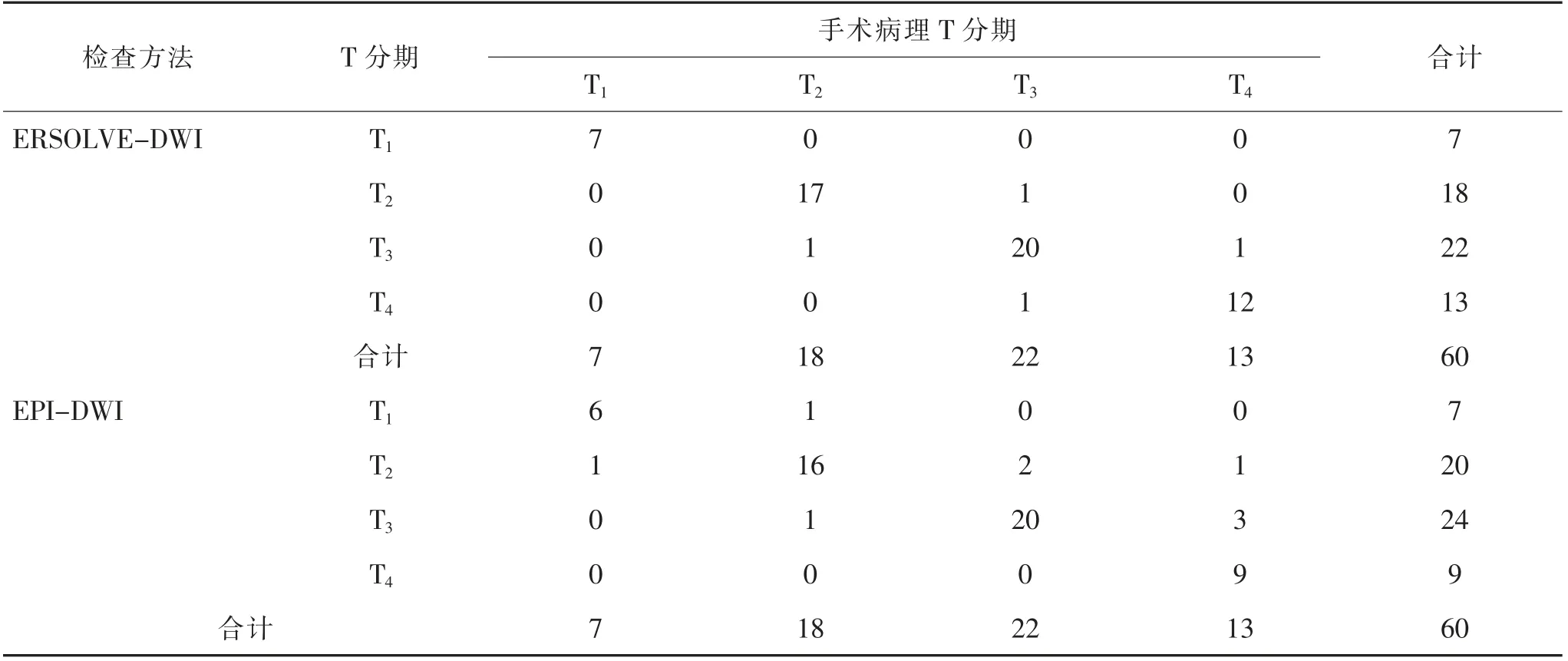
表2 治疗后MRI 检查与手术病理T 分期结果比较
1.6 观察指标 在新辅助治疗后4 w 进行RESOLVE-DWI 和EPI-DWI 扫描,记录肿瘤分期结果,分析其与手术病理结果的一致性。通过比较治疗前和术后病理分期来确定是否降期。 术前分期为T3~4期, 术后T 分期降至T2期及以下的患者为T 降期组,其余为非降期组,并比较两组的ADC 水平,分析ADC 判断肿瘤分期的准确性。
1.7 统计学方法 选用SPSS 19.0 统计学软件对数据进行处理。 计数资料以[n(%)]表示,一致性采用Kappa 检验,以Kappa 值≥0.75 为一致性良好,若Kappa 值<0.4 说明一致性较差[8];计量资料以()表示, 组间比较行t 检验;ADC 判断肿瘤分期的价值采用受试者工作特征曲线 (receiver operation curve,ROC)进行评估,以曲线下面积(AUC)表示。 以P <0.05 为差异有统计学意义。
2 结 果
2.1 治疗后MRI 检查T 分期与术后病理学诊断结果比较 与术后病理诊断结果相比,ERSOLVEDWI 检查评价T 分期有2 例过高分期,2 例过低分期。 T 分期总的准确率为93.33%(56/60)。 Kappa 检验结果显示两者的一致性高度一致,Kappa 值=0.907,P <0.001。 EPI-DWI 检查评价T 分期有7 例过低分期,2 例过高分期。 T 分期总的准确率为85.00%(51/60)。 Kappa 检验结果显示两者的一致性满意, Kappa 值= 0.788,P <0.001,见表2。 各分期的诊断敏感度、特异度、阳性预测值及阴性预测值详见表3。
2.2 治疗后MRI 检查N 分期与手术结果比较ERSOLVE DWI 检查评价N 分期有2 例过低分期,3例过高分期。 N 分期总的准确率为91.67%(55/60)。Kappa 检验结果显示两者的一致性满意,Kappa 值=0.873,P <0.001。 EPI-DWI 检查评价N 分期有5 例过低分期,3 例过高分期。 N 分期总的准确率为86.67%(52/60)。 Kappa 检验结果显示两者的一致性满意,Kappa 值= 0.795,P <0.001,具体见表4。各分期的诊断敏感度、特异度、阳性预测值及阴性预测值详见表5。
2.3 ADC 判断肿瘤分期的准确性比较 非降期组ADC 为(0.95±0.24)×10-3mm2/s,降期组为(1.26±0.31)×10-3mm2/s,两组间ADC 水平比较差异有统计学意义 (t = 4.366,P <0.001)。 RESOLVE-DWI 和EPI-DWI 扫描后所得ADC 判断价值见表6 及图1。
3 讨 论
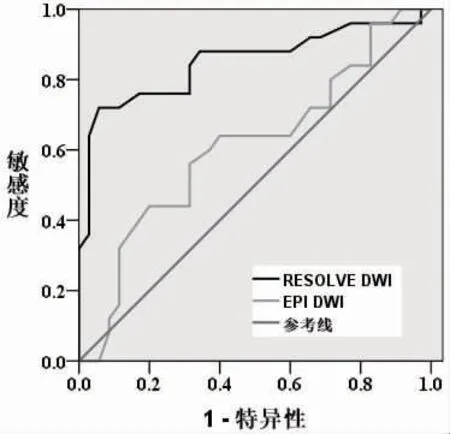
图1 新辅助治疗后MRI 两种扫描方法ADC 参数判断分期的ROC
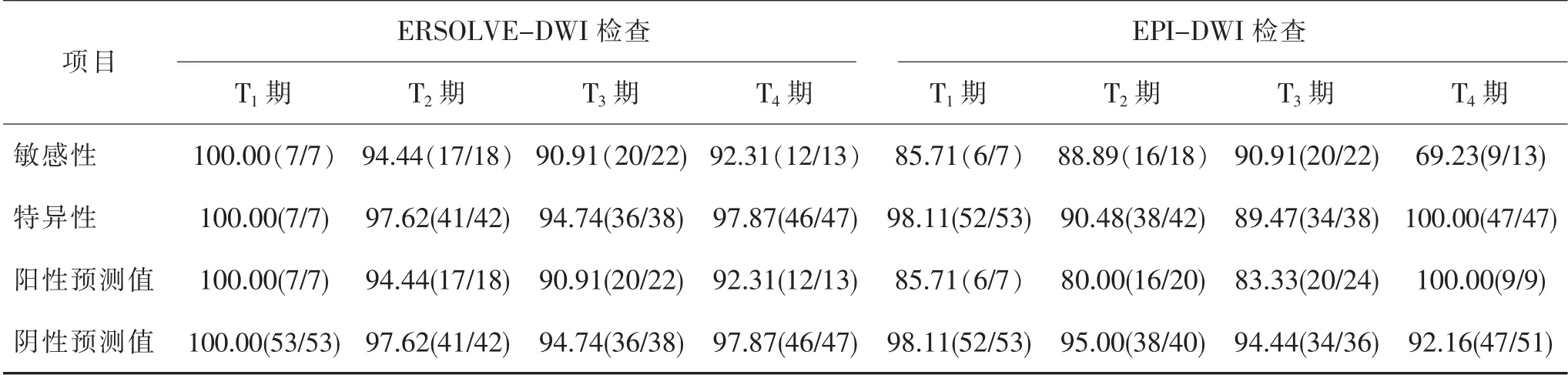
表3 治疗后MRI 检查各期诊断结果[n(%)]
直肠癌术前新辅助治疗可以控制肿瘤进展,降低肿瘤分期, 使部分患者达到临床完全缓解[9],Rasulov 等[10]还认为进展期直肠癌患者术前新辅助治疗可控制微小转移灶,降低术后远处转移风险,进而改善患者预后。 目前,临床提倡个体化治疗,因而术前准确的肿瘤分期对指导手术方案和术后巩固治疗至关重要。 MRI 是目前术前分期诊断重要的影像检查,具有无创、可重复操作的特点,EPI-DWI 成像速度快, 是目前临床常用的成像技术, 但EPI-DWI对磁场均匀性要求高, 近年来相关研究发现,EPIDWI 技术存在磁敏感畸变伪影, 易受自主和不自主运动伪影影响,导致图像模糊,影响成像效果[11],并进一步影响诊断的准确性。
RESOLVE-DWI 成像技术则由于降低了回波间距,提高信噪比和对比噪声比,改善图像质量,降低各种因素造成的伪影,有利于病灶的显示,进而提高图像的分辨率[12]。 本研究一致性检验结果发现RESOLVE-DWI 判断新辅助治疗后肿瘤分期的Kappa 值均超过0.8, 其中判断T 分期的AUC 达0.907,总的诊断准确率达到93.33%,判断N 分期总的准确率为91.67%,提示RESOLVE-DWI 用于评估新辅助治疗效果具有较高的准确性。 此外,RESOLVE-DWI 对T 分期和N 分期诊断的敏感度,除N2期略低于90%外,其余都在90%以上,表明该种诊断方法具有较好的检出病灶的能力。 蔡晓明等[13]研究也发现RESOLVE-DWI 能显著提高图像的对比度和对比噪声比, 且图像对病灶细节和解剖变形的显示均优于常规DWI,与本文结果一致。
T2与T3期是新辅助放化疗后评估肿瘤分期的难点,而肿瘤是否突破固有肌层是T2期与T3期的重要界限[14],ADC 可反映直肠癌组织水分子扩散状态,量化评估肿瘤新生血管生长情况和肿瘤浸润深度[15-16]。 RESOLVE-DWI 与T2WI 显像中肿瘤病灶形态高度吻合, 清晰显现病灶内部组织病变状况及肿瘤边界,从而更加准确勾画ROI,提高ADC 的准确性。本研究显示,与降期组相比,非降期组ADC 值更低,进一步利用ROC 对比分析RESOLVE-DWI 与EPI-DWI 中ADC 判断肿瘤是否突破肿瘤固有肌层,结果显示RESOLVE-DWI 扫描判断的AUC 为0.851,高于EPI-DWI,且特异度在90%以上,表明RESOLVE-DWI 扫描后ADC 值可以较好地判断肿瘤有无突破肿瘤固有肌层。 马晓璐等[17]也认为ADC值与直肠癌肿瘤浸润深度具有显著相关性, 说明RESOLVE-DWI 扫描后计算ADC 值有助于量化评估新辅助放化疗后肿瘤浸润情况, 更好地指导临床治疗。
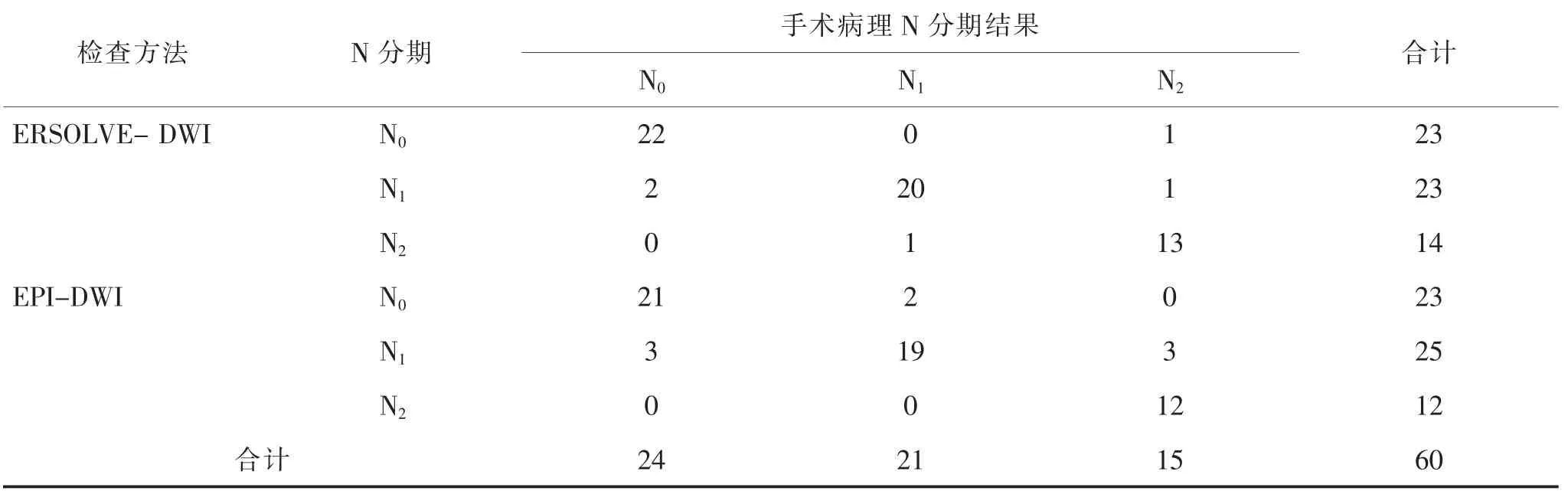
表4 治疗后MRI 检查N 分期与手术结果比较[n(%)]
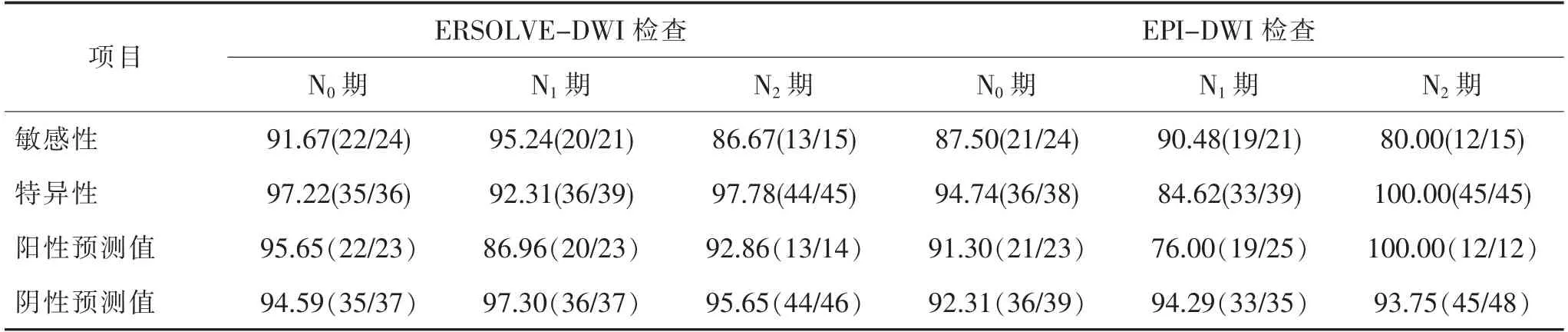
表5 治疗后MRI 检查N 分期各期诊断结果[n (%)]
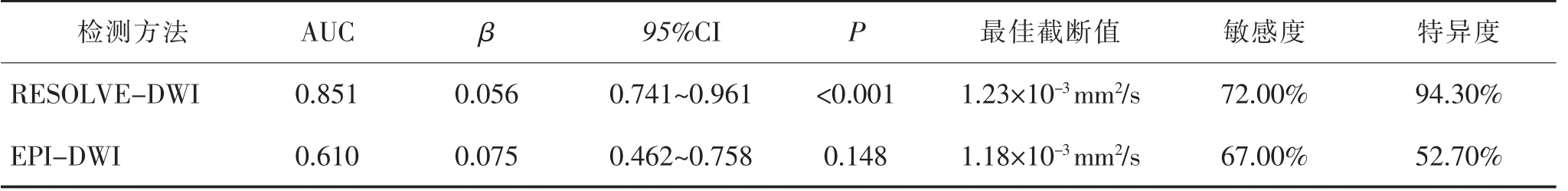
表6 两种方法ADC 值判断分期的ROC 分析结果比较
综上所述,MRI 检查中应用RESOLVE-DWI 成像技术评估进展期直肠癌术前新辅助放化疗后病灶分期的准确性优于常规DWI, 并可量化分析直肠癌肿瘤浸润深度, 可作为评估直肠癌新辅助治疗后肿瘤分期判断的有效影像学检查方法。

