结直肠癌肝转移患者发生肝周淋巴结转移的危险因素分析
陈 兵
(新疆医科大学第一附属医院胃肠肿瘤外科 新疆乌鲁木齐 830054)
结直肠癌(colorectal cancer,CRC)临床常见恶性肿瘤之一[1],其最常见转移部位为肝脏,有10%~25%的CRC 患者在诊断时伴有同时性肝转移, 并且有20%~25%在病程中发展为异时性肝转移[2-3],目前临床上以手术治疗为主。 伴随着化疗与分子靶向药物治疗技术的不断发展,患者5 年总生存率可达25%~58%,但是仍有60%~78%的患者出现结直肠部位或肝转移瘤的复发[4-5]。 还有研究发现,在接受肝切除术的结直肠癌肝转移 (colorectal liver metastases,CRLM) 患者中发生肝周淋巴结转移(perihepatic lymph node micrometastases,PLNM)的比例达到6%~28%[6-7]。 在早期研究中PLNM 被认为是发生肝外转移患者不良预后的危险因素之一, 并且行肝周淋巴结清扫后肝衰竭的比例显著升高, 术后5 年的生存率不超过10%,因此,伴随有PLNM 的CRLM 被认为是手术禁忌症[8-9]。 但是随着手术结合放化疗治疗的发展, 近期研究发现该类患者行肝切除加选择性肝周淋巴结切除术后5 年生存率可以达到13%~21%[10-11]。 本研究旨在探讨发生PLNM 的影响因素,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2014 年4 月至2018年4 月于本院行手术治疗的75 例结直肠癌肝转移患者临床资料。 75 例患者中男性37 例、女性38 例;平均年龄(54.51±6.83)岁;入院时美国东部肿瘤协作组(ECOG)评分:0 分13 例、1 分37 例、2 分25 例;原发疾病部位:结肠33 例、直肠42 例;肝转移瘤手术类型:肝脏射频消融术38 例、肝切除术37 例;合并基础疾病:高血压病20 例、糖尿病7 例、冠心病12 例、肝硬化8 例。 所有患者均签署手术治疗与临床研究知情同意书。
1.2 纳入及排除标准 纳入标准:(1) 年龄≥18岁;(2)ECOG 评分为0~2 分。 排除标准:(1)合并其他部位恶性肿瘤;(2)非初次诊断;(3)临床资料不完整。
1.3 方法 根据患者术中及术后病理结果是否有肝周淋巴结转移分为PLNM 组和无PLNM 组。 收集患者以下临床数据:(1) 年龄、 性别、 体重指数(body mass index,BMI);(2)原发肿瘤特征(原发部位、原发灶直径、浸润深度、神经侵犯、脉管侵犯、WHO 分型、分化程度、RAS 突变状态);(3)肝硬化、除外淋巴结的肝外转移情况、 术前血清癌胚抗原水平、术前是否门静脉栓塞。
1.4 统计学方法 数据采用SPSS 23.0 进行分析。 计量资料采用()表示,采用t 检验比较;计数资料采用[n(%)]表示,采用χ2检验、校正χ2检验或Fisher 确切概率法比较, 并将差异有统计学意义的指标纳入Logistic 多因素回归进行分析。 以P <0.05为差异有统计学意义。
2 结 果
2.1 PLNM 组与无PLNM 组临床病理资料比较两组肝转移程度、 肝转移灶数目差异均有统计学意义(均P <0.05);两组年龄、性别、BMI、原发灶部位、原发灶直径、原发灶浸润深度、有无神经侵犯、有无脉管侵犯、WHO 分型、 分化程度、RAS 突变状态、肝转移灶最大直径、除外淋巴结的肝外转移、术前CEA水平及术前门脉栓塞差异均无统计学意义 (均P >0.05)。 见表1。
2.2 Logistic 多因素回归进行分析 以肝周淋巴结转移设为Y 变量(赋值如下:未发生= 0;发生=1),将肝转移程度及肝转移灶数目纳入多因素分析,将肝转移程度设为X1(赋值如下:H1 = 0;H2 = 1;H3 = 2)、肝转移灶数目设为X2(赋值如下:单发=0,多发= 1)。 结果显示,肝转移程度及肝转移灶数目均为发生PLNM 的独立危险因素 (均P <0.05)。见表2。
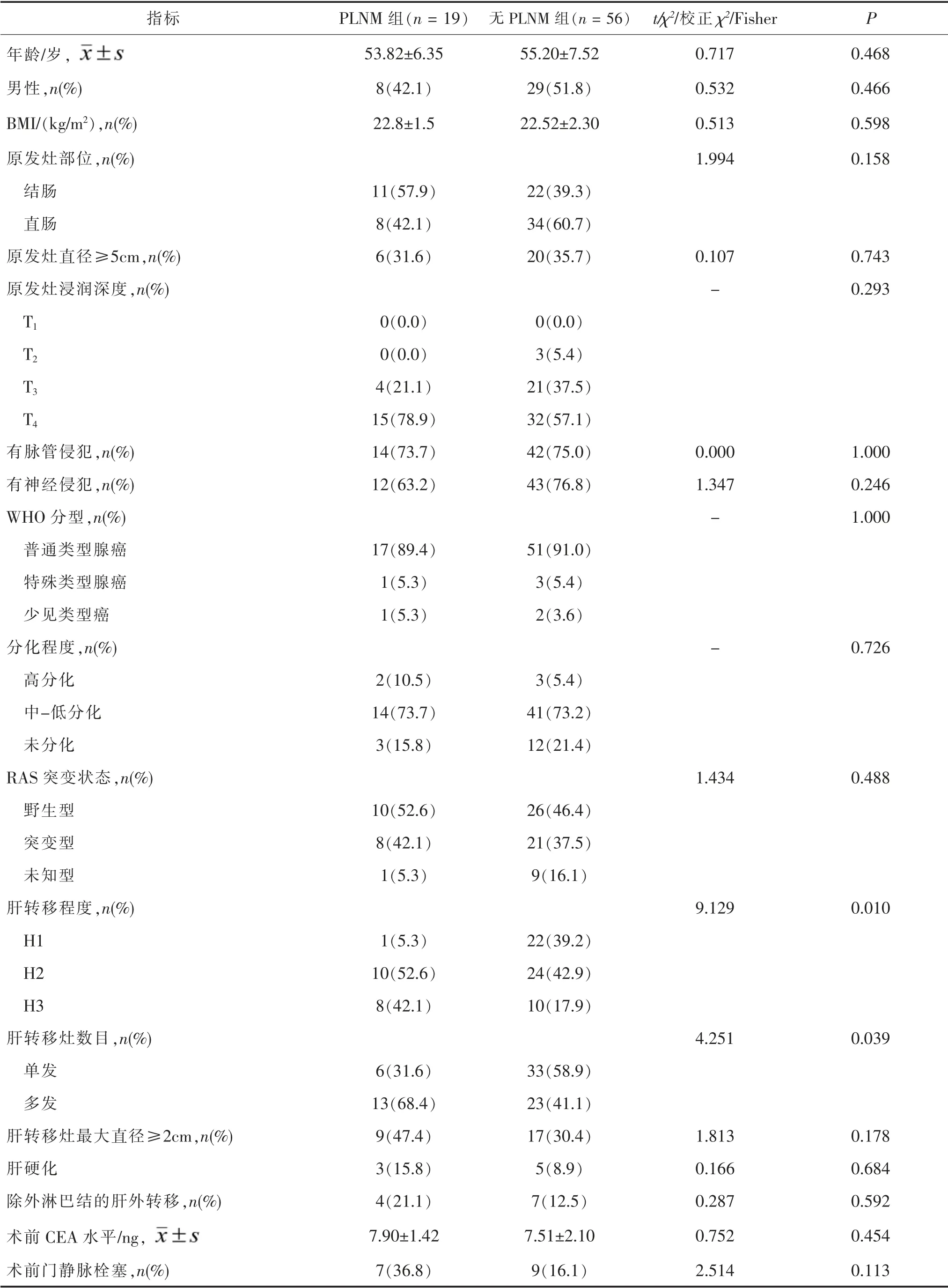
表1 两组一般资料比较
3 讨 论
肝周淋巴结转移(PLNM)是指位于肝十二指肠韧带、肝总动脉、腹腔干和主动脉间隙的转移,被认为是由于肝转移灶本身通过肝周淋巴道的转移扩散所致[12]。 既往大型队列研究显示在肝转移癌和肝癌患者中发生PLNM 的比例为25 %~33 %, 在可切除的患者中为2.2%[13],本研究中发生PLNM 的CRLM患者的比例为25.3%, 进一步表明了在可切除的肝癌或肝转移癌患者中PLNM 的发生率较低。 尽管早期研究认为在可切除的CRLM 患者中, 存在PLNM是不良预后的危险因素之一, 行淋巴结清扫术会改变门静脉周围淋巴引流而出现难治性腹水, 术后5年存活率不超过10%[14],但是近几年有部分研究显示发生PLNM 的CRLM 的患者行肝切除加选择性肝周淋巴结切除术的5 年生存率有所升高, 并且认为选择性淋巴清扫可以取代常规淋巴结清扫对于肿瘤分期的意义, 并且认为即使出现难治性腹水也不会增加死亡率[15-16],因此关于手术的必要性仍存在争议。
目前, 结合术前影像学检查对于疑诊合并PLNM 的CRLM 患者的最佳治疗策略尚未达成共识。CT 影像常通过淋巴结直径来判断有无淋巴结转移, 但是这种评价方法未能准确鉴别炎性肿大还是恶性转移,因此阳性预测值和敏感度均较低[17-18],而判断淋巴结数量、形态、轮廓、强化程度等指标也有一定的主观性。因此有研究者建议用CT 值定量评估肝周淋巴结的转移情况, 可以发现血管增生或坏死导致的不同程度强化, 但是因样本量较小仍需进一步证实该结论[19]。 此外,增强MRI 检查也较容易区分淋巴结与血管和脂肪组织, 在评价肝周淋巴结肿大时具有较高的检出率和敏感度, 且准确率为92%[20]。还有研究认为,PET-CT 检测的阳性预测值为100%[21],但并非所有患者均有条件在术前完善PET-CT 检查。有报道称,合并肝硬化或肝炎的肝原发癌或转移癌患者由于肝脏结构变形引起淋巴阻塞导致淋巴结转移受阻[21-22],伴随有肝炎或肝硬化的CRLM 患者发生PLNM 的发生率要低于非肝炎或肝硬化患者[23],但是本研究中PLNM 的发生率在是否伴随肝硬化的患者中无差异,这可能是因为本研究样本量受限。
既往研究认为发生PLNM 的危险因素包括肝肿瘤转移程度、转移灶发生时间、术前CEA 水平和腹膜转移[6]。 在本研究纳入分析的临床病理参数中显示肝肿瘤转移程度和肝转移灶数目是CRLM 患者发生PLNM 的独立危险因素。既往研究报道称,肝周淋巴结转移主要来源于肝脏转移肿瘤, 与结直肠的原发肿瘤以及肝外肿瘤转移程度无关[13]。 肝肿瘤转移程度与肝转移灶数目与预后有关, Zhou 等[24]的研究认为影响肝转移的R0 切除和预后的最重要因素是肝转移的数量, 当转移灶数≥4 时转移瘤的双叶分布与预后不良有关。 而肝转移淋巴结的转移多沿淋巴管走行进展,淋巴结转移数目越多预后越差,且预后也与淋巴结被膜外的侵犯有关[25]。
综上所述,肝转移程度和肝转移灶数目是CRLM患者发生PLNM 的独立危险因素, 但本研究基于单中心回顾性研究来源且样本量受限, 仍需进一步研究证实该结论。
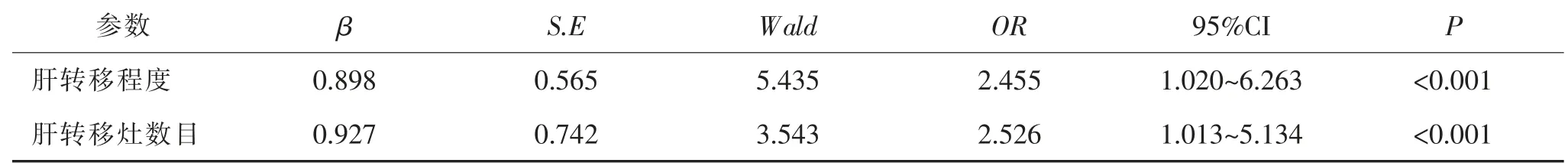
表2 发生肝周淋巴结转移相关因素的多变量回归分析结果

