新辅助化疗干预后中低位直肠癌患者行腹腔镜TME 的手术时机选择探讨*
高本岭 杨向东 宋 雪
(1 苍溪县中医医院普外科 四川广元 628400;2 延安大学附属医院胃肠外科 陕西延安 716000)
直肠癌是消化道常见恶性肿瘤之一, 且以中低位直肠癌为主,随着多学科综合治疗理念的发展,新辅助放化疗联合根治性手术已成为进展期中低位直肠癌主要治疗模式[1-2]。 既往报道指出,恶性肿瘤对放化疗反应具有时间依赖性, 接受放化疗干预后需间隔一定时间才能发挥最大疗效, 但目前临床对新辅助放化疗后手术时间的选择仍存在争议[3-5]。 本研究回顾性分析本院120 例行腹腔镜全直肠系膜切除术(total mesorectal excision,TME)的中低位直肠癌患者临床病历资料, 比较新辅助放化疗至手术不同间隔时间患者的安全性和临床预后, 以期为放化疗后合理选择手术时间提供参考,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2012 年7 月至2014年7 月苍溪县中医医院普外科120 例行腹腔镜TME 术的中低位直肠癌患者临床资料,所有患者术前均接受FOLFOX 化疗和三维适形放疗。 其中男性78 例,女性42 例;年龄(45.74±12.26)岁;入院时临床分期: Ⅱ期59 例, Ⅲ期61 例; 肿瘤距肛缘距离(6.81±2.27) cm。 本研究经医院伦理委员会批准,患者对治疗情况均知情并签署知情同意书。
1.2 纳入与排除标准 (1)新辅助放化疗前经病理、MRI 等检查,并参照AJCC 第7 版标准[6]诊断为Ⅱ~Ⅲ期直肠癌;(2) 肿瘤下缘距肛门距离≤10 cm;(3)病历资料完整。排除标准:(1)合并有其他原发性恶性肿瘤者;(2)肝肾功能严重不全或合并有严重免疫系统疾病者;(3)病历资料缺失者。
1.3 研究方法 根据放化疗完成后至直肠癌手术间隔时间不同分为早期组 (放化疗后6~8 w,38例)、中期组(放化疗后9~11 w,42 例)及晚期组(放化疗完成12~14 w,40 例)。 比较三组患者基本资料(性别、年龄、入院时和术后肿瘤分期、肿瘤距肛缘距离)、围术期指标(手术时间、术中出血量、淋巴结清扫数目、术后首次肛门排气时间、住院期间术后并发症) 及术后3 年生存情况(无进展生存率和总生存率)。 随访以电话联合和入院复诊相结合的方式进行,每2 w 电话联系1 次,记录患者全身状况,每3~6 个月入院复诊1 次, 随访期间发现有疑似复发症状体征时应尽早入院,行影像学检查。将术后肿瘤发生局部复发或远处转移定义为肿瘤进展[7],以手术结束至肿瘤进展时间为无进展生存时间。 术后病理检查记录完全缓解率 (pathological complete response,pCR),在原发肿瘤病灶区域及邻近淋巴结取标本,切片病理检查,以无肿瘤细胞残余定义为pCR[8],以肿瘤细胞浸润最深处距手术环状切面间的最短距离≤1 mm 为环周切缘阳性[9], 绘制pCR 概率折线图,分析开展根治性手术的最佳手术时间。
1.4 统计学方法 选用SPSS 19.0 统计学软件对数据进行处理。 计量资料以()表示,多组间比较采用重复测量的方差分析;计数资料以(%)表示,组间比较行χ2检验; 术后生存情况采用Kaplan-Meier 曲线描述,组间比较行Log-rank χ2检验。 以P<0.05 为差异有统计学意义。
2 结 果
2.1 三组基本资料比较 三组患者性别、 年龄、入院时肿瘤分期及肿瘤距肛缘距离比较, 差异均无统计学意义(均P >0.05),三组术后肿瘤标本病理分期比较,差异有统计学意义(P <0.05),其中早期组与中、晚期组术后肿瘤分期进行两两比较,差异均有统计学意义 (χ2= 6.217、6.226,P = 0.045、0.044)。见表1。
2.2 三组围术期指标比较 早期组环周切缘阴性27 例,阴性率71.05%(27/38),中期组环周切缘阴性39 例,阴性率92.86%(39/42),晚期组环周切缘阴性33 例,阴性率82.50%(33/40)。三组环周切缘阴性率差异显著(χ2= 6.570,P = 0.037),其中早、中期组患者环周切缘阴性率差异有统计学意义(χ2= 6.570,P = 0.010)。三组手术时间、术中出血量、淋巴结清扫数目、 术后肛门排气时间及术后并发症总发生率差异均无统计学意义(均P >0.05)。 见表2。
2.3 三组术后生存情况比较 三组均无失访病例, 早期组术后3 年无进展生存22 例, 总生存24例, 中期组术后3 年无进展生存35 例, 总生存36例, 晚期组术后3 年无进展生存28 例, 总生存30例, 三组术后3 年无进展生存率差异有统计学意义(Log-rank χ2= 6.611,P = 0.037), 三组术后3 年总生存率差异无统计学意义(Log-rank χ2= 5.763,P =0.056)。 见图1、图2。
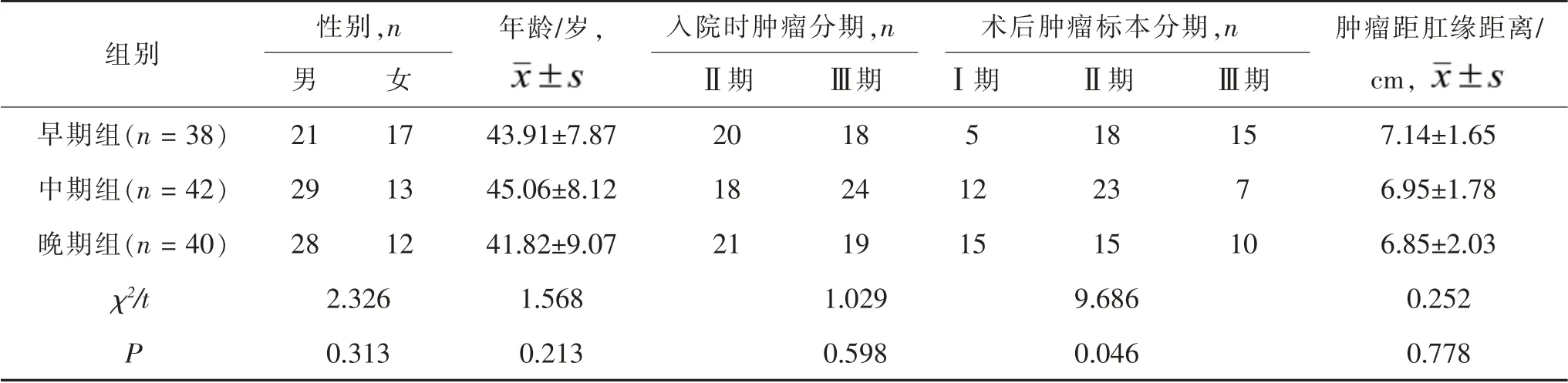
表1 三组基本资料比较

表2 三组围术期指标比较

图1 三组术后无进展生存函数比较
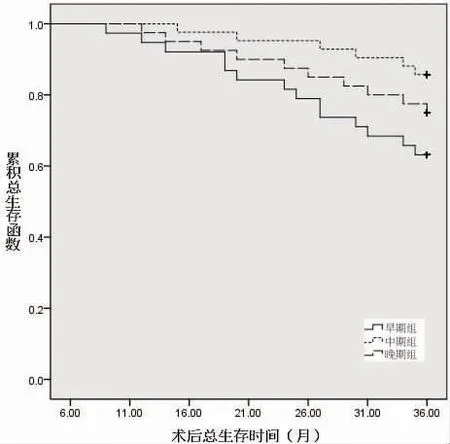
图2 三组术后总生存函数比较
2.4 最佳手术时间分析 新辅助放化疗完成后不同时间手术患者pCR 率分布见表3。 据此绘制pCR 率折线图,可见在新辅助放化疗完成后第10 w进行手术则pCR 率达到峰值,见图3。
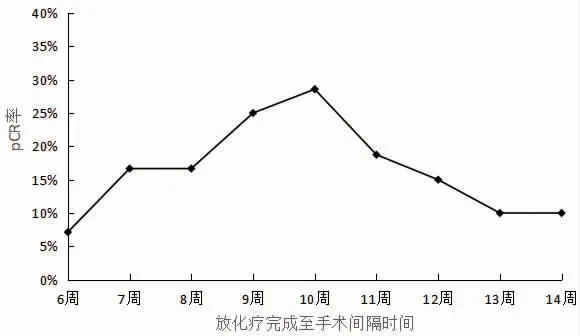
图3 新辅助放化疗后pCR 概率曲线分析
3 讨 论
新辅助放化疗联合直肠癌根治术可提高肿瘤控制率, 对延长患者术后无进展生存时间及改善预后具有重要意义, 已被指南推荐为进展期直肠癌的标准治疗方案[10]。 但目前临床对放化疗至手术间隔时间存在争议,多认为应在放化疗后早期开展手术,有报道显示在放化疗后6 w 内进行根治性手术可使肿瘤缓解率达60%[11-12], 且早期开展可避免放化疗所致的盆腔组织纤维化,防止增加手术难度。但刘德军等[13]报道发现延迟手术并不显著增加手术难度,且在放化疗结束后≥7 w 手术有助于降低肿瘤临床分期及获得较高的R0 切除率。
既往研究显示, 放化疗完成后6~8 w 进行手术可增加保肛率,且手术具有较高的安全性,有研究还将6~8 w 作为中低位直肠癌新辅助化疗与根治性手术的标准间隔时间[14-16]。 本研究据此将手术时间分为早、中、晚三期,结果显示三组手术时间、术中出血量、淋巴结清扫数目、术后肛门排气时间及术后并发症发生率差异均无统计学意义, 说明不同时期开展根治性手术对手术难度并无影响, 且患者术后恢复效果亦无差异。 肿瘤切缘性质是影响患者术后复发和无进展生存时间的独立影响因素[17],本研究显示中期组肿瘤切缘阴性率较高, 这可能是因有所延长手术间隔时间后, 新辅助放化疗可发挥最佳抗肿瘤作用,使肿瘤萎缩,从而降低肿瘤临床分期,提高环周切缘阴性率。 马磊等[18]研究还发现在新辅助放化疗后9~11 w 进行直肠癌根治性手术, 可显著降低CEA、CA-199 及CA125 等肿瘤标记物水平,遏制肿瘤进展,使患者获得更好预后。本研究结果也显示三组术后3 年无进展生存时间差异有统计学意义,提示不同程度延长手术间隔时间对预后有影响。
pCR 指直肠及周围淋巴结均无癌细胞状态,是评估放化疗效果和判断预后的重要临床指标[19],本研究对放化疗完成后各周内开展手术患者的pCR 率进行比较,发现放化疗后10 w 时接受根治性手术患者的pCR 为28.57%,达到峰值,提示放化疗后10 w开展根治性手术可能为最佳手术时机, 但本研究样本量小,结论仍有待验证。 另外,曹键等[20]认为手术时机与放化疗效果、手术质量、术者经验等多因素有关,临床应根据患者病情进行个体化选择。
基于本研究,对于进展期中低位直肠癌患者,新辅助放化疗后9~11 w 开展直肠癌腹腔镜TME 术可观察到较高的术后3 年无进展生存获益, 在放化疗后第10 w 进行手术可获得较高的pCR 率。
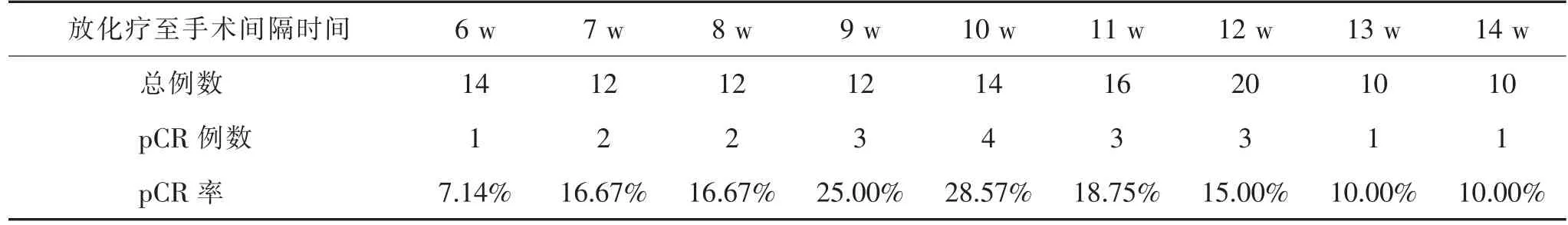
表3 新辅助放化疗后不同时间手术患者pCR 率分布

