银杏叶提取物对对乙酰氨基酚诱导的小鼠急性肝损伤的保护作用*
张全书, 王翔鹏, 谢燕妮, 武璐璐,2, 刘 红△
(1. 湖北民族学院医学院, 恩施 445000; 2. 风湿疾病发生与干预湖北省重点实验室, 湖北 恩施 445000)
对乙酰氨基酚(paracetamol ,APAP)是临床最常用的解热镇痛药,也是临床引起肝毒性的最常见的药物。过量摄入APAP所产生的肝脏毒性与肝细胞中线粒体的功能障碍、自由基代谢产物激增及氧化应激反应等联系密切[1,2]。APAP诱导的动物模型是临床中研究APAP肝损伤的重要方法。
银杏叶提取物(ginkgo biloba extract, GBE)是新型标准化中药制剂,其主要成分为总黄酮醇苷和萜类内酯,可直接清除自由基,减轻氧自由基和脂质过氧化损伤,能够通过Nrf2/ HO-1通路诱导药物代谢二相酶(HO-1、谷胱甘肽-S-转移酶、醌氧化还原酶等)抵抗药物的毒性[3,4,5]。研究发现GBE对由内毒素、酒精和缺血/再灌注导致的肝损伤均有保护作用[5-8]。许多天然提取物对APAP肝毒性具有对抗作用,但尚未报道GBE对APAP诱导的肝损伤具有保护作用。基于此,本实验拟探究GBE对APAP诱导的小鼠急性肝损伤的保护作用及其机制,为开发APAP的临床解毒剂提供依据。
1 材料与方法
1.1 试剂
银杏叶提取物片(德国威玛舒培博士药厂);对乙酰氨基酚(APAP,美国Sigma公司);谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)、髓过氧化物酶(myeloperoxidase,MPO)、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所);肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白介素6(interleukin-6,IL-6)试剂盒(杭州联科生物技术有限公司);BCA蛋白浓度测定试剂盒和ECL发光液(上海碧云天生物技术研究所);转录NF-E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)、血红素氧合酶(heme oxygenase 1,HO-1)抗体及内参照β-actin蛋白抗体(美国Cell Signaling公司)。
1.2 仪器
精密电子天平(上海舜宇恒平科学仪器有限责任公司);低温冷冻离心机(德国Eppendorf公司);全波长酶标仪(美国Thermo公司);电泳及转印系统(北京六一生物科技有限公司)。
1.3 实验动物及取材
健康雄性C57/BL6小鼠30只,体重18~22 g,由北京维通利华生物技术有限公司提供,许可证号:SCXK(京)2012-0001。常规条件饲养,适应性喂养7 d后,随机抽出6只为对照组,剩余的小鼠一次性腹腔注射300 mg/kg的APAP溶液进行造模,再随机将注射过小鼠分为4组,每组6只,分别为模型组、GBE低剂量组(50 mg/kg)、GBE中剂量组(100 mg/kg)和GBE高剂量组(200 mg/kg)。银杏叶提取物片研磨溶于生理盐水中,各治疗组小鼠以相应浓度药物溶液的0.2 ml灌胃对照组和模型组以0.2 ml生理盐水灌胃,每日两次,给药时间隔为12 h,连续给药2 d。末次给药后禁食不禁水,12 h后进行取材。小鼠摘眼球取血于1.5 ml的 EP管中,离心获取上层上清, -20℃保存,用于炎性因子检测。摘取整个肝脏,经0.9%的生理盐水漂洗后,用滤纸吸干多余液体,切取肝左叶用于病理组织学分析和氧化应激指标检测,其余肝脏装于EP管中,-80℃保存用于Western blot。
1.4 病理组织学
切取部分肝左叶于包埋盒,用4%多聚甲醛固定,乙醇脱水,石蜡包埋,切片机切片,HE染色,封片后光镜下观察病理组织学改变。
1.5 血清ALT、AST活性测定
根据试剂盒提供的操作说明测定血清ALT、AST活性。
1.6 血清炎性因子检测
TNF-α和IL-6均采用ELISA法,根据试剂盒提供的操作说明进行操作。操作完成后30 min内用酶标仪在450 nm、570 nm波长准确读取各孔的吸光值,再根据标准曲线计算出对应样品的浓度。
1.7 肝脏氧化应激指标检测
准确称取肝组织重量,按重量比1∶19加入生理盐水中制备成5%肝匀浆后待测。按照SOD、MPO、GSH、MDA试剂盒提供的操作说明进行操作,根据各自标准曲线计算出结果。
1.8 肝脏匀浆液Western blot检测Nrf2/HO-1水平
从-80℃冰箱取出肝组织,剪碎,置于裂解液收集目的总蛋白,采用BCA法测定蛋白含量,统一浓度,再配SDS-PAGE凝胶,点样15 μl,分离出组织蛋白样本转印至PVDF膜,5%脱脂奶粉室温封闭2 h,分别与Nrf2、HO-1和β-Actin抗体孵育(浓度1∶ 1 000),4℃过夜后洗脱,再次以IgG抗体杂交(浓度1∶10 000);最后采用 ECL 显色液进行化学发光显示电泳条带,用目的蛋白灰度值除以内参β-actin以校正误差,所得结果代表样品的目的蛋白相对含量。
1.9 统计学处理
2 结果
2.1 GBE对肝脏大体形态的影响
模型组与对照组相比,肝脏明显肿大,表面可见大量(点状)坏死灶;经过治疗后,GBE低、中剂量组与模型组相比,肝脏肿大有所改善,表面点状坏死灶减少;GBE高剂量组与模型组相比,肝脏肿大明显改善,表面点状坏死灶明显减少(图1,见彩图页Ⅵ)。
2.2 GBE对肝组织病理变化的影响
HE染色可见,对照组小鼠肝小叶结构及肝索排列正常,无肝细胞水肿、变性、坏死。模型组可见局部肝细胞坏死、肝小叶结构破坏、排列紊乱,肝细胞广泛性水肿,有大量炎细胞浸润。GBE低剂量组肝病变程度较模型组,有较轻的改善,局部仍可见大量炎细胞浸润。GBE中剂量组较模型组,肝小叶结构较完整,但肝小叶中心部仍可见较多肝细胞坏死和炎细胞浸润。GBE高剂量组肝组织结构较模型组,肝细胞排列整齐,形态完好,炎细胞浸润较少,有较大改善(图2,见彩图页Ⅵ)。
2.3 GBE对血清中ALT和AST活性的影响
模型组与对照组相比,血清中ALT和AST活性显著升高(P<0.01);经过治疗后,GBE各剂量组与模型组比较血清中ALT活性显著降低(P<0.01),GBE组与模型组相比血清中AST活性显著降低(P<0.01,表1)。

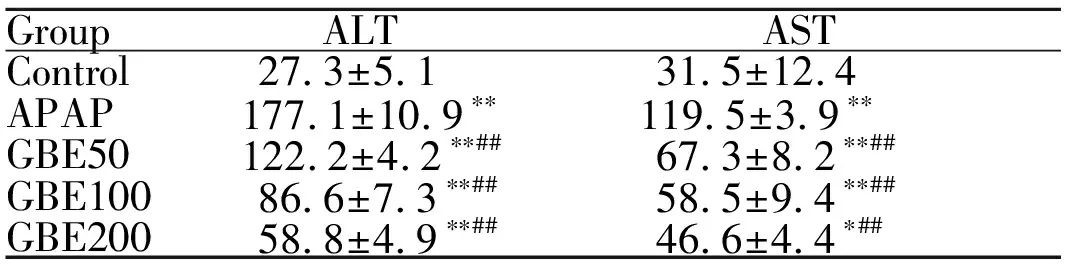
GroupALTASTControl27.3±5.131.5±12.4APAP177.1±10.9∗∗119.5±3.9∗∗GBE50122.2±4.2∗∗##67.3±8.2∗∗##GBE10086.6±7.3∗∗##58.5±9.4∗∗##GBE20058.8±4.9∗∗##46.6±4.4∗##
GBE: Ginkgo biloba extract; APAP: Paracetamol; ALT: Alanine aminotransferase; AST: Aspartate transaminase
*P<0.05,**P<0.01vscontrol group;##P<0.01vsAPAP group
2.4 GBE对血清中TNF-α和IL-6水平的影响
模型组与对照组相比,TNF-α、IL-6的血清含量显著上调(P<0.01);与模型组相比, GBE中、高剂量组的TNF-α的血清含量显著减少(P<0.01);GBE低剂量组的IL-6血清含量减少(P<0.05),GBE中、高剂量组均能显著减少IL-6的血清含量(P<0.01,表2)。

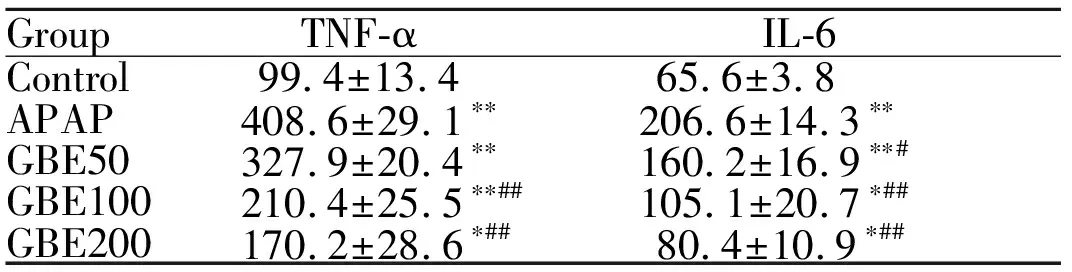
GroupTNF-αIL-6Control99.4±13.465.6±3.8APAP408.6±29.1∗∗206.6±14.3∗∗GBE50327.9±20.4∗∗160.2±16.9∗∗#GBE100210.4±25.5∗∗##105.1±20.7∗##GBE200170.2±28.6∗##80.4±10.9∗##
TNF-α: Tumor necrosis factor-α; IL-6: Interleukin-6
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsAPAP group
2.5 GBE对肝组织中SOD、MPO、MDA、GSH的影响
模型组与对照组相比,肝组织中SOD活性显著降低(P<0.01),MPO活性显著升高(P<0.01), GSH含量显著降低(P<0.01),MDA含量显著增加(P<0.01);经过治疗后, GBE中、高剂量组肝组织中SOD活性显著升高(P<0.01); GBE中、高剂量组肝组织中MPO活性显著降低(P<0.01);GBE低剂量组肝组织中MDA含量降低(P<0.05),GBE中、高剂量组肝组织中MDA含量显著减少(P<0.01);GBE中、高剂量组肝组织中GSH含量显著增加(P<0.01,表3)。


GroupSOD(U/mg pro)MPO(U/g pro)MDA(mmol/mg pro)GSH (mg/g pro)Control119.1±15.10.29±0.034.69±0.794.31±0.77APAP47.7±3.5∗∗1.24±0.12∗∗9.30±2.29∗∗1.62±0.41∗∗GBE5068.9±8.1∗∗1.11±0.09∗∗7.65±0.81∗∗#2.28±0.37∗∗GBE10086.7±7.5∗∗##0.79±0.03∗∗##6.18±0.75∗##3.08±0.68∗#GBE20095.6±10.6##0.52±0.08∗∗##4.81±0.70##3.25±0.89##
SOD: Superoxide dismutase; MPO: Myeloperoxidase; GSH: Glutathione; MDA: Malondialdehyde
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsAPAP group
2.6 GBE对Nrf2/HO-1通路的影响
与对照组相比,模型组小鼠肝组织中Nrf2、HO-1表达水平显著抑制(P<0.01)。与模型组相比,GBE低、中剂量组Nrf2、HO-1表达水平略有增加,GBE高剂量组的Nrf2、HO-1表达水平提高(P<0.05,图3, 表4)。
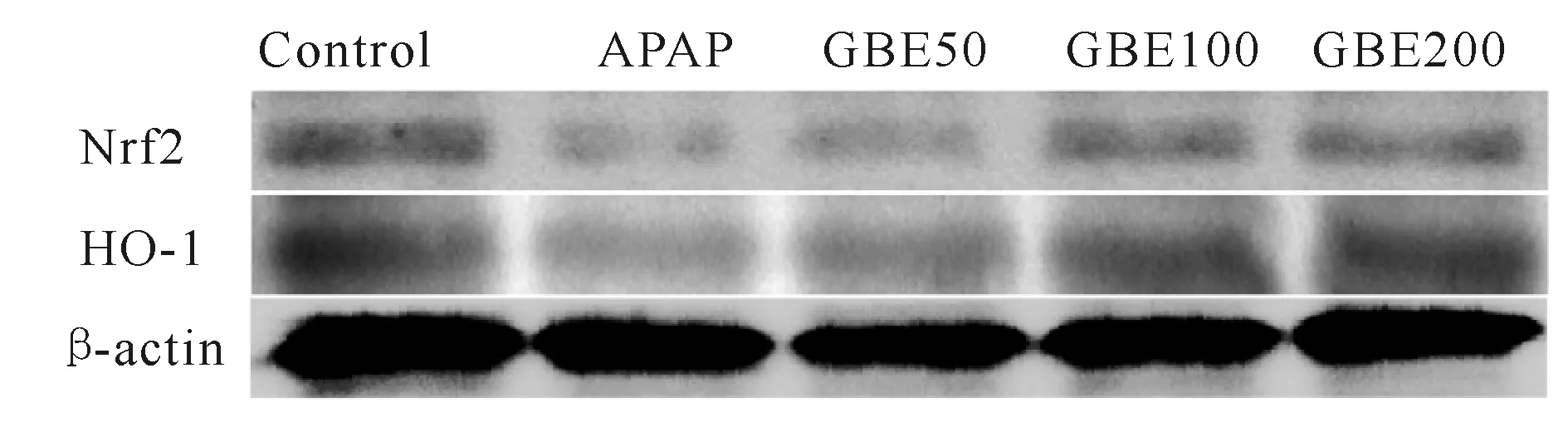
Fig.3Effects of GBE on the pathway of Nrf2/HO-1
Nrf2: Nuclear factor erythroid 2-related factor 2; HO-1: Heme oxygenase 1

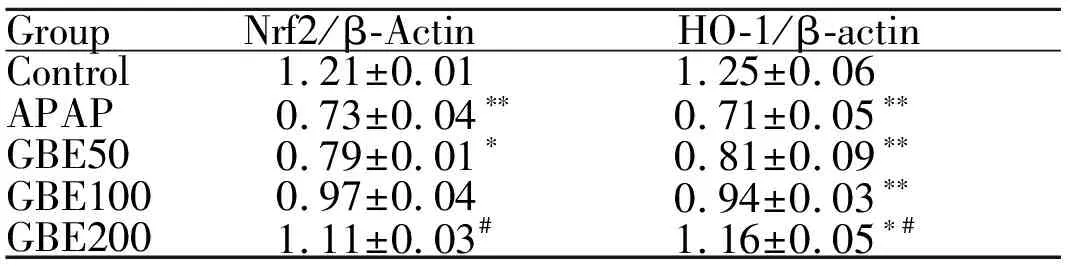
GroupNrf2/β-ActinHO-1/β-actinControl1.21±0.011.25±0.06APAP0.73±0.04∗∗0.71±0.05∗∗GBE500.79±0.01∗0.81±0.09∗∗GBE1000.97±0.040.94±0.03∗∗GBE2001.11±0.03#1.16±0.05∗#
Nrf2: Nuclear factor erythroid 2-related factor 2; HO-1: Heme oxygenase 1
*P<0.05,**P<0.01vscontrol group;#P<0.05vsAPAP group
3 讨论
APAP是临床最常用的解热镇痛药,主要用来减轻感冒给人们造成的头痛发热。过量APAP经吸收后,通过细胞色素P450代谢产生毒性代谢物N-乙酰基-对-苯醌亚胺。虽然GSH可有效清除该毒性代谢物,但胞浆内和线粒体内GSH的大量消耗,会超过GSH的解毒能力,影响线粒体的正常工作,从而导致线粒体膜孔开放和线粒体膜电位崩溃(2~6h),肝细胞受损[9]。炎症反应也会在过量使用APAP的短时间里激活,增加过氧化物的形成,加重肝损伤[10]。这些事件最终导致肝细胞肿胀坏死,引起急性肝损伤。
本研究结果表明,GBE对APAP所致急性肝损伤后的小鼠有一定的保护作用。实验结果表明,GBE高剂量组可明显减少肝脏表面(点状)坏死灶,减轻肝脏充血水肿。组织切片显示,GBE中、高剂量组肝组织形态改善明显,说明GBE能抑制损伤部位炎性细胞的趋化,减轻肝组织水肿。当肝细胞膜受到损害时,ALT、AST被释放进入血液,使血清中ALT和AST 的水平增加[11]。GBE能显著降低血清ALT、AST的水平,说明GBE能使细胞膜防御功能增强,避免肝细胞受损。当APAP的剂量过大时,超过GSH的解毒能力,会发生肝损伤,而GBE能够提高肝组织中GSH的含量,从而增强肝脏的解毒能力,使肝脏损伤减轻[9]。SOD能够有效清除氧自由基,GBE能够提高SOD的活性从而减轻肝细胞损伤。MDA是脂质过氧化物的最终产物,可以严重破坏细胞膜结构,导致细胞肿胀、坏死,是生物体内脂质过氧化程度的良好指示剂,且与APAP所致肝损伤关系密切[12]。经过GBE治疗后,肝组织中MDA含量显著降低,进一步证实GBE的抗氧化作用,能够抑制脂质过氧化反应,对APAP所致的肝损伤有保护作用。
TNF-α、IL-6等炎性因子在APAP诱导的肝损伤中有加剧肝损伤的作用。血清TNF-α、IL-6水平显著升高,会促进NO、组织胺、白三烯等的产生,造成肝细胞坏死,经过GBE治疗后,血清中TNF-α、IL-6的水平显著降低,说明GBE能够抑制炎性反应,阻止APAP诱导的肝损伤的加重[13]。MPO是一种重要的含铁溶酶体,是人体中最重要的氧化应激指标,是中性粒细胞中最重要的氧依赖性酶之一,释放到局部组织或血液,可产生活性氧和活性氮导致氧化应激和氧化性组织损伤[11,14]。GBE能够显著降低肝组织中MPO的活性,进一步证实GBE在APAP诱导的肝损伤中的抗氧化、抗炎作用。
Nrf2 /HO-1 通路在机体氧化损伤保护中有着重要作用,是机体最重要的抗氧化应激机制之一,对药物介导的肝损伤具有保护作用[15]。在正常情况下,Nrf2与其抑制蛋白 Keap1 结合存在于细胞质中,在氧化应激等刺激下,Nrf2与 Keap1解离并易位到细胞核,调控一系列抗氧化基因的转录,比如HO-1、谷胱甘肽-S-转移酶、SOD等,以促进氧化还原反应恢复平衡,减轻自由基损伤[16,17]。本研究表明,APAP诱导急性肝损伤后,经过治疗后,肝组织中Nrf2蛋白表达增加,同时HO-1蛋白表达增强,表明肝组织中Nrf2/HO-1途径激活,Nrf2发生核转位进入胞核,启动了下游抗氧化基因的表达,以对抗过量APAP产生的肝细胞毒性。
综上所述,GBE对APAP所致的小鼠肝损伤具有一定的保护作用,其作用机制可能是GBE能够激活Nrf2 /HO-1通路促进氧化还原反应恢复平衡,抑制大剂量的APAP引起的氧化应激反应,减轻炎性反应,调控SOD、MPO等酶的活性,抑制脂质过氧化反应,修复受损细胞膜,降低肝细胞膜通透性,减少转氨酶的释放,从而起到保护肝脏的作用。

