Beclin-1 shRNA对低氧诱导的SH-SY5Y细胞自噬的影响*
卢 娜, 李成长, 罗晓秋, 杨坤丽
(新乡医学院生理学与神经生物学教研室, 河南 新乡 453003)
RNA干扰(RNAi)是有效沉默或抑制目标基因表达的过程,该过程通过双链RNA(dsRNA)使得目标基因相应的mRNA选择性失活来实现的,目前广泛应用于实验研究[1]。短发夹RNA(RNA-short hairpin RNA,shRNA)作为一种重要的小干扰RNA(small interfering RNA,siRNA),在使用慢病毒作为载体介导shRNA转染时,转染效率高,毒性低,可感染分裂细胞和未分裂细胞,可将基因稳定地整合于宿主细胞的基因组中,且高效稳定的表达,现已广泛用于体内外研究。本实验通过构建干扰Beclin-1表达的慢病毒载体,建立稳定的细胞株,并探索低氧刺激下,shRNA Beclin-1对细胞自噬有何影响,为后续研究低氧激活自噬的信号通路奠定基础。
1 材料与方法
1.1 材料
人神经母细胞瘤SH-SY5Y细胞株由上海中科院典型细胞培养库提供;MEM培养液、F12、Sodium pyruvate、NEAA购于invitrogen;胎牛血清购于美国Hyclone公司;CCK-8试剂盒购自Dojindo;逆转录试剂盒和细胞蛋白提取试剂盒购自Fermentas;RT-PCR试剂盒购自TaKaRa;人抗Beclin-1、LC3B多克隆抗体购自Cell Signalling;Thermo Scientific 三气培养箱、OLYMPUS IX71荧光显微镜、Roche480荧光定量PCR仪、HR40-IIA2生物安全柜。
1.2 SH-SY5Y细胞培养
细胞置于含10%胎牛血清的高糖MEM完全培养基中,培养液中含F12、Gluta-max、Sodium pyruvat、NEAA,在37℃、5% CO2的饱和水气培养箱中培养,每隔48 h换培养液,当单层细胞融合后,行传代处理。
1.3 CCK-8比色法检测细胞存活率
取对数生长期细胞,以2×104个L-1接种于96孔板,每孔细胞悬液100 μl。在37℃、5% CO2的饱和水气培养箱中培养24 h。处理后,每孔加10 μl CCK-8溶液,避光孵育2 h,酶标仪在波长450 nm 处读取吸光度(absorbance,A)值,用8个复孔A值的均数计算存活率。实验重复3次。将对照组的A值表示为A对照,处理各组样本的A 表示为A处理,存活率按下式计算: 存活率=A处理/A对照×100%。本实验对照组的细胞存活率定为100.00%。
1.4 Western blot法检测蛋白表达
收获细胞,4℃预冷的PBS洗1次,加入适量的细胞裂解液,刮下细胞,12 000 g 离心10 min,取上清液。用BCA法测定各组蛋白含量,每孔上样25 μl,经15% SDS-PAGE 80 V电泳2 h后,300 MA恒流转膜40 min,5% 脱脂牛奶常温下封闭1 h后,在 4℃ 孵育一抗(兔抗人Beclin1及LC3B滴度均为1∶3 000);5%脱脂牛奶常温下封闭二抗( 羊抗兔辣根过氧化物酶IgG 和羊抗小鼠辣根过氧化物酶IgG 滴度均为 1∶5 000,5% 脱脂牛奶配制),ECL 显影显示目的条带和内参,用ImageJ软件分析光密度值,代表蛋白表达的相对水平。
1.5 靶向Beclin-1 shRNA慢病毒表达载体制备
1.5.1 根据目的基因设计合成shRNA 根据human Beclin-1的参考序列号NM_003766.4,从NCBI数据库(https://www.ncbi.nlm.nih.gov/)中获取Beclin-1的mRNA序列信息,根据获取的序列信息以及siRNA的设计原则,设计两组不同的shRNA靶序列,并采用scrambler工具准备对应的scrambled control shRNA序列。
1.5.2 构建慢病毒shRNA载体 进行全基因合成后,分别使用无菌水将每条shRNA的两条链按照1∶1的比例混合,进行退火形成双链。将慢病毒shRNA表达载体Lenti-U6-shRNA-GFP使用EcoRI-BamHI进行双酶切,进行琼脂糖凝胶电泳后,回收酶切后的载体,与上述退火后的shRNA片段进行T4 DNA连接酶连接。连接体系如表1:

Tab. 1 shRNA cloning system
将上述T4 DNA连接体系置于16°C连接过夜后,转化至大肠杆菌感受态stbl3细胞中,涂布氨苄抗性的LB平板后,置于37°C过夜培养,第二日挑取单克隆细胞进行小规模摇菌培养,提取质粒DNA后,进行Sanger测序。
1.5.3 Snager测序验证 将小抽的质粒,使用U6启动子通用引物测序,将测序结果与设计的shRNA 标准序列进行比对,确认插入载体中的序列正确后,制备无内毒素质粒。
1.6 慢病毒制备
1.6.1 慢病毒的包装 取15 cm细胞培养皿,接种5×106个293T细胞/皿。将转染试剂LVTransm及慢病毒包装质粒(Lenti-shRNA-GFP、Lenti-packaging Mix)完全混匀后,逐滴加入到15 cm培养皿中,充分混匀,培养6~8 h后,更换为新鲜的完全培养基,继续培养24 h。收集培养皿中含有病毒的培养基上清至一个50 ml离心管中;向培养皿内重新加入25 ml左右新鲜的完全培养基,继续培养24 h;收集培养皿中含有病毒的培养基上清至50 ml离心管中;向培养皿内重新加入25 ml左右新鲜的完全培养基,继续培养24 h;收集培养皿中含有病毒的培养基上清,并与前面收集的两次培养基上清混合。
1.6.2 慢病毒浓缩及纯化 将上述收集的含有慢病毒的培养基上清,用0.45 μm的PES材质滤膜过滤后,转至无菌离心管中,50 000 g 4°C离心2 h。弃上清,加入1 ml PBS缓冲液将沉淀重悬,将病毒置于-80°C保存。
1.6.3 慢病毒滴度测定 将对数生长期的293T细胞以5×106个/孔接种于24孔板,补充培养基至终体积为500 μl,将24孔板置于37°C、5% CO2培养箱中,过夜培养。将浓缩后的慢病毒按照1 μl的量加入至上述24孔板中,同时添加终浓度为6 μg/ml的polybrene。将24孔板重新放回37°C、5% CO2培养箱中,连续培养96 h。培养结束后,使用PBS洗涤每孔的细胞,然后使用Genomic DNA Purification Kit (Lifetech,CAT#K0512)提取基因组DNA,并使用NanoDrop2000测定所提取的基因组DNA的浓度。将pUC-WPRE和pUC-ALB质粒,分别按照10倍稀释,准备荧光定量PCR所需的标准曲线样品。所用引物的序列及荧光基团如表2所示,取96孔PCR反应板,按照每孔加入5 μl基因组样品或标准曲线样品,然后向每孔加入15 μl上述制备的PCR反应预混液,使用封膜密封后,短暂离心1 min,进行PCR反应。

Tab. 2 Probe and primer sequences information table
1.6.4 嘌呤霉素杀伤曲线 按照5×104个细胞/孔的密度将对数生长期的靶细胞SH-SY5Y接种至24孔板中,过夜培养。使用完全培养基制备2X的梯度稀释puromycin,终浓度分别为0.5 μg/ml、1 μg/ml、2 μg/ml、4 μg/ml、8 μg/ml、10 μg/ml、20 μg/ml;从培养箱中取出接种有靶细胞的24孔板,从每孔中吸出250 μl培养基丢弃,然后分别加入250 μl 2×的puromycin。小心混匀后,继续培养。每天观察细胞状态,以在第五日能够完全杀死所有靶细胞的puromycin浓度作为筛选稳定细胞株的浓度。
1.6.5 稳定细胞株筛选 将处于对数生长期的SH-SY5Y,按照5×105个细胞/孔的密度接种至6孔板中,并加入3 ml完全培养基,过夜培养。按照MOI=20,根据接种细胞数以及病毒滴度计算所需的病毒量。将慢病毒加入6孔板中,800 g室温离心1 h;取出孔板,继续培养24 h;然后将孔板中的培养基更换为新鲜的培养基,继续培养24 h;将培养基更换为含有puromycin的培养基,连续培养5 d,直至将所有的未被感染的靶细胞杀死。将剩余的活细胞继续扩大培养,待长至2个10 cm皿时,收集细胞进行冻存,同时保留部分细胞进行realtime qPCR和Western blot验证对靶基因的干扰水平。
1.6.6 稳定细胞株验证 (1) qPCR 分别离心收集1×106个knockdown Beclin-1的细胞和转染Scrambled control shRNA的细胞,用Trizol裂解细胞,提取总RNA。使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit 制备cDNA样品。按照表3配置PCR反应体系,所用qPCR引物序列信息见表4,PCR反应结束后,获取样品Ct值,采用2-ΔΔCt法对结果进行定量。

Tab. 3 Fluorescence quantitative PCR reaction system
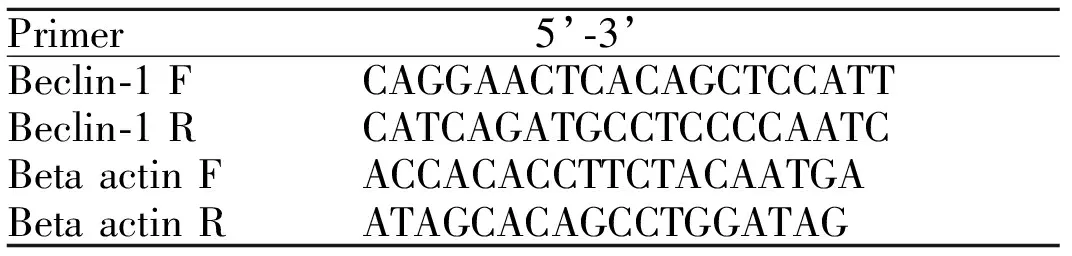
Tab. 4 Fluorescence quantification PCR primer sequences
(2) Western blot 分别离心收集1×106个knockdown Beclin-1的细胞和转染Scrambled control shRNA的细胞,用RIPA裂解液裂解细胞,12 000 g、4°C离心10 min,收集上清。向蛋白上清中加入10×的上样缓冲液,混匀后,100°C煮沸5 min;配置12%的聚丙烯酰胺凝胶,待凝固后,在上样孔中加入30 μg总蛋白,120 V电泳1.5 h;电泳结束后,将凝胶从电泳槽中取出,将分离胶切除,通过半干转印方案将蛋白从聚丙烯酰胺凝胶转移至PVDF膜上。转印结束后,使用5%的BSA室温封闭1 h;使用TBST缓冲液洗涤膜三次,每次10 min;使用TBST将Anti-Beclin-1抗体按照1∶1 000比例稀释后,与PVDF膜共孵育1 h;使用TBST缓冲液洗涤膜三次,每次10 min;使用TBST将HRP标记的二抗按照1∶ 5 000的比例稀释后,与PVDF膜共孵育1 h;使用TBST缓冲液洗涤膜三次,每次10 min;混合化学发光底物的A液和B液,滴加到PVDF膜表面后,进行曝光显影。
1.7 统计学处理
2 结果
2.1 慢病毒感染后SH-SY5Y细胞中GFP的表达
细胞感染慢病毒24 h后,荧光显微镜下观察可见大量绿色荧光颗粒,细胞表达GFP蛋白。与同一视野下明场相比,表达GFP细胞超过80%(图1)。

Fig.1Expression of GFP after lentiviral infection in SH-SY5Y cells (× 100)
2.2 慢病毒有效抑制目的基因Beclin-1的mRNA及蛋白表达
荧光定量RT-PCR检测结果显示,Beclin-1 shRNA 1组Beclin-1mRNA表达(0.096±0.009)明显低于Beclin-1 Scrambled control 1组(P<0.01);Beclin-1 shRNA 2组Beclin-1mRNA表达(0.197±0.021)明显低于Beclin-1 Scrambled control 2组(P<0.01,图2A)。提示慢病毒LV Beclin-1 shRNA1和2均可有效抑制Beclin-1基因的表达。
Western blot结果显示,Beclin-1 shRNA 1组蛋白相对表达水平(0.127±0.017)显著低于Beclin-1 Scrambled control 1组(P<0.01);Beclin-1 shRNA 2组蛋白表达水平(0.156±0.013)显著低于Beclin-1 Scrambled control 2组(P<0.01, 图2B,C)。说明慢病毒LV Beclin-1 shRNA1和2均可有效抑制Beclin-1蛋白的表达。
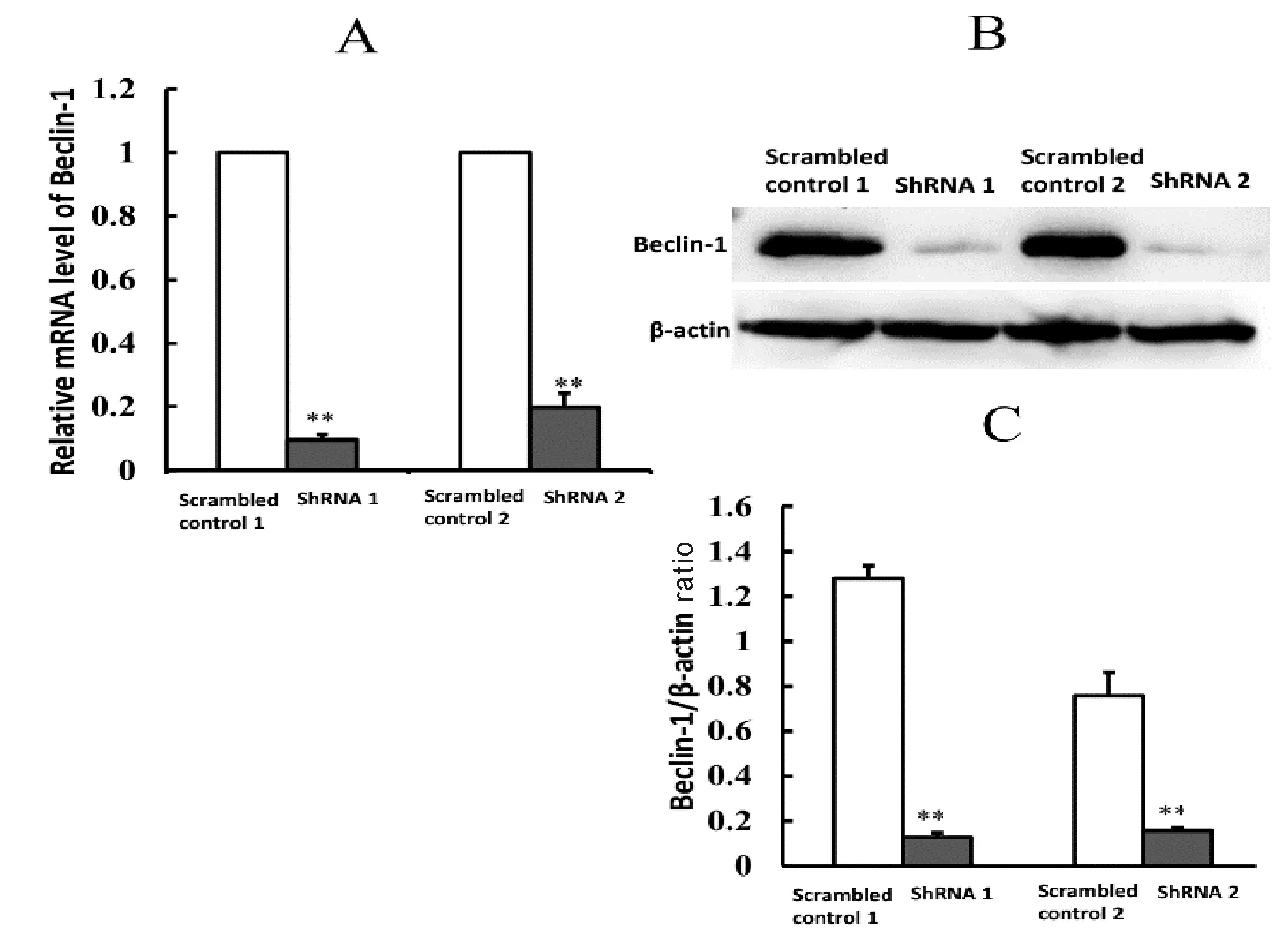
A: The expression of Beclin-1 mRNA by RT-PCR; B: Western blot was used to detect the expression of Beclin-1 protein; C: The expression of Beclin-1 protein
**P<0.01vsscrambled control group
2.3 沉默Beclin-1基因对SH-SY5Y细胞活力的影响
CCK-8法检测结果以空白对照细胞(Blank Control)组存活率为100.0%,则阴性对照细胞(Negative Control),shRNA细胞组存活率分别为 98.6%±3.4%、97.9%±2.7%。Negative Control组、shRNA组与Blank Control组比较差异无统计学意义。
2.4 沉默Beclin-1基因对低氧诱导的SH-SY5Y细胞自噬相关蛋白表达的影响
SH-SY5Y细胞经转染Beclin-1shRNA后, Western blot实验结果显示:(1)BC、NC细胞的5%O2组Beclin-1蛋白的相对表达量分别为1.057± 0.037、1.122±0.032,均明显高于相应的21% O2组(P<0.01);Beclin-1shRNA细胞的5%O2组蛋白相对表达量为0.028±0.003,明显低于NC细胞的5%O2组(P<0.01);(2)BC、NC细胞的5%O2组LC3Ⅱ/LC3Ⅰ比值分别为2.186±0.113、2.762± 0.102,均明显高于相应的21% O2组(P<0.01);Beclin-1shRNA细胞的5%O2组LC3Ⅱ/LC3Ⅰ比值为 0.686±0.048,高于相应的21%O2组(P<0.05)且明显低于NC细胞的5%O2组(P<0.01,图3)。

Fig.3Effect of Beclin-1 shRNA on autophagy-related proteins in SH-SY5Y cells induced by hypoxia (x±s,n=3)
A: Western blot was used to detect the expression of Beclin-1 and LC-3 proteins; B: The expression of Beclin-1 protein; C: The expression of LC-3 protein
*P<0.05 ,**P<0.01vs21%O2group;##P<0.01vs5%O2group of NC
2.5 沉默Beclin-1基因对低氧诱导的SH-SY5Y细胞自噬小体的影响
电镜观察,NC 21%O2组SH-SY5Y细胞胞浆可见丰富的粗面内质网和形态正常的线粒体,少见自噬体出现;NC 5%O2组细胞结构完整,胞浆内出现大量的双层膜囊泡结构,内含细胞器和胞浆成分,即自噬体;Beclin-1shRNA细胞 5%O2组胞浆内出现少量的双层膜囊泡结构。(图4 箭头所指即为自噬小体)

Fig.4Observation of autophagosomes by transmission electron microscopy. Arrows refer to autophagosomes (×1 200)
3 讨论
慢病毒是一种以人类免疫缺陷病毒-1(human immunodeficiency virus-1, HIV-1)为基础构建的新型载体系统,因其对分裂期和非分裂期细胞均有很高的转染效率,广泛应用于基因转染和基因治疗等[2]。shRNA在利用慢病毒为载体时,shRNA可整合到细胞基因组中。shRNA在细胞内通过一系列酶的作用后,通过碱基互补配对,以序列特异性的方式结合到靶mRNA,从而抑制靶基因的表达[3],shRNA在体内抑制靶基因的表达具有很高的特异性[4]。polybrene是一种阳离子聚合物,可以促进慢病毒包膜与细胞膜的相互作用,协助慢病毒对细胞膜的感染过程[5]。本实验在polybrene协助下以MOI=20进行感染,结果证实(图2),Beclin-1 LV shRNA1和2均可有效抑制Beclin-1mRNA和蛋白的表达(P<0.01);但是shRNA2的细胞转染后,收集样品检测发现其对细胞的增殖有影响,因此最终选用shRNA1建立稳定表达的细胞系。
自噬(autophagy)是指细胞在自噬相关基因(autophagy related gene,Atg)的调控下,清除细胞内少量受损的细胞器(如线粒体等)和生物大分子(如蛋白质等),维持细胞内环境自身稳定的一种溶酶体依赖的降解途径[6]。自噬广泛存在于真核细胞中[7],大多数研究证实一定程度自噬的增强对维持细胞内环境稳定意义重大[8, 9],在低氧、饥饿、应激等多种刺激条件下自噬被激活[10]。自噬过程包括自噬的诱导;自噬体组装成形;自噬体的运输、与溶酶体融合;自噬体的降解[11]。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3/Atg8)即是自噬体膜上的标记蛋白。细胞内存在两种形式的LC3蛋白:LC3-Ⅰ和LC3-Ⅱ,LC3蛋白在合成后其C端即被Atg4蛋白酶切割变成 LC3-Ⅰ,LC3-Ⅰ散在分布于细胞浆内。当自噬体形成后,LC3-Ⅰ和磷脂酰乙醇胺(phosphatidylethanolamine, PE)偶联形成 LC3-Ⅱ,并定位于自噬体内膜和外膜,而且LC3-Ⅱ 始终稳定地保留在自噬体膜上直到与溶酶体融合,因此被用来作为自噬体的标记,且LC3-Ⅱ的水平在某种程度上反映了自噬体的数量[12]。
Beclin-1是自噬基因,其为自噬的直接执行者[13]。Beclin-1蛋白除了接受自噬信号,还可接受很多其它信号对自噬进行调节,Beclin-1可能是自噬的“守门人”,成为人工干预自噬活性的靶点[14,15]。低氧是激活自噬的诱因之一[16],Beclin-1介导的自噬途径在低氧诱导的自噬中起着关键的作用,但它并不是调节自噬的唯一通路[17]。本实验通过慢病毒介导Beclin-1 shRNA转染入SH-SY5Y细胞,特异性并长期稳定地抑制SH-SY5Y细胞Beclin-1表达,进一步证实沉默Beclin-1基因对SH-SY5Y细胞的活力无影响;但是可以明显降低5%低氧诱导的自噬(图3、4)。得出结论:Beclin-1在5%低氧诱导的自噬中扮演重要角色。

