不同功率的激光刺激对小鼠C2C12成肌细胞耗氧率水平的影响及机制*
冯 钰, 程泽鹏, 孙 鹏, 史仍飞
(上海体育学院运动科学学院, 上海 200438)
低强度激光疗法在20世纪80年代已经引起了国内外重视,目前在眼科、牙科方面已被广泛使用。随着大众健身的热潮,运动损伤(尤其是骨骼肌损伤)的发生率呈爆发式增加,而对骨骼肌损伤后康复治疗的研究逐渐成为运动医学的热点。对肌细胞的基础研究方面,之前的实验发现低强度激光具有提高肌卫星细胞增殖、加强骨骼肌细胞萎缩及创伤后的恢复、促进肌细胞分化为肌管等作用[1,2]。在激光刺激的剂量方面,SHEFER G等[3]发现0.5 J/cm2的激光剂量会促进肌卫星细胞增殖,这与抗凋亡蛋白Bcl-2的蛋白合成有关[4],而过高剂量的激光会抑制细胞增殖,甚至引起凋亡[5]。
低强度激光会影响线粒体内膜质子转运,对细胞供氧能力有一定影响,进而影响细胞线粒体氧化磷酸化能力。且细胞消耗氧的速率也可以作为评判能量代谢的一种指标。激光作为一种特异性光能源,是否会对细胞代谢产生积极效应仍未有足够的实验证明。已知的研究认为mTOR-PGC1α通路对细胞转录因子有调控作用[6, 7],从而影响细胞氧化磷酸化水平,那么,低强度激光是否对离体肌细胞氧化磷酸化水平有影响,是否影响mTOR-PGC1α通路中信号蛋白表达?本实验旨在探讨不同剂量的650 nm低强度激光对C2C12小鼠成肌细胞氧化磷酸化水平的影响,并对相关合成酶进行检测,为进一步丰富低强度激光对离体细胞氧化磷酸化的影响及其机制提供实验依据。
1 材料与方法
1.1 主要试剂和仪器
DMEM、胎牛血清、青链霉素、胰蛋白酶(Gibco,美国);PBS缓冲液(碧云天生物技术有限公司,中国);BCA蛋白浓度试剂盒、ECL发光液试剂盒(碧云天生物技术有限公司,中国);细胞外耗氧率试剂盒(Luxcel Biosciences,爱尔兰);MyoD一抗、山羊抗兔HRP、PGC-1α一抗、mTOR一抗、p-mTOR一抗、β-actin抗体(CST,美国);一抗稀释液(碧云天生物技术有限公司,中国);Trans-Blot电泳槽、Trans-Blot转膜槽(Bio-Rad,美国);CO2细胞培养箱(Thermo公司,美国);Leica倒置显微镜,酶标仪(CLARIOstar,德国);激光二极管;全自动荧光成像显影仪(Tanon 5200 Multi)。
1.2 小鼠C2C12成肌细胞培养
以体外培养的C2C12小鼠成肌细胞(购于中国科学院细胞库;上海)为实验对象,用含有10%胎牛血清,1%青链霉素的DMEM培养基进行传代培养,置于恒温37℃,含有5% CO2的培养箱中,当细胞在培养皿中生长至80%时,用0.25%胰蛋白酶进行消化,以1∶2比例进行传代培养,将细胞接种至6孔板上,接种密度为4×105个细胞/孔,接种24 h后进行激光刺激。
1.3 激光干预方案
本实验采用输出功率5 mW,波长650 nm的二极管进行激光干预,根据照射剂量不同分为3组,每组6个复孔,C组为对照组,即无激光刺激;L组为低剂量组,激光剂量为0.4 J/cm2(激光刺激时间12.8 min);H组为高剂量组,激光剂量为0.8 J/cm2(激光刺激时间25.6 min)。
1.4 细胞氧化磷酸化水平测定
采用耗氧率试剂盒检测细胞耗氧率水平。将含有氧敏感性的荧光探针加入悬浮细胞中,并加入矿物油隔绝空气与细胞悬液,随着时间变化,细胞悬液中的氧含量会随着氧消耗逐渐减少,荧光信号增加,其荧光寿命斜率即耗氧速率。检测方法:将实验后6孔板中贴壁细胞用PBS清洗两遍,0.25%胰酶消化,制备成为细胞悬液,并进行计数,将细胞接种于96孔板中,每孔加入细胞悬液为150 μl(细胞数为1×106),探针10 μl及矿物油100 μl,放入37℃培养箱孵育1 h,用酶标仪测量耗氧率。
1.5 Western blot法测定蛋白表达量
待激光刺激结束24 h后,用PBS清洗6孔板两遍,每孔加入150 μl裂解液裂解细胞,所有操作保证低温环境。用刮板将裂解好的细胞从6孔板中刮下,放入1.5 ml的eppendorf管中,离心15 min,转速12 000 r/min。取上清,用BCA试剂盒检测细胞总蛋白浓度,确定上样量(25 μg),蛋白质经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)分离(浓缩胶5%,分离胶10%)后,用湿转法将蛋白转到聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉进行封闭1 h后孵育一抗(1∶1 000),4℃过夜,结束后用TBST漂洗3次,孵育二抗(1∶3 000)室温1 h。将孵育好的PVDF膜浸入发光液中,用全自动荧光成像分析系统进行显影,并曝光拍照。使用ImageJ软件分析目标蛋白与内参灰度值,进行统计分析。
1.6 统计学处理
2 结果
2.1 激光刺激对C2C12细胞耗氧率的影响
实验采用耗氧率试剂盒检测细胞氧化磷酸化水平,当细胞与空气隔绝,细胞逐渐消耗培养基中的氧,探针所激发的荧光信号随之增加,荧光寿命曲线斜率越高代表了细胞耗氧率越高[7],图1为各组荧光寿命-时间曲线。与对照组相比,低剂量组耗氧率水平显著增高(P<0.05),而高剂量刺激组则无明显差别(P>0.05,表1)。

Fig.1Fluorescence lifetime curve of each group
2.2 激光刺激对PGC-1α蛋白表达的影响
PGC-1α是线粒体生成的关键调控因子,其对线粒体的合成与表达有关。各组PGC-1α蛋白相对表达量如表1所示,低剂量组和高剂量组PGC-1α蛋白相对表达量均显著增高于对照组(P<0.01),且高剂量刺激组显著低于低剂量刺激组(P<0.05)。

Tab. 1 The analysis of oxygen consumption rate and protein
C: Control group; L: Low dose group; H: High dose group
*P<0.05,**P<0.01vscontrol group;#P<0.05vslow dose group
2.3 激光刺激对p-mTOR/mTOR蛋白表达量的影响
mTOR可以通过转录因子(YY1)-PGC-1α来调控线粒体氧化功能[7],对于细胞生长有重要影响,同时对细胞增殖,蛋白转运也有一定作用。如表1所示,与对照组相比,低剂量组对p-mTOR/mTOR蛋白表达量无显著差异(P>0.05),高剂量组蛋白表达量显著降低(P<0.05, 图2)。
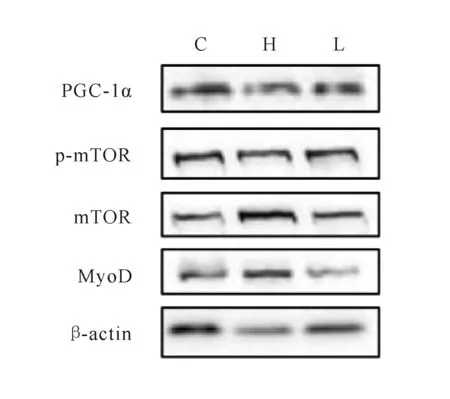
Fig.2Immunoblotting images in mouse C2C12myoblasts by Western blot
C: Control group; L: Low dose group; H: High dose group
2.4 激光刺激对MyoD蛋白表达的影响
MyoD是肌细胞再生的主要调节因子,能促进成肌细胞的增殖及分化。各组C2C12成肌细胞MyoD蛋白相对表达结果如表1,与对照组相比,低剂量组和高剂量组MyoD蛋白相对表达量显著增加(P<0.05,P<0.01),且高剂量组也显著性高于低剂量组(P<0.05)。
3 讨论
激光疗法对在体肌细胞损伤修复功能已被许多文献报道[8],其不仅可以促进肌肉质量增加及减少疤痕产生,也对机体抗氧化能力也有一定增强作用。离体实验证明适量的低强度激光可以促进肌细胞增殖,但对离体细胞分化及线粒体氧化能力的报道较少。
本研究发现,650 nm的低强度激光照射促进小鼠C2C12成肌细胞MyoD蛋白表达,增强细胞分化能力。且两种剂量的低强度激光均可增强MyoD蛋白表达,是否更高剂量的低强度激光刺激会抑制成肌细胞分化能力,还有待进一步研究。MyoD作为骨骼肌细胞形成的重要蛋白被人们熟知[9],对细胞分化有着调控作用[10],之前在体实验中也发现低强度激光可以提高大鼠骨骼肌中MyoD mRNA和蛋白的表达,但对激光剂量要求较高,需3.2 J/cm2及以上[11, 12],本实验中0.4 J/cm2的低强度激光便可影响MyoD蛋白表达,表明离体成肌细胞对激光剂量较在体肌肉组织更为敏感。
我们研究发现适宜剂量的激光照射不仅诱导骨骼肌细胞分化,同时对线粒体氧化功能也有一定促进作用。但过高剂量的激光照射会抑制两种蛋白表达。之前研究发现激光刺激可以促进线粒体相关合成酶的表达,从而增强线粒体活性[13, 14],PGC-1α作为一种细胞核受体转录辅助激活因子和细胞能量代谢辅助激活因子,可以通过控制转录因子如雌激素相关受体(estrogen related receptor,ERR-α)和核呼吸因子(nuclear respiratory factor,NRF)来调控线粒体功能,对细胞氧化磷酸化水平有着重要影响[6, 7]。为进一步探讨不同剂量的激光对成肌细胞线粒体的氧化能力,我们也检测成肌细胞中PGC-1α和p-mTOR/mTOR蛋白,研究结果显示0.4 J/cm2激光照射促进PGC-1α蛋白的表达,而0.8 J/cm2的激光照射抑制成肌细胞PGC-1α蛋白表达的增加,与细胞耗氧率检测结果相吻合。
p-mTOR/mTOR蛋白检测结果显示过高剂量的激光照射会抑制蛋白的表达,但低剂量的激光刺激对其无显著影响,这可能与mTOR功能有关,mTOR属于磷脂酰肌醇激酶相关激酶(phosphatidylinositol 3-kinase-related kinase,PIKK)超家族,是一种丝/苏氨酸蛋白质激酶,具有诱导蛋白质、核糖体合成,调控PGC-1α[15],控制线粒体自噬,影响骨骼肌肥大等多种功能[7, 16],虽然mTOR可以通过YY1-PGC-1α途径来调控转录因子[5-6],但mTOR所调控的通路较为复杂。激光刺激可能不仅影响了mTOR-PGC1α通路,对AKT/mTOR通路也有一定影响[17]。
综上所述,较低剂量(0.4 J/cm2)的650 nm低强度激光增强成肌细胞氧消耗水平,即氧化代谢能力,并对细胞分化有一定影响。其机制可能与适宜的激光刺激影响PGC-1α蛋白的表达,进而影响线粒体氧化呼吸有关。

