HLA-G阳性的胎盘间充质干细胞体外诱导Treg的实验研究*
崔桂玉, 白 剑, 苗兰英, 林大勇, 刘 鸿, 李亚丽, 刘喜成△
(1. 内蒙古民族大学医学院, 通辽 028000; 2. 辽宁中医药大学, 沈阳 110847;3. 深圳市人民医院麻醉科, 广东 深圳 518020; 4. 深圳市麻醉医学工程研究中心, 广东 深圳 518020)
器官移植是治疗器官功能衰竭的有效手段之一,但是排斥反应是制约移植物长期存活的主要障碍。有研究显示,器官移植受者体内调节性T淋巴细胞(regulatory T lymphocyte, Treg)的出现则表明移植物在受者体内产生了免疫耐受,预示着患者术后恢复良好,与对增加移植物的存活时间、减少排斥反应的发生有着重要意义[1-2]。
间充质干细胞是成体干细胞的一种,由于其具有低免疫原性、来源广泛和免疫抑制的特点,目前已经应用于临床治疗和预防移植物抗宿主病[3]。但是,间充质干细胞对机体免疫功能调节虽然十分明确,但是作用效果不强,因此许多研究通过转染CTLA4、IDO和IL-10等基因来增加间充质干细胞的免疫抑制功能[4-6]。人类白细胞抗原-G(Human Leukocyte Antigen, HLA-G)属于非经典的HLAⅠ类分子,在孕妇体内表达较高,其主要功能是诱导母婴耐受,具有明确的免疫抑制作用。有研究显示HLA-G可以诱导Treg的产生,并且促进体内的效应细胞分泌IL-10诱导免疫耐受的形成[7]。因此,本研究在此基础上将胎盘间充质干细胞外源性的转染HLA-G基因,通过将HLA-G阳性的胎盘间充质干细胞与T淋巴细胞混合体外培养,检测HLA-G阳性的胎盘间充质干细胞对T细胞的影响。
1 材料与方法
1.1 材料
RPMI-1640培养基、DMEM/DF12培养基、PBS(Gibco);胎牛血清(杭州四季青公司);CX31倒置显微镜(Olympus);BD FACSCalibur(BD公司);Percoll分离液(GE公司);单克隆抗体CD45-Percp/CD34-PE/HLA-DR-FITC/CD29-PE/CD44-FITC/CD105-APC/CD4-FITC/CD25-PE/Foxp3-APC(BD公司);PEGFP-N1-HLA-G全基因合成质粒(北京奥科鼎盛生物科技有限公司);LipofectamineTM2000(Invitrogen公司);HLA-G特异性单抗4H84和α-Tublin(Santa Cruz公司);CD4+分选试剂盒(Miltenyi公司);二氧化碳培养箱(Thermo Fisher公司); 0.25%胰酶(Sigma公司);实验所用分析纯试剂购自国药集团北京分公司。
足月新生儿胎盘取自于辽宁中医药大学附属医院,取得父母知情同意书后,经本院伦理委员会讨论通过用以制备胎盘间充质干细胞。
1.2 胎盘间充质干细胞的分离培养及鉴定
用75%酒精消毒胎盘表面后,用生理盐水反复冲洗3次。在超净工作台中,用眼科剪刀将胎盘剪成约1~2 mm3大小的碎块,放入50 ml离心管中,用生理盐水冲洗后1 500 r/min离心5 min,。后弃去上清液,使用生理盐水重复上述步骤1次,加入含 0.25%胰酶和0.1%胶原酶Ⅳ的生理盐水30 ml,置37℃培养箱中30 min,使酶能充分发挥活性。用100目的滤网过滤胎盘碎块,用15 ml离心管收集滤液,1 500 r/min离心5 min弃去上清液,在细胞沉淀中加入含10%胎牛血清的DMEM/DF12培养基,充分混匀后转移至培养瓶中,置培养箱中培养。待细胞贴壁生长至融合度90%左右时,用0.25%胰酶消化,将细胞按1∶3接种于新的培养瓶中。当传代细胞进入指数生长期后,消化细胞制备单细胞悬液,调整细胞悬液密度至1×106cells/ml。取200 μl细胞悬液,分别加入CD45-Percp/CD34-PE/HLA-DR-FITC/CD29-PE/CD44-FITC/CD105-APC流式抗体各5 μl,每组设置5个复孔,避光室温孵育20 min后上流式细胞仪检测CD45、CD34、HLA-DR、CD29、CD44和CD105的表达情况。
1.3 实验分组
根据转染情况不同,将胎盘间充质干细胞分为3组:空白对照组为未经转染的胎盘间充质干细胞;PEGFP-N1组为转染PEGFP-N1质粒载体的胎盘间充质干细胞;PEGFP-N1-HLA-G组为转染PEGFP-N1-HLA-G质粒的胎盘间充质干细胞,每组设置5个复孔。将转染后的细胞经过蛋白质免疫印迹鉴定后,分别与T淋巴细胞一起作混合淋巴细胞培养,并检测各组中的Treg含量。
1.4 胎盘间充质干细胞转染HLA-G基因及鉴定
将指数生长期的胎盘间充质干细胞2×105个接种到6孔板内,加入含10%胎牛血清的DMEM/DF12培养基3ml,待细胞生长融合达到约80%进行转染。分别取LipofectamineTM2000试剂1.5 μl与PEGFP-N1-HLA-G或空载体PEGFP-N1各0.5 μg用DMEM/F12稀释到200 μl,将混合后的LipofectamineTM2000室温放置30 min。弃去6孔板内含血清的DMEM/F12培养基并用PBS冲洗细胞2次,每孔中加入1 000 μl无血清DMEM/F12培养基,再将200 μl混有PEGFP-N1-HLA-G或空载体PEGFP-N1的LipofectamineTM2000的DMEM/F12分别滴入6孔板内,在二氧化碳培养箱内孵育4 h后弃去转染液,加入含10%胎牛血清的DMEM/DF12培养基3 ml,在培养箱内继续培养20 h。
收集6孔板中转染后的胎盘间充质干细胞,经蛋白裂解液裂解后,收集到1.5 ml EP管中,煮沸5 min后12 000 r/min离心1 min,弃上清备用。BCA法进行蛋白质定量,在SDS-PAG板上样,电泳分离后电转移至PVDF膜。滴加5%脱脂奶粉4℃封闭过夜。滴加抗HLA-G(1∶1 000稀释)和抗α-tublin(1∶1 000稀释)抗体,4℃孵育过夜后,再滴加二抗37℃孵育30 min。采用凝胶成像分析系统检测各条带的吸光度值,计算蛋白质的相对表达量。
1.5 健康人外周血中CD4+的T淋巴细胞的分离
在50 ml离心管中加入健康人末梢血10 ml,同时加入等体积的Percoll分离液,1 500 r/min离心20 min,吸取液面交界处的有核细胞,并将细胞转移至15 ml离心管中,使用PBS稀释后1 500 r/min离心5 min,弃上清液,再加入10 ml PBS重复离心清洗一次。加入PBS稀释沉淀,并调整有核细胞悬液密度为1×107cells/ml。取150 μl细胞悬液,加入40 μl CD4 MicroBeads混匀,置培养箱中孵育10 min。将LS柱放置于MACS分选架上,用缓冲液冲洗,将孵育好的细胞悬液导入LS柱中,用3 ml缓冲液冲洗一次。CD4+细胞滞留于LS柱中,用缓冲液将LS柱中吸附的CD4+细胞洗脱下来,并用15 ml离心管离心备用。
1.6 各组胎盘间充质干细胞与CD4+T淋巴细胞一起作混合淋巴细胞培养
将分离的CD4+T淋巴细胞计数,按照细胞计数1∶10的比例加入到含HLA-G阳性的胎盘间充质干细胞的6孔板内,同时按照相同的比例将CD4+T淋巴细胞加至空载体组和未经转染的胎盘间充质干细胞的6孔板内,并在上述各组中加入含10%血清的RPMI-1640培养基,培养24 h和48 h后,检测CD4+CD25+Foxp3+Treg占T淋巴细胞的比例。
1.7 统计学处理
2 结果
2.1 胎盘间充质干细胞表面分子的鉴定
通过流式细胞仪检测第二代胎盘间充质干细胞的干细胞标记物,CD45、CD34和HLA-DR呈阴性表达,CD29、CD44和CD105呈阳性表达。其中,CD29阳性表达率为98.1%,CD44阳性表达率为99.3%,CD105阳性表达率为98.9% (图1)
2.2 胎盘间充质干细胞转染HLA-G基因的鉴定
空白对照组中HLA-G蛋白质的相对表达量为PEGFP-N1-HLA-G组的(0.23±0.05)倍,空白对照组与PEGFP-N1-HLA-G组比较,结果有统计学意义(P<0.01);PEGFP-N1组中HLA-G蛋白质的相对表达量为PEGFP-N1-HLA-G组的(0.27±0.03)倍,PEGFP-N1组与PEGFP-N1-HLA-G组相比,结果有统计学意义(P<0.01,图2,表1)。
2.3 HLA-G阳性胎盘间充质干细胞与CD4+T淋巴细胞混合淋巴细胞培养诱导Treg的产生
空白对照组、PEGFP-N1组和PEGFP-N1-HLA-G组肽盘间充质干细胞与CD4+T淋巴细胞混合淋巴细胞培养24 h后,各组Treg细胞占全部T淋巴细胞的比例分别为(11.56±0.52)%、(10.89±0.49)%和(16.41±0.94)%,空白对照组、PEGFP-N1组与PEGFP-N1-HLA-G组相比,统计学有显著性差异(P<0.05);培养48 h后,各组Treg细胞占全部T淋巴细胞的比例分别为(2.22±0.69)%、(2.08±0.38)%和(16.46±0.59)%,空白对照组、PEGFP-N1组与PEGFP-N1-HLA-G组相比有显著统计学差异(P<0.05)。

Fig.1CD45, CD34 and HLA-DR on placenta-derived mesenchymal stem cells were negative; CD29, CD44 and CD105 on placenta-derived mesenchymal stem cells were positive
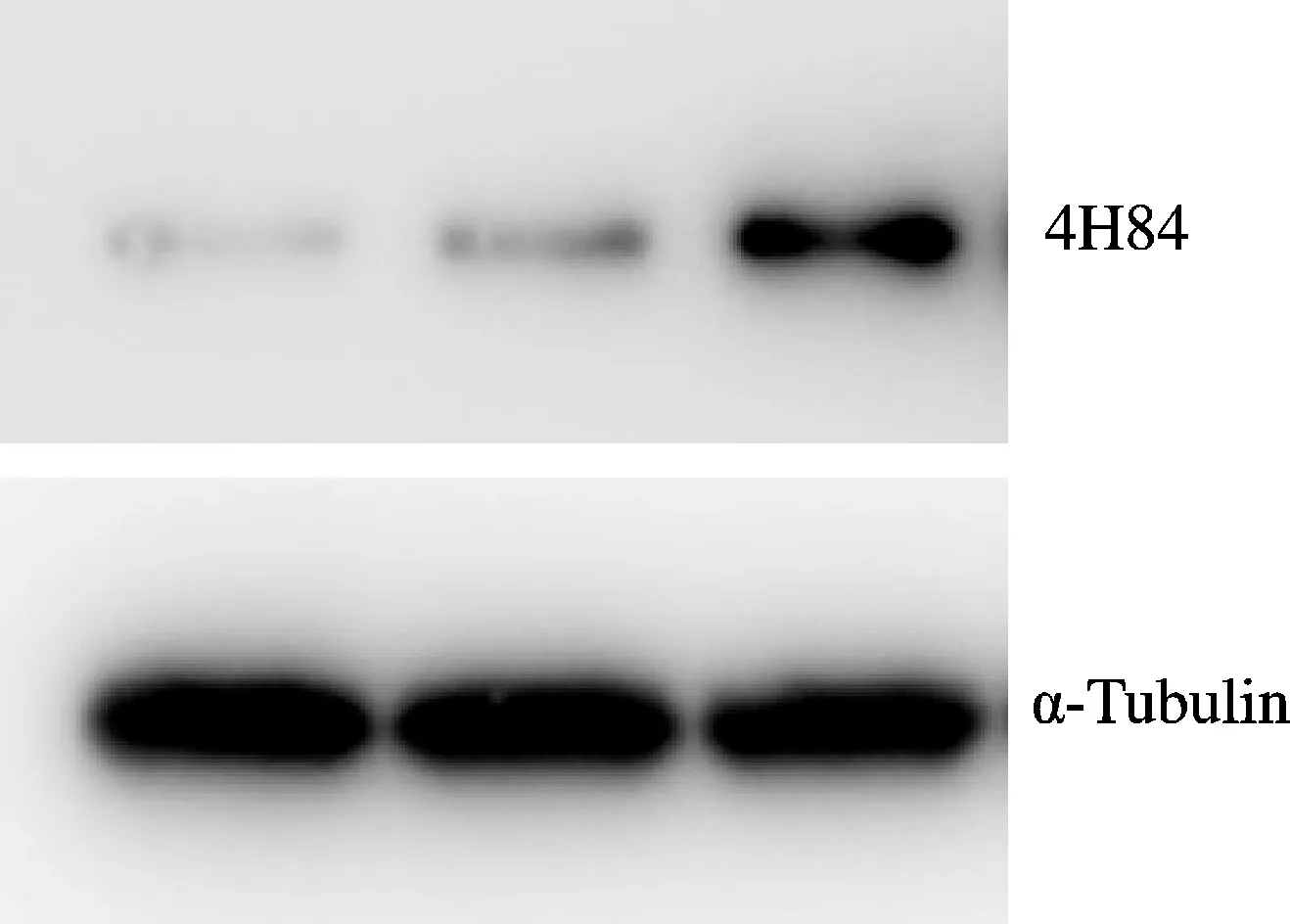
Control PEGFP-N1 PEGFP-N1-HLA-G
Fig.2Expression of HLA-G protein in control group, PEGFP-N1 group and PEGFP-N1-HLA-G group
Tab.1HLA-G expression on placenta-derived mesenchymal stem cells in each group(n=5)

GroupRelative protein expression(%)Control100.00±0.21PEGFP-N1106.29±0.45PEGFP-N1-HLA-G210.35±0.42∗#
*P<0.05vscontrol group;#P<0.05vsPEGFP-N1 group
3 讨论
在移植领域,Treg是临床免疫耐受研究的重点之一,移植受者体内Treg的表达对于受者体内建立的免疫耐受和维持移植物免疫状态起着重要作用。Treg以CD4+CD25+为主要标志物,并特异性表达FoxP3因子,Treg可降低移植受者对外来抗原的反应性、抑制免疫应答的功能。因此,临床上常常把移植受者体内的Treg水平作为衡量移植物存活状态的重要生物标志物[8-10]。
HLA-G是一种非经典MHC-I类抗原,其受体主要有三种:ILT2、ILT4和KIR2DL4。ILT4主要分布在单核细胞和树突状细胞等髓样细胞表面,HLA-G/ILT4相互作用可使树突状细胞分泌IL10从而实现对T淋巴细胞功能的抑制,同时活化的树突状细胞还可以诱导T淋巴细胞分化为CD4+CD25+FoxP3+Treg,还可以诱导T淋巴细胞分化成具有免疫抑制功能的CD3+CD4low或CD3+CD8low的Treg细胞,不表达FoxP3转录因子,并最终形成机体的免疫耐受[11]。若能上调移植受者体内的HLA-G,即可诱导CD4+CD25+FoxP3+Treg的产生,并最终实现受者体内移植物在的免疫耐受[12-13]。
胎盘间充质干细胞由于其来源无伦理学限制,容易获得,且增殖速度快、免疫原性低,目前已广泛用于移植排斥和自身免疫性疾病,是目前最具前景的间充质干细胞之一[14]。胎盘间充质干细胞具有强大的免疫调节功能,同时胎盘间充质干细胞又能被其他基因所修饰而表达相应的蛋白质。因此,本实验选用HLA-G基因修饰胎盘间充质干细胞作为反应细胞,将淋巴细胞作为效应细胞,观察HLA-G阳性的胎盘间充质干细胞在体外诱导CD4+CD25+FoxP3+Treg的效果。结果表明,HLA-G阳性的胎盘间充质干细胞在与T淋巴细胞混合培养24 h后可以有效地诱导CD4+CD25+FoxP3+Treg,其比例占全部T淋巴细胞的(16.41±0.94)%;在混合培养48 h后,CD4+CD25+FoxP3+Treg比例仍然占全部T淋巴细胞的(16.46±0.59)%,而同一时间段的胎盘间充质干细胞诱导CD4+CD25+FoxP3+Treg比例只占全部T淋巴细胞的(2.08±0.38)%。有研究显示[15-16],干细胞可以在体内诱导T淋巴细胞产生CD4+CD25+FoxP3+Treg,Treg产生的时间尚未明确;输入间充质干细胞4周左右,受者体内可以检测出Treg的变化,而在接受骨髓造血干细胞移植的患者体内,间充质干细胞可以诱导骨髓移植受者在2周内产生Treg。但对于体外诱导的报道较少。我室前期研究发现,T淋巴细胞作为体循环中成熟的血细胞,其分化和分裂能力较弱,若按照体内实验的方式,T淋巴细胞与间充质干细胞混合培养2~4周后检测CD4+CD25+FoxP3+Treg的比例,有可能导致T淋巴细胞的大量死亡而无法检测T淋巴细胞的变化。从本实验结果看,HLA-G阳性的胎盘间充质干细胞对于诱导CD4+CD25+FoxP3+Treg的产生与胎盘间充质干细胞相比无差异,但可维持CD4+CD25+FoxP3+Treg的体外存活时间,其作用机制可能与HLA-G蛋白质的生物学活性有关[17]。
综上所述,由于胎盘间充质干细胞本身也具有诱导CD4+CD25+FoxP3+Treg的产生的功能,经过HLA-G基因修饰后胎盘间充质干细胞能够更加有效的在体外诱导CD4+CD25+FoxP3+Treg的产生,具有潜在的临床应用价值。但本实验现仅局限于体外实验,体内试验是否有类似的结果尚待进一步观察。

