千层纸素A改善大鼠慢性心力衰竭的作用及其分子机制
王晶晶,田晨光,张金盈,张继佳,吴照科*
(1河南省人民医院省直第一医院高血压科,郑州 450003;2郑州大学第二附属医院内分秘科,郑州 450014;3郑州大学第一附属医院心血管内科,郑州 450052;4郑州大学第二附属医院老年医学科,郑州 450014)
心力衰竭是指由于心脏的收缩功能和舒张功能发生障碍,不能将静脉回心血量充分排出心脏,导致静脉系统血液淤积,动脉系统血液灌注不足,进而引起心脏循环障碍症候群[1]。心肌重塑涉及心肌细胞的自噬、凋亡、肥大、血管新生及细胞外基质相关改变的多个病理生理过程[2-4]。与此同时,心力衰竭时肾素-血管紧张素-醛固酮系统和交感神经系统兴奋性增高,多种内源性的神经内分泌和细胞因子激活,其长期慢性激活促进了心肌重构,加重了心肌损伤和心功能的恶化,进而过度激活神经内分泌因子分泌,形成恶性循环,加剧了心力衰竭的进展[5]。细胞自噬在心力衰竭中的重要性越来越受到重视,如扩张型心肌病、心瓣膜病和缺血性心脏疾病所导致的心衰均能发现心肌细胞自噬水平出现显著降低,提示心肌自噬不足与心力衰竭的发病密切相关[6]。异丙肾上腺素是β受体激动剂,利用异丙肾上腺素诱导心肌细胞的损伤可引起心肌细胞肥大甚至心肌重构,同时也引起心肌能量代谢的紊乱,导致细胞凋亡,直接影响心脏功能[7-9]。
千层纸素A(oroxylin A,OA,图1)又名千层纸黄素,木蝴蝶素,是常见的植物次生代谢产物,主要存在于木蝴蝶和黄芩中,属于黄酮类化合物[10-11]。OA具有广泛的药理活性,如改善脂肪肝[12]、抑制流感病毒复制[13]、舒张血管[14]、抗肿瘤[15]等功效。此外,OA还可通过激活PPARγ抑制NLRP3炎症小体从而改善炎症性肠病[16]。目前OA对心力衰竭是否具有改善作用尚不清楚,因此本研究拟考察OA对异丙肾上腺素诱导的大鼠心力衰竭的改善作用,并对作用机制进行探讨。
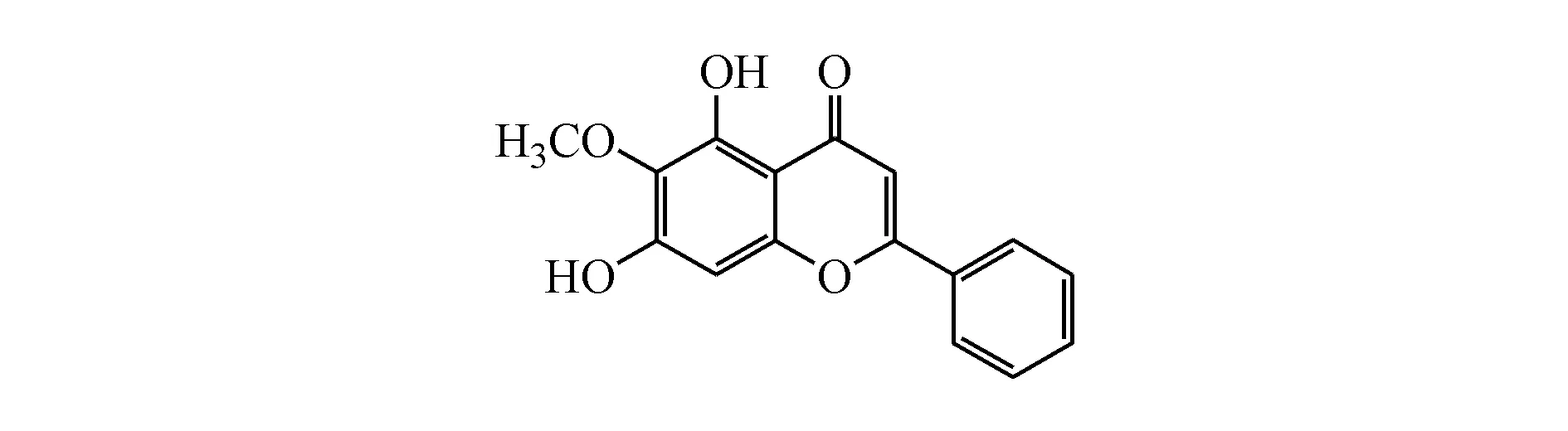
Figure1 Chemical structure of oroxylin A (OA)
1 材 料
1.1 药品与试剂
千层纸素A(oroxylin A,OA,纯度大于98%,江苏永健医药科技有限公司);异丙肾上腺素(isoproterenol,ISO,百灵威科技有限公司);美托洛尔(广州杨叶生物科技有限公司)。
胎牛血清(美国BI公司);双抗、不含EDTA的胰酶(上海源培公司);BCA蛋白浓度检测试剂盒及DMEM培养基(美国Thermo Fisher Scientific公司);Western blot试剂及IP裂解液(碧云天公司)。抗AKT1抗体、抗磷酸化AKT1抗体、抗RPS6KB1 抗体、抗磷酸化RPS6KB1抗体、抗RPS6抗体以及抗磷酸化RPS6抗体均购自美国Cell Signaling Technology公司;抗LC3B抗体、抗p62抗体和抗Actin抗体均购自美国Santa Cruz公司。其他试剂均为市售分析纯。
1.2 仪 器
CO2培养箱及低速离心机(美国Thermo公司);多功能酶标仪(美国BioTek公司);电泳仪(美国Bio-Rad公司);倒置荧光显微镜(日本Nikon 公司);高速冷冻离心机(德国Eppendorf公司);超纯水仪(美国Millopore公司)。
1.3 动 物
实验用清洁级SD大鼠,雄性,200~220 g,购自北京维通利华实验动物技术有限公司,合格证号为SCXK(京)2016-0006,标准饲养,自由饮水,室温20~25 ℃,湿度50%~60%,光照12 h明暗交替。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 大鼠心力衰竭模型的建立
大鼠先用异丙肾上腺素ISO(1 mg/(kg·d),皮下注射,连续10 d)诱导心力衰竭模型[17],行超声心动图检查后,心脏射血分数超过45%的被排除,剩下的大鼠被随机分为5组:模型组、美托洛尔组10 mg/(kg·d)、OA组25 mg/(kg·d)、50 mg/(kg·d)、100 mg/(kg·d),每组8只大鼠,每天给药1次,每次3 mL,灌胃给药8周。正常对照组大鼠与ISO组大鼠给予同体积的CMC-Na溶液。
2.2 心脏功能指数测定
大鼠造模8周后,检测大鼠血流动力学数据,左室收缩末压(LVESP)、左室舒张末压(LVEDP)、等容收缩期左心室压力上升最大速率(+dp/dtmax)和等容舒张期左心室压力下降最大速率(-dp/dtmax);并用彩超仪检测大鼠心脏功能。大鼠取血后3 500 r/min离心15 min,小心吸取上清液后,存放于-80 ℃冰箱保存,用商品化试剂盒检测血清中去甲肾上腺素、醛固酮、脑钠肽、内皮素-1和血管紧张素Ⅱ的水平。
2.3 苏木精-伊红染色和Masson染色
取大鼠心肌组织先用10%中性福尔马林固定液固定,石蜡包埋并切片后,用苏木精-伊红染液和Masson进行染色,在镜下观察并拍摄照片。
2.4 ISO体外诱导心肌细胞损伤模型的建立及实验分组
出生1~3 d的正常SD大鼠的乳鼠,按文献方法[18]提取原代心肌细胞。从正常SD大鼠乳鼠中取出心肌组织,先用胶原酶消化,再使用差速贴壁方法分离得到原代心肌细胞,种于24孔板,37 ℃培养48 h后,分为4组进行不同预给药:培养基对照组、ISO模型组、OA低剂量组(3 μmol/L)及OA高剂量组(10 μmol/L)。OA孵育细胞6 h后,ISO模型组、OA低剂量组及高剂量组分别用1 μmol/L ISO刺激30 min,然后收集细胞,免疫印迹法检测细胞自噬通路相关蛋白的表达。
2.5 细胞蛋白定量
先用PBS快速冲洗细胞2遍后;加入适量的裂解液(含蛋白酶抑制剂及磷酸酶抑制剂),将细胞吹下,冰上静置10 min,离心13 500 r/min,5 min,弃沉淀,取上清液待用。利用BCA法测定不同浓度BSA以及上清液的吸收度,绘制标准曲线。根据酶标仪所示吸收度,参照标准曲线,读取上清液中蛋白浓度。
2.6 数据处理及统计分析
3 结 果
3.1 OA显著改善ISO诱导的大鼠心力衰竭模型中心脏功能障碍和心肌重构
ISO可诱导大鼠发生实验性心脏功能障碍,如图2所示,ISO造模8周后左室收缩末压(LVESP)、等容收缩期左心室压力上升最大速率(+dp/dtmax)和等容舒张期左心室压力下降最大速率(-dp/dtmax)均明显下降,而左室舒张末压(LVEDP)和左心室指数(LVMI)明显上调;在给予OA治疗后显著地逆转了心脏功能障碍、心肌肥厚以及血流动力学参数的改变。
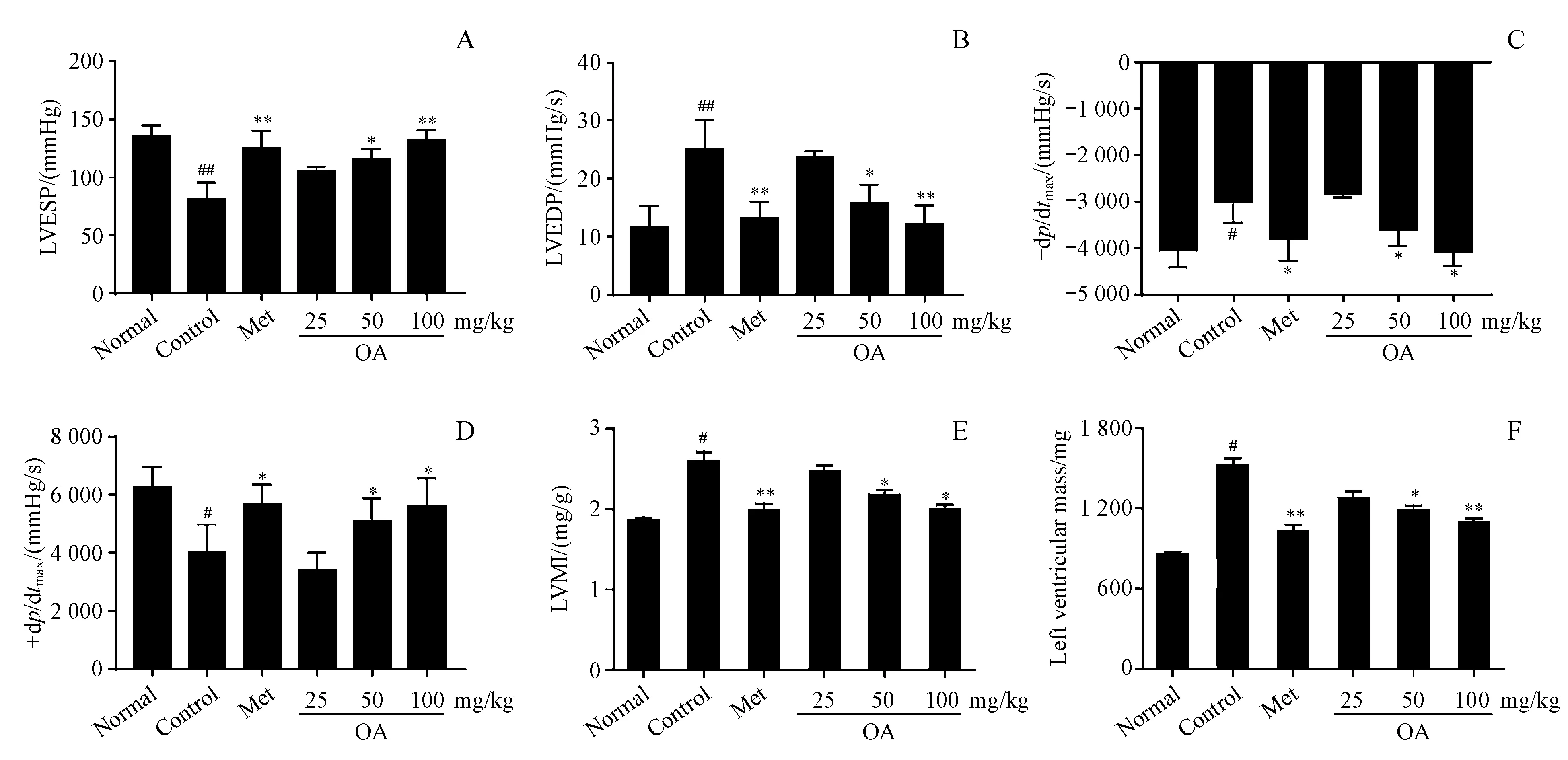
Figure2 OA alleviates deranged cardiac parameters in rats with heart failure caused by isoproterenol
#P<0.05,##P<0.01vsnormal group;*P<0.05,**P<0.01vscontrol group
根据超声心动图分析数据,与正常大鼠相比,ISO造模后的大鼠心脏射血分数显著降低。而OA给药组明显改善了大鼠心力衰竭后的心脏射血分数(图3)。
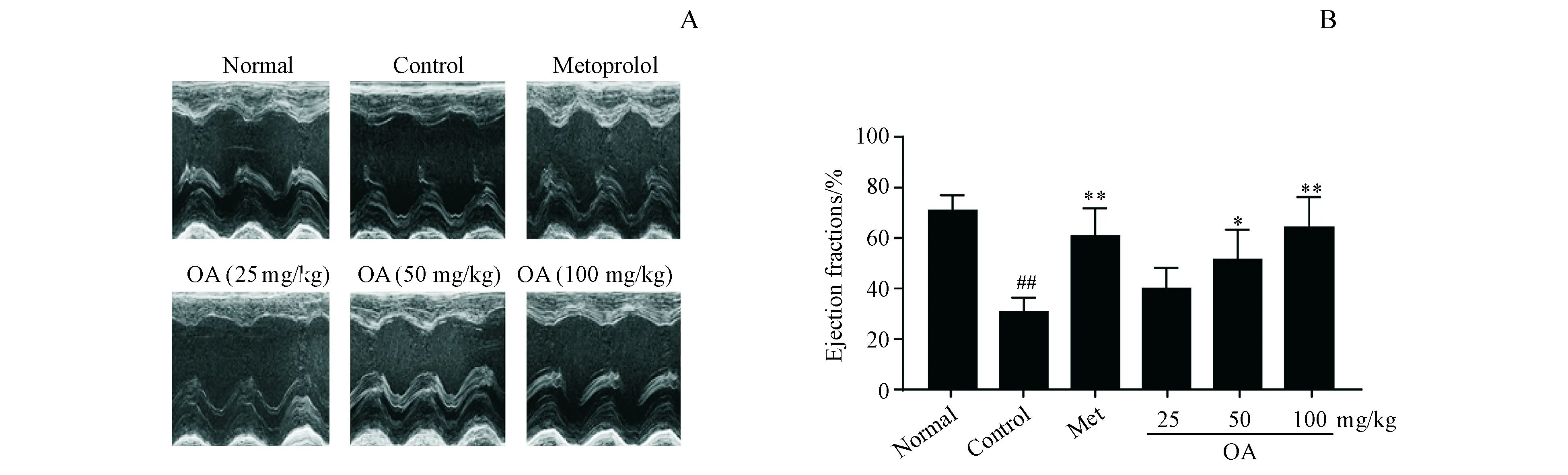
Figure3 OA improves echocardiography parameters of the left ventricular in rats with heart failure caused by isoproterenol

##P<0.01vsnormal group;*P<0.05,**P<0.01vscontrol group
此外,H&E和Masson染色还提示OA显著缓解了受损心肌组织的病理改变如心肌肥大、心肌黏连形成、炎性细胞浸润、心肌纤维化等(图4-A,4-B)。进一步,OA改善心肌纤维化的效应又在羟脯胺酸测定试验中得到证实(图4-C)。本研究还利用电镜对慢性心衰大鼠心肌超微结构改变进行了考察,结果表明,与正常组相比,心力衰竭模型组的主要损伤部位是线粒体和横纹肌的形态,其中线粒体的内、外膜破损,有部分脊受损且消失;横纹肌呈不连续形态,Z带较宽(图4-D)。OA给药组的线粒体形态和横纹肌形态有明显改善,且高剂量组改善效果最显著,尤其是线粒体的形态良好,与正常组较为接近(图4-A,TEM组)。以上结果提示OA显著改善了ISO诱导的大鼠心力衰竭模型中的心脏功能障碍以及心肌重构。
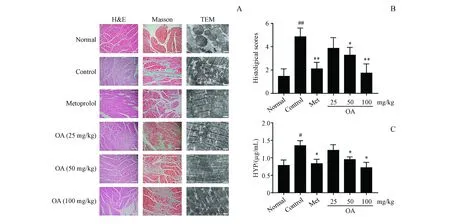
Figure4 OA ameliorates histopathological changes of the left ventricular in isoproterenol-induced rat heart failure model

#P<0.05,##P<0.01vsnormal group;*P<0.05,**P<0.01vscontrol group
3.2 OA显著下调ISO诱导的大鼠心力衰竭模型中神经内分泌因子的释放
从图5可以看出,OA剂量依赖性地抑制了ISO所致心力衰竭大鼠血清中去甲肾上腺素(NE)、醛固酮(ALD)、脑钠肽(BNP)、内皮素-1(ET-1)以及血管紧张素Ⅱ(ANG-II)等的水平。这些神经内分泌因子的下调对于OA改善心力衰竭大鼠心脏功能障碍以及心肌重塑起重要作用。
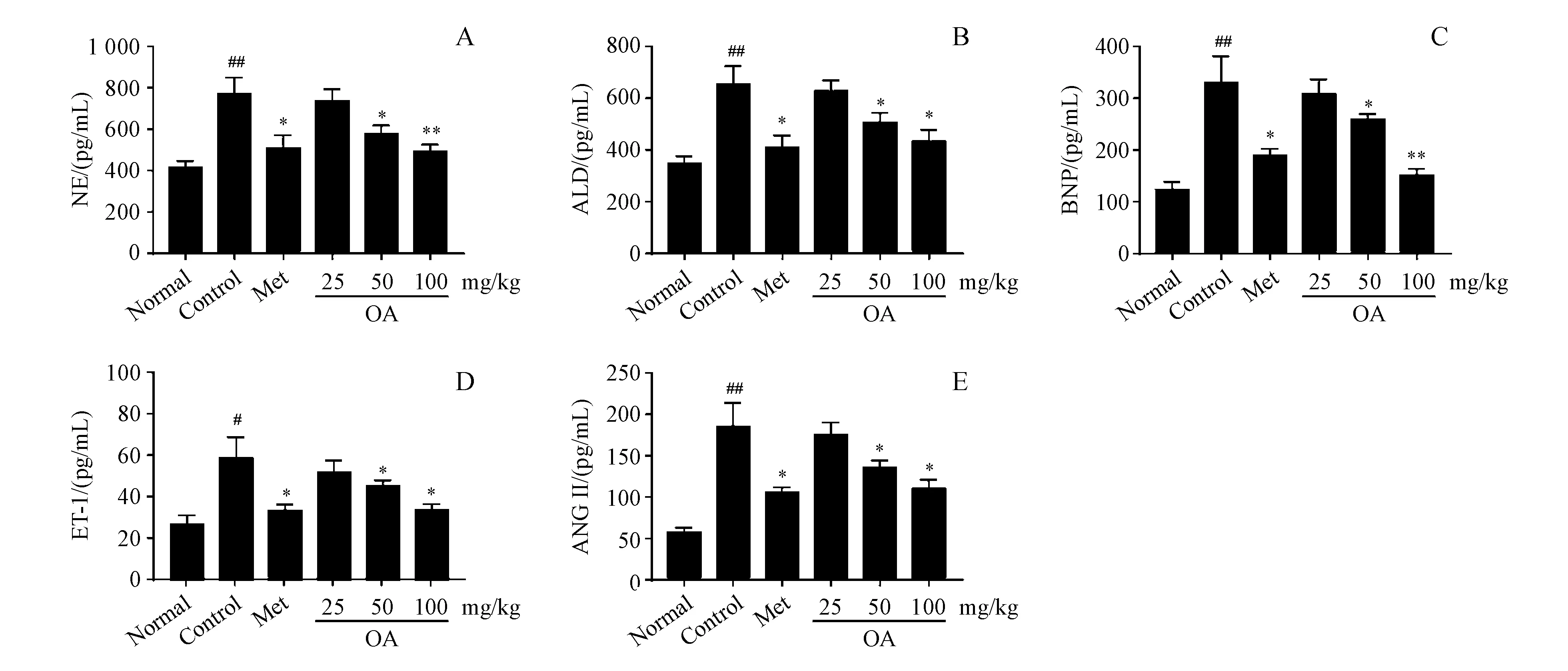
NE:Norepinephrine;ALD:Aldosterone;BNP:Brain natriuretic peptide;ET-1:Endothelin 1;ANG II:Angiotensin II
#P<0.05,##P<0.01vsnormal group;*P<0.05,**P<0.01vscontrol group
3.3 OA促进心肌细胞自噬改善心力衰竭
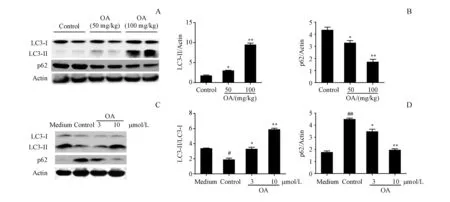
为了考察自噬是否参与ISO诱导的大鼠心力衰竭模型,检测了体内心肌组织的自噬水平。LC3是哺乳动物细胞中反映自噬状态的蛋白,取大鼠的心肌组织,免疫沉淀法检测LC3-I和LC3-II的表达水平。与对照组相比,在OA治疗组中,特别是在100 mg/kg的OA治疗组中,LC3-II的表达明显增加,LC3-II/LC3-I比值明显上升(图6-A,6-B)。此外,还发现自噬相关蛋白p62的表达水平在OA处理后显著降低(图6-A,6-B)。
为了进一步证实OA诱导心肌细胞自噬这一结果,采用新生大鼠心肌细胞体外培养模型,与正常组相比,ISO模型组心肌细胞的自噬水平显著降低(图6-C,6-D)。然而,OA预处理大大增加了LC3-I到LC3-II的转换,且呈剂量依赖关系。此外,p62的表达在OA处理下也明显的减少(图6-C,6-D)。以上结果提示OA体外可诱导心肌细胞发生自噬。综合体内外实验结果发现,OA可以在体内外触发心肌细胞自噬来改善ISO诱导的心力衰竭。
3.4 OA通过抑制AKT1-RPS6KB1信号促进自噬
AKT1-核糖体蛋白S6激酶多肽1(RPS6KB1)信号通路在自噬调节中起着关键作用。本研究用免疫沉淀法考察了心肌细胞相关蛋白的表达水平。OA显著地抑制AKT1在Ser473和Thr308位点的磷酸化(图7-A,7-B)。此外,OA也剂量依赖性地下调了p-RPS6KB1和p-RPS6的表达(图7-C,7-D)。这些结果表明,OA通过下调AKT1-PRS6KB1信号通路促进心肌细胞的自噬。
综上所述,OA通过抑制AKT1-PRS6KB1信号通路促进心肌细胞自噬从而改善实验性大鼠心脏功能障碍。
4 讨 论
心力衰竭是一种慢性进展性疾病。在心力衰竭的发生发展中,心肌细胞自噬起着至关重要的调控作用。心力衰竭时的“能量危机”可引发心肌细胞的自噬通路激活,自噬可降解异常蛋白质及受损的细胞器,从而为细胞的自我更新提供必要的能量和物质[19-20]。若这一过程中心肌细胞自噬出现障碍,则会加剧心力衰竭的进展。通过外源性小分子化合物调节自噬的发生也已成为治疗因自噬不足所致疾病的一种有效策略[21]。
前期研究表明,OA具有改善脂肪肝、抑制流感病毒复制、舒张血管等活性[12-14],然而OA在心力衰竭中的作用还不清楚。因此,以ISO诱导的大鼠心力衰竭模型为研究对象,考察OA是否能改善心衰大鼠的症状。研究发现,OA给药组的心力衰竭大鼠紊乱的血流动力学参数和心脏射血分数得到显著改善,受损心肌组织的病理改变明显缓解,后期心力衰竭大鼠心肌纤维化的症状也得到显著改善;OA还显著下调ISO诱导的大鼠心衰模型中神经内分泌因子的释放;进一步的机制研究发现,OA通过抑制AKT1-PRS6KB1信号通路促进心肌细胞自噬来改善实验性大鼠心脏功能障碍和心肌重塑。
#P<0.05,##P<0.01vsnormal group;*P<0.05,**P<0.01vscontrol group
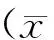
##P<0.01vsnormal group;*P<0.05,**P<0.01vscontrol group
自噬是机体在生理和病理状态下维持稳态平衡的关键。因此,自噬水平的改变与恶性肿瘤、神经退行性疾病以及心血管疾病等密切相关[22-24]。已有报道显示,心肌自噬功能紊乱在心肌重塑和心力衰竭中起着至关重要的作用[25]。本研究结果提示,OA能改善心脏重构和左心室功能障碍,但是否能调节心肌的自噬尚不清楚。本实验结果表明,OA显著增加了LC3-I到LC3-II的转换,同时减少了自噬相关蛋白p62的表达,提示OA可诱导受损的心肌细胞自噬。据报道,AKT1-RPS6KB1信号通路在自噬的调节中起着至关重要的作用[26]。本研究发现OA处理后p-RPS6KB1、p-RPS6以及p-AKT1均呈现剂量依赖的下调。这些结果提示OA促进心肌细胞自噬与抑制AKT1-RPS6KB1信号通路有关。然而OA是如何促进受损心肌细胞的自噬还需要进一步的研究。
总之,OA能够显著地改善ISO诱导的心力衰竭大鼠心脏的重构以及左心室的功能障碍。OA改善心力衰竭的机制可能与抑制AKT1-RPS6KB1信号通路促进损伤心肌细胞自噬有关。本研究为千层纸素A作为临床上治疗心力衰竭的候选药物提供了理论依据。

