基于血小板及其膜的仿生递药系统研究进展
徐剑培,徐群为,王晓琪,辛洪亮
(南京医科大学药学院,南京 211166)
目前,在纳米递药系统研究中,存在着诸如生物相容性差、血液循环寿命短、主动靶向性不足、生物膜屏障透过率不高等问题。尤其在血液循环中,会吸附大量非特异性蛋白质和生物分子在其表面形成蛋白质干扰层[1-2],极大地影响了纳米载体按照设计预期到达病灶部位并发挥应有的疗效。因此,基于机体循环系统中各种细胞仿生的新型递药系统应运而生,逐渐成为近年来生命科学领域的研究热点[3-4]。其中,血小板及其膜仿生递药系统(platelet and platelet membrane biomimetic drug delivery system)引起了研究者们极大的关注。血小板作为生物体内的固有成分,可以逃避免疫系统清除,且和血管内皮损伤修复[5-6]、免疫应答[7-8]、动脉粥样硬化形成[9]、神经退行性变[10]、肿瘤生长转移[11]等生理过程密不可分。血小板在参与这些机体反应的过程中,能很好地靶向富集到反应部位。所以,血小板及其膜仿生递药系统在肿瘤靶向、病原微生物吸附、血管内皮损伤修复以及凝血等领域展现出巨大的应用前景。本文综述了基于血小板及其膜仿生递药系统的研究现状与应用,以期促进血小板及其膜仿生载体在药物递送领域的研究与开发。
1 血小板的性质和特点
血小板是由成熟巨核细胞分化出的无核细胞,平均粒径在2~5 μm,是血液中体积最小的成分,其平均生命周期为7~10 d。随着对血小板研究的深入,人们发现血小板在许多生理和病理过程中起到至关重要的作用,如参与血管内皮损伤的修复过程:凝血和止血,维持血管完整性和诱导血栓形成等[5]。此外,还与组织修复[6]、免疫应答[7-8]、动脉粥样硬化形成[9]、神经退行性变[10]以及肿瘤生长和转移[11]等密切相关。
在血小板膜表面,富含多种特异性膜蛋白,如免疫调节蛋白CD47、CD55、CD59;整合素αⅡb、α2、α5、α6、β1、β3;穿膜蛋白GPIbα、GPIV、GPV、GPVI、GPIX、GLEC-2等。这些膜蛋白为血小板发挥特定生理作用提供了强有力的支持。例如在血管损伤时,血小板表面GPIb-IX-V受体上的GPIbα糖蛋白,损伤内皮细胞分泌的血管性血友病因子(vWF)相结合,同时血小板表面的GPIa-IIa和GPVI 糖蛋白结合到损伤部位的内皮下胶原蛋白,激活血小板及许多信号通路,使大量血小板聚集黏附于损伤血管处,形成纤维蛋白堵塞损伤部位[12]。
2 血小板及其膜仿生递药系统的种类
根据载药方式与组装方法,血小板及其膜仿生递药系统可以分为3类:(1)药物共价偶联在血小板膜上的载体;(2)药物直接包载于血小板内的载体;(3)血小板膜包覆的纳米载体。
2.1 药物共价偶联在血小板膜上的载体
药物共价偶联在血小板膜上的载体,是以天然血小板为媒介,通过化学共价结合或生物工程手段将药物偶联或表达于血小板膜上的递送载体(图1)。其利用血小板在肿瘤组织、循环肿瘤细胞(CTC)、损伤血管等部位的靶向结合能力,将药物递送至病灶,随后血小板激活,释放含药微粒起到治疗作用。
Wang等[13]将程序化死亡配体1(PDL1)抑制剂修饰于未激活状态的活体血小板上,用于肿瘤术后复发的免疫治疗研究。Li等[14]通过基因工程手段在血小板表面表达诱导肿瘤凋亡的坏死因子,通过自体血小板与迁移肿瘤细胞的作用关系为靶向机制来抑制肿瘤细胞的转移。
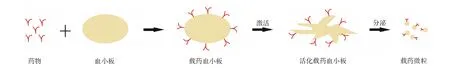
图1 药物共价偶联在血小板膜上的载体
2.2 药物直接包载于血小板内的载体
药物直接包载于血小板内的载体,是通过化学法、电穿孔法、胞吞法、低渗法和脂质融合法等手段[15],将药物包载于天然血小板内的递送载体(图2)。利用天然血小板的保护,可以提高药物的稳定性,减少不良反应,增强治疗效果。
Xu等[15]首次利用血小板上开放的微管系统,将阿霉素(DOX)物理包载于血小板内,利用血小板对肿瘤部位的靶向结合特性,靶向治疗淋巴瘤。应用该递药载体对荷瘤小鼠给药治疗10 d后,与游离DOX相比,肿瘤体积缩小至原来的二分之一。
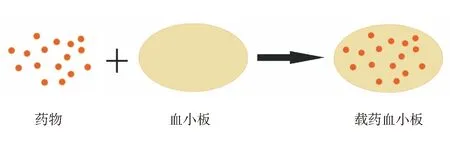
图2 药物直接包载于血小板内的载体
2.3 血小板膜包覆的纳米载体
血小板膜包覆的纳米载体,是通过静电吸附作用将血小板膜包覆于纳米载体表面,亦可对其膜表面进一步修饰的功能性递送载体(图3)。
从新鲜血液中提取的血小板,经过分离、纯化、冻融或涨破、离心等过程后,仍能较好地保留血小板膜蛋白,并在包覆于纳米载体表面后发挥其原有的生理特性[16]。该类递药系统为纳米载体提供一层生物伪装外衣,在提高生物相容性和免疫逃逸能力的同时,还可以利用血小板膜上的游离氨基或者羧基进行化学修饰,赋予该载体系统更加丰富的功能。
在血小板膜包覆的纳米仿生递药系统研究中,加州大学圣地亚哥分校张良方教授团队开展了具有开创性的研究。他们利用静电吸附,通过物理超声的方法在聚乳酸-羟基乙酸共聚物(PLGA)纳米粒表面包覆了一层约15 nm厚的单层血小板膜外衣,免疫印迹试验(Western blot)检测结果显示血小板膜蛋白(包括免疫调节蛋白、整合素以及其他穿膜蛋白等)大多数较完整的保留于血小板膜上[16]。
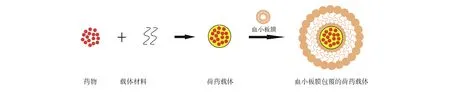
图3 血小板膜包覆的纳米载体
3 血小板及其膜仿生递药系统的特点
3.1 提高生物相容性,延长药物体内循环时间
普通治疗药物在体内循环过程中,容易被机体免疫系统和代谢机制所清除,因而存在体内循环时间短,药物治疗量不足等问题,而采用聚乙二醇(PEG)修饰的方法进行改善,仍然可能产生“加速血液清除”(ABC)现象[17]。制备纳米粒的材料,虽具有一定的生物相容性,但在血液循环过程中,仍易激活血液中的补体系统,吸附血液中的蛋白形成蛋白干扰层[3-4],弱化了功能性纳米粒的特异性,使其易被免疫系统所识别和清除。
血小板及其膜仿生递药系统可以利用血小板膜上调节免疫逃逸的CD47、抑制补体激活的CD55和CD59等提高其生物相容性,延长药物体内循环时间[16,18]。Hu等[16]通过阻断包裹在纳米粒表面的血小板膜上CD47受体,发现其被THP-1巨噬细胞吞噬量提高了1.6倍。在补体激活实验中,血小板膜包覆纳米粒也未出现明显补体激活现象。Wang等[13]通过将程序化死亡配体1(PDL-1)抑制剂接枝于未激活的天然血小板膜上,显著延长了PDL-1抑制剂在体内的半衰期,由原来的5 h延长到35 h。
3.2 增加药物的稳定性,减少不良反应
蛋白多肽类药物在体内容易被酶水解失活,如组织中的蛋白质水解酶、组织蛋白酶、溶酶体、膜结合的氨肽酶,血液中的二肽酶Ⅳ(DAP IV),后脯氨酶断裂酶(PPCE)等。将蛋白多肽类药物包裹或修饰在血小板膜仿生递药系统中,可以减少酶及外界条件的降解,从而增加药物的稳定性。
细胞毒性化疗药物对正常细胞具有严重的不良反应,将其装于血小板及其膜仿生递药系统中,可以有效减少化疗药物的脱靶毒性。例如,Xu等[15]将DOX包载于天然血小板内,在体外心脏毒性试验中,72 h共孵育后,仍有80%心肌细胞存活,表现出较小的细胞毒性。
3.3 增加药物的主动靶向性
血小板膜表面富含许多功能性蛋白,在肿瘤的生长与远端转移、血管损伤修复和病原微生物吸附结合方面有重要的作用。利用这些特点,可以增加血小板及其膜仿生递药系统的相关靶向性。
3.3.1 肿瘤靶向性 研究表明,血小板与肿瘤生长和转移过程密切相关[19]。肿瘤细胞会分泌激活因子直接激活血小板,并通过GPIIb-IIIa-纤维蛋白原(fibrinogen)以及P选择素-CD44与活化血小板结合,形成血小板-肿瘤异质聚集体,这种聚集体更易被微脉管所截留,从而为肿瘤生长提供了有利的场所[20]。同时,血小板形成的保护层为肿瘤细胞迁移提供了良好的免疫逃逸环境,并为肿瘤细胞迁移嫁接了MHC Ⅰ型配体,从而避免其被自然杀伤细胞(NK cell)识别和清除。
Hu等[18]用罗丹明标记血小板膜包覆的纳米粒,与人乳腺癌细胞(MDA-MB-231)孵育2 h后,用激光共聚焦显微镜观察到,包覆有血小板膜的纳米粒通过P选择素靶向肿瘤细胞膜上CD44受体的机制,不仅在细胞质聚集,在肿瘤细胞膜表面也有大量分布,而裸纳米粒仅在细胞质中聚集。体内动物实验表明,给药48 h后,血小板膜包覆的纳米粒在肿瘤部位的蓄积量为裸纳米粒的1.9倍。
Li等[21]将肿瘤坏死因子凋亡相关配体(TRAIL)接枝于血小板膜包覆的二氧化硅纳米粒上,在肺转移瘤动物模型评价中,表现出高度的CTCs结合性,显著减少了肺转移瘤的形成。
3.3.2 血管内皮损伤及血栓靶向性 血小板在体内最主要的功能是参与血管损伤修复而止血。在血管损伤后凝血的第一阶段,血小板通过损伤血管壁释放的vWF结合到暴露的血管内皮下胶原蛋白上,同时血小板膜表面的GP-Ib-V-IX糖蛋白复合物介导其结合至vWF因子A1区的GPIbα配体结合蛋白,GPIbα促进血小板在高血流剪切力环境下吸附到损伤血管处[22-23]。随后被激活的血小板如同蜘蛛网般黏附到血管壁上并相互粘连,形成血小板栓,堵塞损伤部位。此外,血小板的激活提高了其表面GPIIb-IIIa整合蛋白的表达,作为和纤维蛋白原相结合的受体,促进了纤维蛋白和血小板的结合[24]。Hu等[16]利用该特性,将多西他赛担载于血小板膜包覆的聚合物纳米粒中,用于术后冠状动脉再狭窄的治疗。在SD大鼠血管损伤模型中,血小板膜包覆的多西他赛聚合物纳米粒可以在血管内皮损伤处大量蓄积,并可以滞留至少5 d。Hu等[25]将溶栓药物组织纤维溶酶原激活剂(tPA)接枝于载有抗肿瘤药物的血小板膜包覆聚合物纳米粒表面,协同治疗多发性骨髓瘤及并发血栓。在肺血栓模型评价中,接枝有tPA的血小板膜包覆聚合物纳米粒表现出高于游离tPA组2倍的溶栓效果,这主要是由于血小板膜增强了tPA的血栓结合力,从而增加了tPA在血栓部位的蓄积量。
3.3.3 病原微生物靶向性 血小板几乎和所有的病原微生物都有交互作用,并引起血小板的激活和聚集,如病毒、细菌、真菌和原生动物等。这些交互作用种类繁多,病原微生物表面的蛋白可以和血小板膜上的受体发生直接结合,也可以在二者之间通过血浆蛋白发生间接结合。在感染病原微生物后,病原微生物通过这种交互作用激活血小板,并引起大量血小板的吸附聚集。例如:链球菌通过其表面含有胶原蛋白样表位的血小板激活蛋白结合并激活血小板[26];幽门螺杆菌结合血浆中的vWF因子,再结合到血小板膜上的GPIbα[27]等。血小板膜仿生递药系统可以利用这种交互作用靶向病原微生物。
Hu等[16]将血小板膜包裹于PLGA纳米粒表面,作为万古霉素的递送载体。以MRSA252(一种耐甲氧西林的金黄色葡萄球菌)为模型,该血小板膜仿生递药系统展现出良好的病原微生物靶向性。和裸纳米粒相比,血小板膜包裹的万古霉素纳米粒的结合力提高了12倍,只需要1/6游离万古霉素的剂量,就能达到同等的抑菌效果。
4 血小板及其膜仿生递药系统的应用
4.1 在肿瘤靶向治疗中的应用
Hu等[18]利用血小板膜和肿瘤细胞间的相互作用,构建了一种pH敏感壳-核结构型血小板膜包覆的聚合物纳米载体,用于靶向递送TRAIL和DOX程序化双重杀伤肿瘤细胞。当该体系进入血液循环后,在恶性肿瘤增强渗透和滞留(EPR)效应下富集于肿瘤组织,通过载体表面血小板膜上高度表达的P选择素主动靶向于肿瘤细胞表面高表达的CD44受体。接着血小板膜上接枝的TRAIL传递细胞凋亡信号到肿瘤细胞膜,引发细胞凋亡。随后载体系统内吞进入肿瘤细胞内,聚合物纳米粒在细胞内弱酸环境下解聚,释放DOX,再次杀伤肿瘤细胞。该递药系统在作用肿瘤组织的同时,对循环肿瘤细胞同样起到杀伤作用,从而抑制了肿瘤的远端转移。
在多发性骨髓瘤治疗中,经常会出现血栓并发症,从而使得多发性骨髓瘤患者死亡率提高了3倍[28]。Hu等[25]在血小板膜包覆纳米粒的基础上,联合运用tPA协同治疗多发性骨髓瘤及并其并发血栓。他们将硼替佐米通过纳米沉淀法包载于pH敏感聚合物纳米粒中,然后在纳米粒表面包被一层约20 nm厚的血小板膜,通过生物素-链亲和素将tPA接枝于膜表面,同时修饰钙离子螯合剂阿仑膦酸钠作为靶向配体以增强载药纳米粒在骨髓微环境的靶向性。该载药系统通过阿仑膦酸钠靶向到骨髓瘤部位后,借助于血小板膜上P选择素-CD44结合作用聚集于肿瘤细胞,释放硼替佐米杀伤肿瘤细胞。而血小板膜上接枝的tPA发挥溶栓的治疗作用,以应对可能出现的血栓并发症。
Li等[14]采用基因工程的方法在血小板膜上表达诱导肿瘤凋亡的坏死因子,通过血小板与循环肿瘤细胞的作用为靶向机制,抑制肿瘤细胞的远端转移。他们采用血小板靶向慢病毒转移基因法(platelet-targeted lentiviral transgene approach),通过对造血干细胞和祖细胞(HSPCs)的基因改造,随后进行骨髓移植。在血小板膜上表达特异性TRAIL,通过HSPCs自我更新,由成熟巨核细胞持续产生表达TRAIL的血小板。在前列腺肿瘤转移模型的评价中,这种基因工程修饰后的血小板明显减少了肿瘤细胞的肝转移率。
4.2 在抗病原微生物方面的应用
Hu等[16]考察了血小板膜包覆的聚合物纳米粒在病原微生物吸附方面的性能。在全身性细菌感染疾病模型中,用血小板膜包覆的聚合物纳米粒包载万古霉素进行治疗,和未包膜载药纳米粒及红细胞膜包覆的载药纳米粒对比,治疗效果得到明显提高。
此外,Li等[29]开发了一种血小板膜仿生纳米机器人(Nanorobot)用于清除体内病原微生物。通过模板辅助的复合电沉积法制备磁性纳米机器人,用超声法将血小板膜包覆该纳米机器人。借助外界磁场为其提供体内航行能力,血小板膜为其提供免疫逃逸能力和病原吸附结合能力。在抗志贺病菌(Stx)的治疗研究中,志贺病菌会特异性与血小板膜表面的鞘糖脂受体结合,从而在溶血性尿毒症中造成血小板减少和激活,形成微血栓。正是利用了这一结合特性,该纳米机器人能竞争性吸附结合志贺病菌,从而减少其对体内正常血小板的结合以及对机体的损伤。在以外界磁场为动力的驱动下,能类似于清道夫在体内快速、精准地吸附清除相关病原微生物,从而起到治疗的作用。
4.3 在治疗血小板减少症方面的应用
免疫型血小板缺少性紫癜(immune thrombocytopenia purpura,ITP)是先天性免疫调节的血液功能紊乱,通常是由体内的抗血小板自体抗体导致机体血小板含量过低,从而极易引发过量出血的疾病[30]。自身血小板抗体会特异性结合体内的血小板,从而导致血小板被网状内皮系统所清除,使得体内大量血小板减少,影响机体正常生理功能。基于此,Wei等[31]用PLGA纳米粒为载体,运用静电吸附在其表面包覆一层血小板膜,将纳米粒伪装成血小板。通过制备的这种人造血小板,诱捕患者体内的抗血小板自体抗体,替代天然血小板与该抗体的结合,从而保护了健康血小板。在其随后的体内外药效学评价中,该血小板膜仿生纳米药物也表现出良好的治疗效果,为免疫型血小板缺少性紫癜的治疗提供了新的研究思路。
4.4 在血管内皮损伤修复方面的应用
Hu等[16]用血小板膜包覆聚合物纳米粒递送多西他赛,应用于术后冠状动脉再狭窄的治疗。该系统利用包被在纳米粒上的血小板膜上GPIV结合到损伤血管暴露的胶原蛋白,能有效防止血管内膜的过度生长以及血流量的减少。
Modery-Pawlowski等[32]通过接枝功能性多肽于纳米粒上,模仿血小板在血管损伤修复时的功能。他们以脂质体作为模型粒子,通过杂化多原子配体的方法将胶原蛋白结合多肽(CBP)和vWF结合多肽(vBP)共修饰到粒子表面,模仿血小板的吸附,再修饰上仿纤维蛋白原多肽(FMP)提高血小板的聚集。通过调整vBP和CBP修饰的密度和比例,优化体系在不同血流剪切力作用下的吸附能力。调整FMP的密度,优化血小板的聚集作用,表现出较好的止血效果。Brown等[33]开发了质地极软的微凝胶仿生血小板形态学的功能。他们通过沉淀聚合法合成了超低交联度(<0.5%)的异丙基丙烯酰胺-丙烯酸(pNIPAm-AAc)微凝胶。这种极低的交联度为微凝胶提供了比天然血小板更优的可变形性。同时通过噬菌体展示技术,筛选出了纤维蛋白特异性的sdFvs多肽,赋予该微凝胶特异性选择损伤位点的纤维蛋白,而不与血液循环中的纤维蛋白原及血小板作用的能力。此外,该微凝胶在参与纤维蛋白网状结构的形成后,其良好的可变形性能模拟出血小板的凝块收缩能力,从而主动促进伤口愈合后栓子的解聚清除。
4.5 在免疫治疗中的应用
免疫治疗成为近年来的研究热点,尤其是针对T细胞免疫检查点PD-1/PD-L1的抗体疗法在临床上取得了显著的疗效,然而,在提高患者应答率及疗效,同时降低系统不良反应方面,仍需更加深入的研究。由于手术切除是目前治疗实体肿瘤的主要手段之一,利用血小板能在手术伤口富集止血的天然生理属性,Wang等[13]将抗PD-L1(aPDL1)抗体通过偶联剂共价连接于未激活的血小板膜上,该载体系统能够在黑色素瘤术后位点富集并激活,从其膜上释放出含有aPDL1的微粒,从而提高aPDL1向肿瘤术后部位的递送。此外,该课题组还结合基因工程技术使血小板表达PD-1受体,使得工程化的血小板能在手术后的伤口处靶向富集并可活化成微小纳米颗粒,识别并阻断肿瘤细胞表面的PD-L1配体,从而激活CD8+T细胞来清除术后潜在的残余肿瘤细胞。同时,将环磷酰胺直接包载于血小板内,通过低浓度的环磷酰胺使得其在病灶处能够特异性地杀伤调节性T细胞(Treg),实现在阻断肿瘤细胞PD-L1配体的基础上,清除Treg细胞,双管齐下激活T细胞,显著增强了黑色素瘤的治疗效果[34]。
5 展 望
血小板及其膜仿生递药系统是目前新型递药系统的研究热点。将血小板及其膜与递药系统相结合,弥补了普通递药系统在生物性能方面的不足,为新型递药系统的研究提供了新的思路。
目前血小板及其膜仿生递药系统的研究大多应用于肿瘤和病原微生物清除方面,对于心脑血管疾病方面的研究还不多。该类疾病,如缺血性脑卒中、脑血栓、动脉粥样硬化等,会对周围血管造成损伤,从而引发血小板的吸附和聚集。这为血小板及其膜仿生递药系统的应用提供了靶向条件,如果将治疗药物包载或修饰于血小板中,或许可以极大提升药物的递送效果。
血小板及其膜仿生纳米递药系统的研究与开发,其最终目的是为了应用于临床治疗,为患者服务。然而,该递药系统在投入临床研究前,还有较多困难和问题需要克服解决。如血小板是否必须来自患者本身,不同个体或种族的血小板是否影响疗效,是否会产生个体排异现象等。又如,工业化生产时,如何获取大量血小板,如何在生产过程中保留血小板的生物特性,如何确保制备工艺的稳定等,这些问题还有待于科学家进一步研究与探讨。

