胰岛素和GLP-1类似物长效化策略研究的最新进展
李承业,黄文龙,钱 海
(中国药科大学新药研究中心,南京 210009)
糖尿病是以高血糖为特征并伴随严重并发症的代谢性疾病。根据国际糖尿病联盟报告,目前全球糖尿病患者约有8.4%,预计到2045年,发病率会增加到9.9%[1],糖尿病已成为危害公众健康的重大疾病之一。胰岛素是目前治疗1型和2型中晚期糖尿病的首选药物;而胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂是新型的2型糖尿病治疗手段,二者都属于多肽类药物。
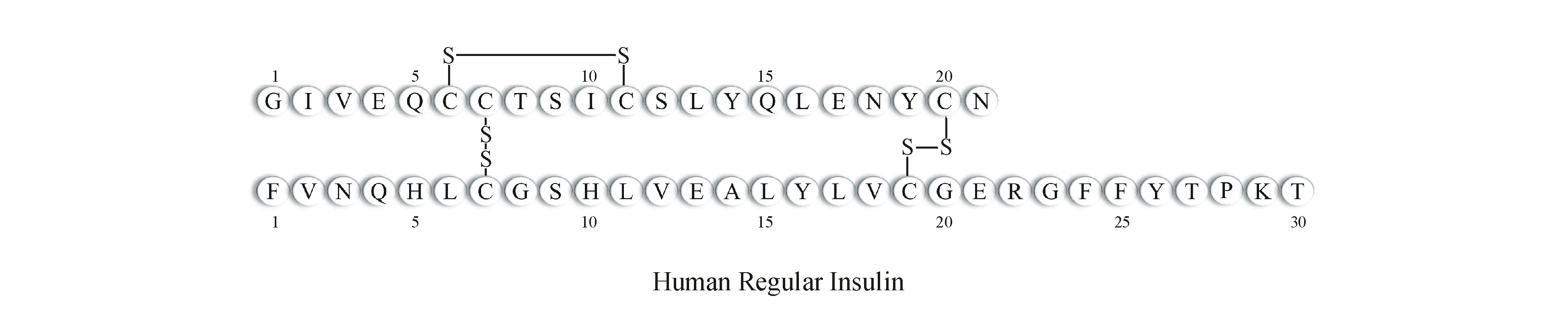
胰岛素是一种多肽类激素,由两条多肽链构成并通过两对二硫键连接,A链由21个氨基酸组成,且A链内部有一对二硫键,B链由30个氨基酸组成。胰岛素是机体内唯一降血糖的激素,并具有促进糖原、脂肪、蛋白质合成等功能。普通外源性胰岛素在临床应用上存在两大劣势:(1)人体β细胞分泌胰岛素直接作用于肝细胞,而外源性胰岛素在外周施用,存在一定起效时间;(2)外源性胰岛素无法模拟内源性胰岛素的作用曲线(维持基础水平并在进餐时达到峰值水平),当体内血糖水平下降时,没有反馈机制抑制胰岛素作用,增加低血糖风险。20世纪90年代,得益于重组DNA技术大力发展,人们发现对胰岛素肽链进行局部修饰能够改变胰岛素的理化性质和生理学特性,得到比普通胰岛素更适合临床需求的胰岛素类似物。胰岛素类似物一般可分为两类:速效胰岛素类似物和长效胰岛素类似物。速效胰岛素类似物模拟餐时胰岛素分泌,起效快,但作用时间短需要多次注射以及存在低血糖风险。因此临床需求能够模拟基础胰岛素作用的长效胰岛素类似物,以稳定持续控制血糖的同时减轻患者注射痛苦。
GLP-1是一种内源性肠促胰岛素激素,在体内发挥促进胰岛素释放、抑制胰高血糖素释放、抑制食欲和延缓胃排空等作用[2]。GLP-1的胰岛素促释放作用和胰高血糖素抑制作用具有血糖依赖性,因此其低血糖风险大大降低。然而内源性GLP-1在血浆中会被二肽基肽酶-4(DPP-4)等酶代谢失活,并且会被肾小球快速滤过清除,其体内半衰期很短,只有2~3 min[3]。首款上市的GLP-1受体激动剂艾塞那肽(exenatide)是从蜥蜴的毒汁中分离得到的具有生物活性的多肽,与内源性GLP-1的同源性较低,只有53%,半衰期大约2.4 h[4],主要通过肾脏清除作用而被排除体外。每天需要注射两次,给患者的使用带来不便。因此,对GLP-1及其类似物进行长效化研究具有重要意义。

多肽长效化的策略主要可分为化学结构修饰方式、制剂途径和给药装置3种。通过对多肽序列中的酶切位点进行定点修饰,可降低多肽酶对多肽的快速清除;将多肽结合至白蛋白、单克隆抗体片段或聚乙二醇(polyethylene glycol,PEG)片段等聚合物增加多肽相对分子质量,可达到减少肾脏快速滤过的目的。多肽与脂肪酸缀合可用于增加对白蛋白的亲和力,这能增加肽在体内的作用时间。制剂途径和给药装置能够改变多肽药物的药代动力学和药效学性质而不改变药物分子本身,如药物聚合物库基质的可控释放或可植入药物装置的缓慢释放能够达到延长多肽药物作用时间的目的。化学结构修饰方式、制剂途径和给药装置手段在提高多肽药物生物利用度,改善其药代动力学和药效学参数和延长半衰期等方面发挥重要作用。本文综述多肽类药物胰岛素和GLP-1类似物的长效化策略以及临床数据,为设计新型长效化多肽类药物提供思路。
1 通过化学结构修饰改善药物特性
1.1 改变多肽药物的氨基酸序列
1.1.1 相关的胰岛素类似物药物
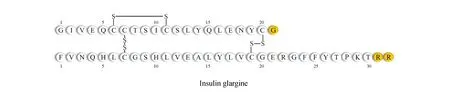
甘精胰岛素 甘精胰岛素(insulin glargine)由Sanofi公司研发,于2000年获美国食品药品监督管理局(FDA)批准,是首个进入临床应用也是目前最常用的长效胰岛素类似物。甘精胰岛素是将人胰岛素的A链末端Asn替换为Gly,同时在B链末端添加两个Arg得到。其可在皮下组织积聚形成聚集体,从而能够长期释放达到长效化。B链末端的两个Arg将等电点改变为pH 6.7,所以这种皮下积聚只发生在中性条件下[5]。在临床应用中,甘精胰岛素比普通胰岛素拥有更长的作用时间和更平滑的效果曲线[6]。甘精胰岛素在单剂量条件下的平均作用时间为22~24 h,在稳定条件下的平均作用时间为24~25.6 h,因此每天注射1次对大多数患者是可行的[6]。
1.1.2 相关的GLP-1类似物药物
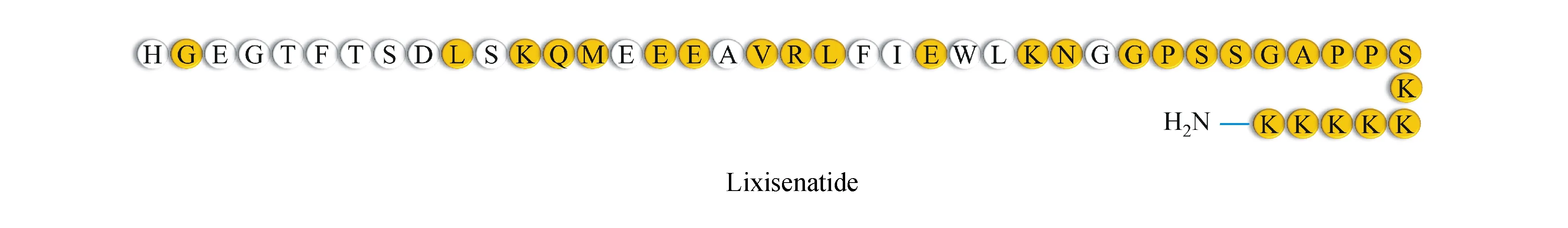
利西拉来 利西拉来(lixisenatide)由Sanofi公司研发,于2013年2月被欧洲药品管理局批准。Sanofi公司曾在2013年2月向FDA递交申请,但因FDA要求心血管终点实验ELIXA的数据被临时撤回。2015年重新递交申请,并于2016年7月被FDA批准上市。利西拉来的结构与艾塞那肽类似,用6个连续的Lys代替C末端的Pro。6个连续的Lys能够稳定多肽的结构,并抵抗酶类的降解达到长效化目的。利西拉来的半衰期约为2~4 h,每天需要给药两次。一项心血管结果研究显示,利西拉来不会增加心血管事件的发生风险。常见不良反应为恶心、呕吐以及与磺酰脲和基础胰岛素类似的低血糖症等[7]。
1.2 缀合脂肪酸链
1.2.1 相关的胰岛素类似物药物
地特胰岛素 地特胰岛素(insulin detemir)由Novo Nordisk公司研发,于2005年获FDA批准的中性可溶的基础胰岛素类似物。将人胰岛素B链30位Thr残基去除,在B链29位Lys残基上缀合14碳肉豆蔻酰基得到地特胰岛素。肉豆蔻酰基有助于地特胰岛素在注射部位自组装形成双六聚体,并且有助于和白蛋白可逆性的结合,促进地特胰岛素长效化[8]。地特胰岛素与甘精胰岛素相比,具有更稳定的作用曲线。在1型糖尿病患者施用0.4 units/kg的地特胰岛素,其作用时间能够达到21.5 h,且其夜间低血糖次数较甘精胰岛素明显减少[9]。
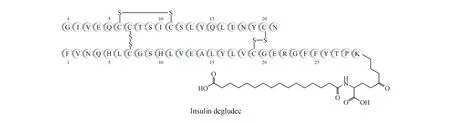
德谷胰岛素 德谷胰岛素(insulin degludec)是Novo Nordisk公司研发的新型长效化胰岛素,于2015年获FDA批准上市。将人胰岛素B链30位Thr去除,B链29位Lys通过Glu作为连接臂和16碳脂肪酸链连接,可得到德谷胰岛素。德谷胰岛素在皮下组织注射后会自组装成六聚体,其脂肪酸侧链又可与相邻六聚体作用,最终形成多聚六聚体链。其注射制剂中含有苯酚、锌离子和氯离子,苯酚和氯离子可稳定六聚体的构型,而当构型中的锌离子缓慢扩散,六聚体缓慢分解成二聚体或单体进入体内发挥作用[10]。脂肪酸结构使德谷胰岛素可以与白蛋白可逆连接,共同起效可发挥超长的作用时间[11]。1型糖尿病患者注射0.4 units/kg的德谷胰岛素,其作用时间至少42 h[11]。临床研究发现,每天注射一次德谷胰岛素不会导致活性胰岛素的积累,而是稳定的“储备”胰岛素[12]。与甘精胰岛素相比,德谷胰岛素在24 h内的降糖作用曲线更均匀,因此夜间低血糖的发生率更低[13]。德谷胰岛素的注射时间非常灵活,其两针的间隔时间可短至8 h,长至40 h,而且这种灵活性并不影响其安全性和有效性[14]。
1.2.2 相关的GLP-1类似物药物
利拉鲁肽 利拉鲁肽(liraglutide)由Novo Nordisk公司研发,2009年获得欧盟批准,2010年获得美国FDA批准上市。在内源性GLP-1的基础上,34位Lys用Arg替代,并在26位Lys上缀合16碳脂肪酸侧链。脂肪酸侧链可以与血清白蛋白发生非共价键作用,使得利拉鲁肽经皮下注射进入循环后,仅有1%~2%的化合物以游离多肽形式存在[15]。故利拉鲁肽拥有大约11~15 h的半衰期,能够在一天内持续激活GLP-1受体[15]。利拉鲁肽的初始给药剂量为每次0.6 mg,1周后增加到每次1.2 mg,如耐受性良好,或需要更好的疗效,可以将剂量提升到每次1.8 mg。利拉鲁肽可以显著降低平均糖化血红蛋白(HbA1c)和空腹血糖(fasting plasma glucose,FPG)水平,有减轻体重的效果,且发生低血糖概率低[16]。利拉鲁肽可以在一天中任何时间给药,与进食无关,皮下注射部位包括腹部、大腿和上臂。
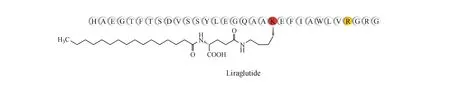
索马鲁肽 索马鲁肽(semaglutide)由Novo Nordisk公司研发的每周给药1次的长效化GLP-1类似物,于2017年12月被FDA批准上市。索马鲁肽与天然GLP-1有94%的同源性[17]。在利拉鲁肽的基础上,索马鲁肽做了进一步的改变,将34位Lys替换为Arg,在26位Lys缀合18碳脂肪酸链,同时将8位Ala替换为2-氨基异丁酸(Aib)。脂肪酸侧链会与血清白蛋白发生更强的非共价键作用,减少了肾脏对药物的清除作用。另外,8位Aib可以抵抗DPP-4对索马鲁肽分子的降解。根据文献报道,索马鲁肽的半衰期达到了惊人的155~184 h[17]。研究表明,索马鲁肽降糖效果优于多个主流降糖药,如甘精胰岛素等,并具有降低心血管疾病风险的效果[18]。在SUSTAIN 7试验中,索马鲁肽又凭借低剂量在降糖、减重效果方面击败了杜拉鲁肽[19],进一步确定了其当今最佳GLP-1受体激动剂的地位。另外,Novo Nordisk公司还与口服给药系统厂商Emisphere Technologies合作,推进索马鲁肽的口服制剂开发[20]。索马鲁肽口服制剂在Ⅱ期临床中降糖、减肥效果优异,但是生物利用度较低,已上市的索马鲁肽注射制剂每周用药1次,每针0.25~1.0 mg,而口服制剂需要1天1片,每片10~20 mg,其安全性、有效性也仍有待临床试验证明[21]。
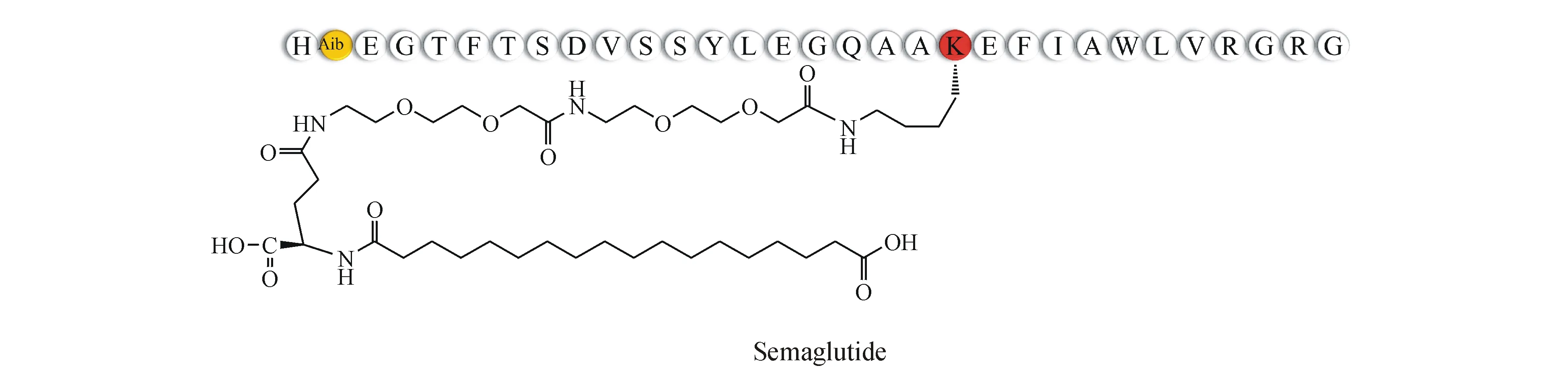
克莫鲁肽 克莫鲁肽(coumaglutide)由笔者所在课题组研发,将双香豆素通过不同碳链长度的马来酰亚胺连接臂与修饰过的GLP-1肽链在不同氨基酸残基位点结合得到一系列GLP-1类似物,发现其具有良好的生物学活性。4-羟基香豆素可以与人血清白蛋白紧密结合,而双香豆素是一种干扰维生素K代谢的口服抗凝剂。糖尿病患者动脉粥样硬化血栓形成的风险增加,而双香豆素可能有助于预防血液凝结。其中,活性最好的化合物克莫鲁肽在db/db小鼠中的降血糖持续时间显著大于艾塞那肽和利拉鲁肽。鉴于啮齿类动物的药物清除速度比人类快得多,人类的抗糖尿病持续时间可能大大高于小鼠观察到的35.8 h,后续的活性评估仍在进行[22]。
1.3 融合人体内源性长效化蛋白片段
1.3.1 相关的胰岛素类似物药物
LAPSInsulin 115LAPSInsulin 115是由Hanmi Pharmaceutical公司研发的每周给药的长效化胰岛素类似物,目前已进入Ⅰ期临床。其以免疫球蛋白G(immunoglobulin G,IgG)Fc片段为载体,用3.4 kD的PEG作为连接臂以减小空间位阻与胰岛素相连。Fc融合蛋白延长半衰期的方式不仅仅是增大相对分子质量减慢肾脏清除,还通过IgG与新生儿Fc受体(neonatal Fc receptor,FcRn)作用,增加体内循环,延长半衰期[23]。LAPSInsulin 115的血浆半衰期是德谷胰岛素的15倍,其降血糖功能可持续7 d[24]。根据文献报道,LAPSInsulin 115与胰岛素有相似作用,注射24 h后,在肝脏、骨骼肌和脂肪组织等主要靶组织中都发现存在胰岛素信号转导[24]。
1.3.2 相关的GLP-1类似物药物
LAPSCA-Exendin-4LAPSCA-Exendin-4(efpeglenatide)同样是由Hanmi Pharmaceutical公司研发的长效化GLP-1类似物,目前已进入Ⅲ期临床。将免疫球蛋白的Fc区以柔性非肽基聚合物为连接臂与氨基酸修饰过的艾塞那肽的27位氨基酸残基连接得到LAPSCA-Exendin-4[25]。临床发现,当艾塞那肽用于治疗2型糖尿病,会有37%~57%的患者产生免疫应答,而LAPSCA-Exendin-4含有的Fc片段能通过MHC II类抗原呈递之前的蛋白水解化片段使其降低免疫原性[26]。LAPSCA-Exendin-4与其他可用于2型糖尿病患者的药物相比具有最长的药物作用持续时间,平均半衰期超过150 h。超过60%的受试者的HbA1c降至目标值以下[27]。
杜拉鲁肽 杜拉鲁肽(dulaglutide)是由Lilly公司研发的每周给药的长效化GLP-1类似物,2014年获得FDA批准。杜拉鲁肽由两个具有DPP-4抵抗作用的GLP-1类似物与IgG Fc片段融合得到,减少了肾脏消除作用,半衰期为5 d。在大鼠实验中发现,长期给药杜拉鲁肽,有增加甲状腺C细胞肿瘤的风险,具有剂量依赖性和治疗时间依赖性。依据现有临床与非临床试验数据,尚不能确定是否会在人体引起甲状腺癌。在一项167名患者参与的为期12周的双盲临床试验中,杜拉鲁肽可以降低HbA1c水平,具有剂量依赖性,治疗2型糖尿病安全性高,具有较好的前景[28]。
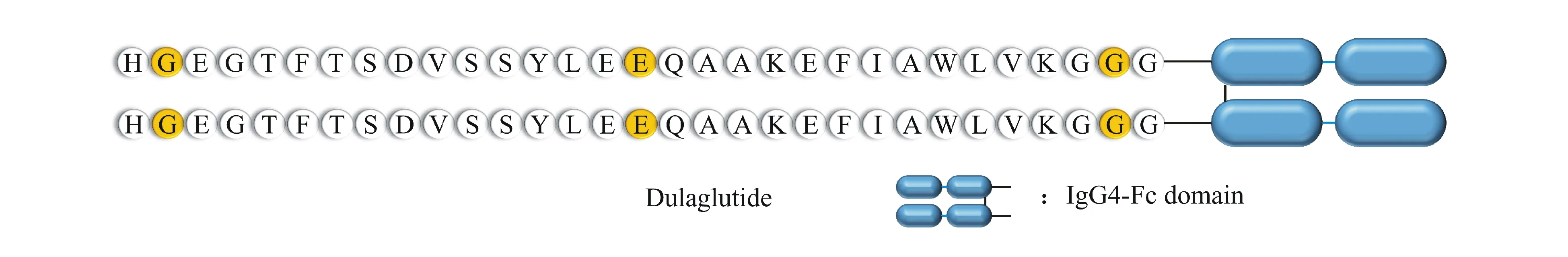
阿必鲁肽 阿必鲁肽(albiglutide)是由GSK公司开发的每周给药的长效GLP-1类似物,2014年获得美国FDA批准。阿必鲁肽由两个具有DPP-4抵抗作用的GLP-1类似物拼接后,缀和人血清白蛋白,具有减少肾脏过滤的效果[15]。在一项临床试验中,每周给药1次阿必鲁肽30 mg,可以明显降低HbA1c和FPG水平,降低幅度大于每天给药2次的艾塞那肽,但减轻体重效果不如艾塞那肽[29]。一项名为HARMONY的试验将阿必鲁肽和利拉鲁肽进行了对比,经过32周的治疗后,阿必鲁肽组的HbA1c降低0.78%,利拉鲁肽组降低0.99%,阿必鲁肽的注射部位反应略高于利拉鲁肽,但其胃肠道不良反应较轻[30]。

GSK2374697 GSK2374697是由GSK研发一种长持久力的GLP-1类似物,其是将缀合有血清白蛋白的抗体与艾塞那肽结合得到的基因工程融合蛋白,目前已进入Ⅰ期临床。GSK2374697的相对分子质量增大能减少肾脏清除,含有的抗体片段能与Fc受体结合,从而在抵抗酶的降解同时回收白蛋白进入血浆,半衰期在6 d左右[31]。单剂量使用GSK2374697能够降低餐后血糖,并延迟胃排空,但是多剂量下,延迟胃排空现象消失[31]。恶心现象以剂量依赖性出现,多剂量之后恶心等不良反应的耐受性明显减少[31]。
1.4 融合PEG片段
1.4.1 相关的胰岛素类似物药物
LY2605541 LY2605541由Lilly公司研发,但于2015年终止了Ⅲ期临床试验,推测是肝毒性影响[32]。当一个大的PEG聚合物链附着在胰岛素分子上,分子的流体动力学增加,从而更容易通过肝脏有孔毛细血管。将人胰岛素B链28位Pro和29位Lys对调,将20 KDa的PEG缀合到B链28位Lys上形成。PEG可增加溶解度,也能增加分子体积,从而减少肾脏滤过,半衰期为2~3 d[33]。研究表明,接受LY2605541的患者HbA1c水平降低,但与甘精胰岛素相比,LY2605541的低血糖发生率更高[34]。
1.4.2 相关的GLP-1类似物药物
LY2428757 LY2428757由Lilly公司和Amylin公司研发,为每周给药的长效化GLP-1激动剂,现已完成Ⅱ期临床试验。LY2428757是将一个或多个PEG聚合物与艾塞那肽上的Lys残基相连,从而降低免疫原性,抵抗蛋白酶水解,延长半衰期[35]。
1.5 融合新型长效化片段
1.5.1 相关的胰岛素类似物药物
PE0139 PE0139是由PhaseBio公司研发的每周给药的长效胰岛素,目前已经进入Ⅱ期临床。弹性蛋白样多肽(elastin-like peptide,ELP)是一种可合成的生物聚合体,其结构单元Val-Pro-Gly-X-Gly(VPGXG)n,“X”为除Pro外的任意氨基酸。ELP具有临界相转变温度(Tt),当溶液温度低于Tt时,ELP高度可溶;当温度高于Tt时,ELP聚集成不溶性微团聚体;当温度再次低于Tt时,ELP发生复溶。改变X残基和链长度可调节ELP的Tt。
将胰岛素的基因序列与合适长度的ELP生物聚合物序列融合,在大肠埃希菌中表达提取可得到PE0139。与ELP融合可以提高溶解度和生物利用度,同时保留了天然肽几乎相同的活性。皮下注射后可形成热诱导的凝胶贮库,缓慢释放胰岛素ELP融合蛋白。同时相对分子质量增加会减少肾小球滤过,并增强对酶剪切的抵抗能力。
1.5.2 相关的GLP-1类似物药物
VRS-859 VRS-859由Amunix最初研发,由Versartis公司推进Ⅰ期临床。研究人员设计了 1 500 多种非重复性的36个氨基酸基序的基因库,将这些基因随机连接并在E.coli中表达一系列聚多肽,通过考察基因稳定性、蛋白稳定性、热稳定性和聚集倾向,最终获得含864个残基的聚多肽,该聚多肽及其不同长度的衍生物统称为XTEN[36]。XTEN融合蛋白还具有可生物降解、免疫原性低和纯度高等特点。将XTEN864融合在该肽的C端并在E.coli中可溶表达,获得融合蛋白VRS-859,半衰期为128 h。据文献报道,VRS-859单次给药200 mg,其控制血糖作用可维持30 d,HbA1c水平显著降低,且未发现不良反应[36]。
2 通过制剂途径改善药物特性
2.1 甘精胰岛素U300
当人普通胰岛素浓缩时,其药代动力学和药效学作用特征改变,与正常浓度相比,高浓度胰岛素的起效时间相似,但由于需要从注射部位更长时间释放,降血糖效果比正常浓度的时间长。人普通胰岛素U500的降血糖效果延长至21 h,人普通胰岛素U100的降血糖时间为18 h[38]。可能解释为,与正常浓度的胰岛素相比,高浓度胰岛素可以在皮下形成更紧密的聚集体,减少了胰岛素分子离解的表面积,同时增加了胰岛素到毛细管的距离[39]。
Sanofi公司于2015年推出了甘精胰岛素U300(常用的甘精胰岛素为U100),其为甘精胰岛素每日一次的长效剂型。对于胰岛素耐受的患者,需要使用大剂量来控制血糖。为了减少注射体积,开发甘精胰岛素U300很有必要。甘精胰岛素U300的半衰期为19.0 h,而甘精胰岛素U100的半衰期为13.5 h[40]。甘精胰岛素U300的药代动力学作用曲线比甘精胰岛素U100平坦。然而,稳态时甘精胰岛素U300的生物效能比甘精胰岛素U100低27%[41],这表明在将患者从甘精胰岛素U100转换为甘精胰岛素U300时需要调整剂量。
2.2 艾塞那肽微球制剂
微球制剂是一种将多肽包裹,达到稳定释放的制剂方法。微球体的安全性和载药效率已经得到很好的确认。药物加载到微球表面或微球中,随着微球基质材料降解,药物稳定释放并起效,肽和蛋白质在释放前可以得到保护。但微球制剂必须皮下注射,这带来了很大的疼痛感导致患者顺从性降低。
Bydureon是由Amylin Pharmaceuticals研发的首款微球形式的长效化艾塞那肽产品。Bydureon微球是将艾塞那肽非采用油包水(W/O)溶剂蒸发法包埋在生物可降解的聚乳酸-羟基乙酸共聚物(PLGA)中。微球体的直径为0.06 mm,并且它们具有典型的“夹心葡萄干”形状和致密的表面层[42]。在比较试验中,与每日两次的艾塞那肽相比,Bydureon可以改善HbA1c和降低FPG,胃肠道不良反应更少,低血糖风险也不会增加,并且体重相应降低[43]。在一个为期2年的试验中,将单用噻唑烷二酮或联合二甲双胍治疗2型糖尿病与每周一次艾塞那肽微球的安全性进行比较。研究结果显示,艾塞那肽微球组的HbA1c和体重得到一致的改善[43]。然而,Bydureon微球表现出滞后期,完全释放需要长达7周的时间[44]。这种滞后期对药物的药代动力学和疗效有一定影响。
3 通过给药装置改善药物特性
3.1 胰岛素和GLP-1的常规给药装置
胰岛素给药的装置有多种,如注射器、笔注射器、泵等,选择取决于患者的生活方式和胰岛素的药理特性等[45]。胰岛素最初是通过注射器给药,其优点是成本低以及适用于各种剂型。然而注射器对于视力或灵活性受损的人来说不太方便。一次性或重复使用的胰岛素注射笔上市后受到患者的欢迎。其优点在于笔可以更好地控制递送的胰岛素剂量并且更易于使用,针头也较注射器短,这既降低疼痛感又使皮下注射更易操作。与注射器相比,笔装置在HbA1c变化,降低低血糖患者发生率方面表现更优。然而,用笔设备注射胰岛素悬浮制剂会发生显著剂量变化,未充分混合的悬浮液导致低血糖发生率更高[46]。
GLP-1受体激动剂在2005年以注射笔形式引入市场。开发注射用GLP-1药物时,安全性、有效性和患者依从性是选择装置时的关键考虑因素。
其他新型药物装置组合如微针、活性颊或透皮贴剂,这些给药系统处于临床前阶段。透皮给药的开发工作目前主要集中在微创微针贴片上,以避免传统透皮系统的低透皮通量[47]。
3.2 胰岛素闭环系统
闭环胰岛素输送系统是药物装置组合,可连续监测血糖,并通过输液泵装置输送胰岛素,模拟内源性胰岛素分泌的生理学作用[48]。闭环系统中含有一个动态的血糖监测器,该监测器每5~10分钟进行一次血糖监测,并向算法单元发送信号,算法单元控制泵装置通过插入患者皮下组织的套管向体内输送速效胰岛素。该系统的优点在于模拟体内胰岛素的释放,达到更好的血糖控制和更低的低血糖发生率。但闭环系统的插管部位可能引起皮肤感染,泵一旦故障有发生酮症酸中毒的风险。闭环系统的设备成本较高,且必须一直佩戴[49]。
2016年9月,FDA批准通过首个胰岛素闭环给药系统——美敦力MiniMed 670G胰岛素泵。该系统具有葡萄糖传感器和控制算法以自动化基础胰岛素输送,而患者仅需要补充进餐时间的胰岛素。泵和传感器完全集成,无需使用智能设备进行外部控制或监测。根据研究表明,124名患者使用670系统3个月后,HbA1c水平从7.4%下降至6.9%;低血糖的持续时间减少了44%;而高血糖持续时间则减少了11%[50]。闭环胰岛素输送系统目前用于1型糖尿病患者,2型糖尿病患者的临床研究正在进行中。
3.3 胰岛素吸入装置
为了解决注射给药带来的不便,许多公司开发了吸入装置。2006年,FDA批准了由Pfizer公司开发的首个速效胰岛素吸入制剂Exubera。其为重组人胰岛素的干粉吸入剂,使用专用吸入器经口腔吸入给药,将雾化的胰岛素送达肺部发挥降糖疗效。但研究发现,Exubera的效果并不比注射短效胰岛素好,而且额外的成本更高。在安全性方面,Exubera导致低血糖,糖尿病酮症酸中毒和呼吸系统不良事件发生率升高[51]。这些因素导致吸入式胰岛素市场表现不佳,最终辉瑞自愿退市。
尽管经历Exubera的挫折,胰岛素吸入装置的研发仍在进行。MannKind开发的Afrezza吸入装置于2014年获得批准[52]。Afrezza在设备设计和使用方便性方面与Exubera相比具有重要优势:它比Exubera小巧得多,并且胰岛素能够以单位给药[52]。Afrezza最常见的不良反应为低血糖、咳嗽、咽喉痛或咽部刺激症状,其安全性与Exubera类似,市场使用率仍需观察[52]。
3.4 艾塞那肽植入式渗透泵
ITCA 650由Intarcia公司研发并已向FDA递交申请。ITCA 650的外部尺寸为直径4 mm,长44 mm,其带有一个火柴棍大小的钛合金渗透微型泵,可在精确且可预设置的速率下以皮下注射的方式提供连续可控的艾塞那肽。细胞外液通过半透膜直接进入渗透引擎,所产生的压力以缓慢且平均的速度推动活塞,使药物制剂通过扩散调节器的孔释放[53]。ITCA 650的安装需要使用放置工具将无菌微型泵放置在腹壁下表面,这一过程通常由专业人员在患者良好耐受情况下以简单手术进行。在一项实验中,2型糖尿病患者用二甲双胍治疗效果不佳,接受ITCA 650每天20 μg治疗12周,然后每天60 μg继续治疗12周,发现HbA1c平均降低1.4%,体重平均减轻3.1 kg[54]。
4 胰岛素和GLP-1联合给药和药物装置
胰岛素和GLP-1组合疗法能够降低胰岛素使用量、改善血糖控制、降低低血糖发生率和中等体重减轻等诸多益处,同时还能减少注射次数和频率[55]。Novo Nordisk公司开发的IDegLira,是一种固定剂量的德谷胰岛素和利拉鲁肽的组合[56]。与仅使用GLP-1或胰岛素的患者相比,IDegLira的Ⅲ期临床结果显示联合产品在降低HbA1c方面具有优异的疗效[57]。与胰岛素治疗患者相比,联合治疗没有体重增加。2014年,IDegLira作为欧洲联合产品获得上市许可。LixiLan是由Sanofi公司开发的利西拉来和甘精胰岛素药物组合装置。2016年11月,FDA批准了IDegLira和LixiLan。随着每周1次和每月1次注射的GLP-1药物和每周一次胰岛素的发展,胰岛素和GLP-1组合剂型的研发空间具有很大潜力。
5 总结与展望
胰岛素和GLP-1类似物领域目前的研究成果极大地提高了糖尿病患者的生活质量和生命预期。其未来研究方向仍然是更快的起效速度,更长的作用时间,更平坦的作用曲线以及提高安全性和便利性。在胰岛素治疗中,低血糖风险仍然存在,因此葡萄糖响应性胰岛素类似物可能发展成下一代胰岛素类似物[58]。胰岛素和GLP-1类似物的长效化策略众多,在分子构建方面,氨基酸修饰、缀合脂肪酸链、利用单克隆抗体片段以及注射后形成缓释库等手段都能有效地提高了药物的半衰期。在药物制剂途径方面,将药物浓缩以达到长期释放以及药剂的缓释控释手段如艾塞那肽微球制剂,能够有效地提高药物的作用时间。采用苯硼酸类糖敏感材料应用于胰岛素控释系统中,等[59]。在给药装置方面,具有稳定释放和可植入缓释库的给药装置以及胰岛素闭环设备能提高胰岛素和GLP-1类似物糖尿病治疗的便利性。学术界和工业界正在研究如吸入、透皮和口服等注射给药的替代方案,其中索马鲁肽的口服制剂研究进展最快,已进入Ⅲ期临床,多肽类药物口服给药将指日可待。

