2017年中国天然产物化学研究进展(下)
杨国勋,熊 娟,胡金锋
(复旦大学药学院天然药物化学教研室,上海 201203)
(接上期)
5 甾 体
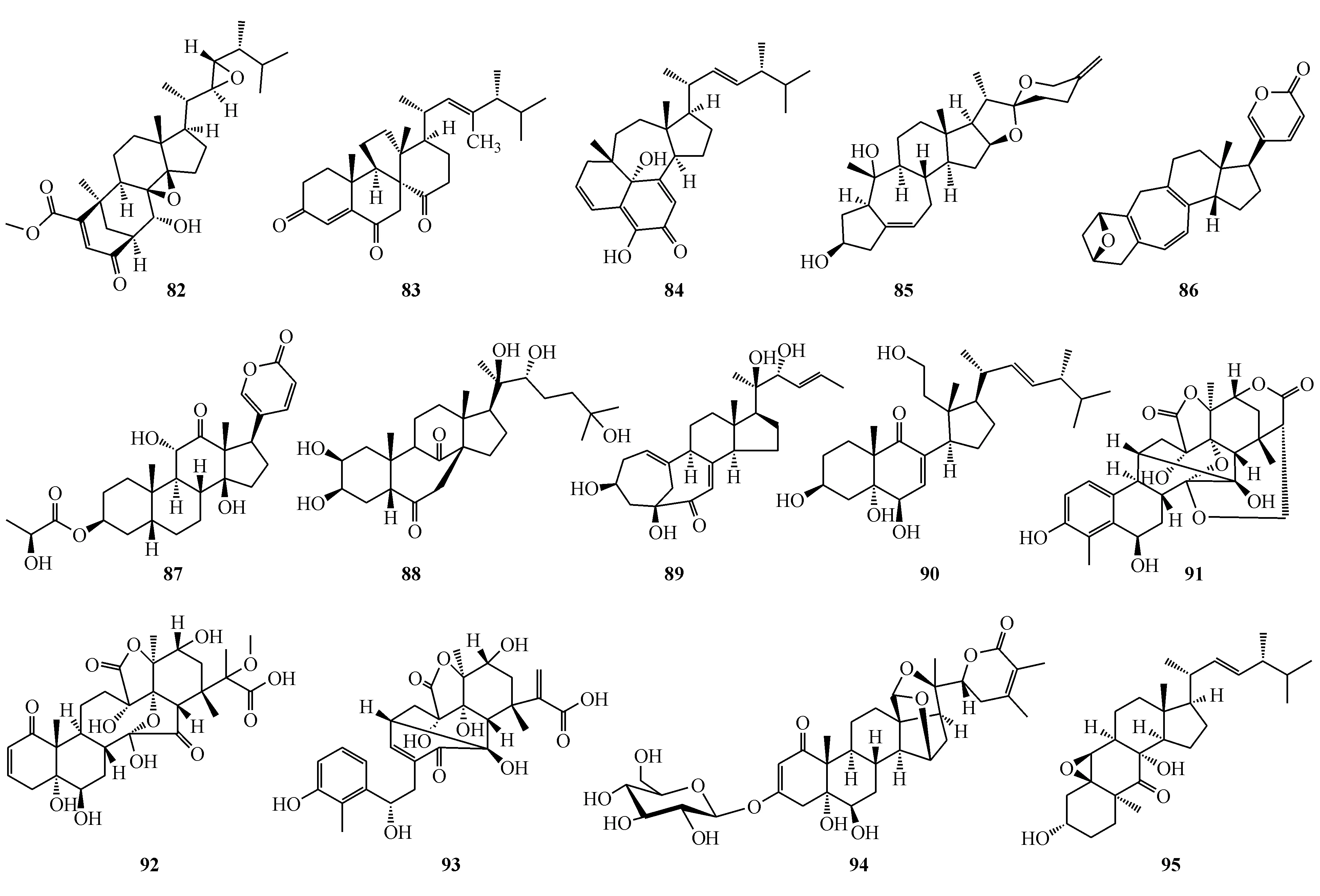
Phomopsterones A(82)和B(83)是从植物来源的拟茎点霉Phomopsissp.TJ507A分离得到的两个麦角甾烷类化合物。化合物82是罕见的具有重排双环[3.3.1]壬烷片段的麦角甾醇。化合物83具有抗炎作用[73]。Ganotheaecolin A(84)是从茶病灵芝(Ganodermatheaecolum)的子实体中分得,为具有6/6/7/5-环合碳骨架的麦角甾醇[74]。
Bufospirostenin A(85)和bufogargarizin C(86)为A/B环重排的甾体类化合物,是从中华大蟾蜍的胆汁和毒液中分离而得[75]。2′S-Arenobufagin-3-O-lactate(87)是从中华大蟾蜍(Bufobufogargarizans)的卵中分离而来,为首次发现的结合了乳酸的蟾毒内酯结构,其对人胃癌细胞BGC-823和人肺癌细胞A549显示强抑制作用,IC50分别为12.2和8.9 nmol/L[76]。Aspafilisine(88)具有独特的C(7)-C(14)连接的重排七元B环结构特征,是从羊齿天门冬(Asparagusfilicinus)的根中分离而来[77]。Neocyclocitrinol E(89)是从蛇足石杉(Huperziaserrata)内生菌Chaetomiumsp.M453的固相发酵物中分离到的罕见C25甾体[78]。Ganoderin A(90)是从灵芝(Ganodermalucidum)孢子油分离得到[79]。Aromaphysalin A(91)为睡茄素类(withanolide)化合物,具有异乎寻常的C(11)-C(15)化学键以及4,9-环合的重排骨架,是从苦蘵(Physalisangulata)的茎叶中分离得来。此外,化合物91对NO生成具有抑制作用,IC50为51.6 μmol/L[80]。Physalin X(92)和aromaphysalin B(93)为两个酸浆苦素类(physalin)化合物,也是从苦蘵中分离而来。二者均具有抑制LPS诱导巨噬细胞中NO生成的作用,IC50分别为68.5和29.7 μmol/L[81]。Withapubeside B(94)具有笼状结构片段和烯醇葡萄糖苷片段,是从毛酸浆(Physalispubescens)中分离而来[82]。Matsutakone(95)具有全新的多环甾醇类化合物,是从松口蘑(Tricholomamatsutake)的子实体中分离得来。该化合物显示AChE抑制作用[83]。
6 生物碱
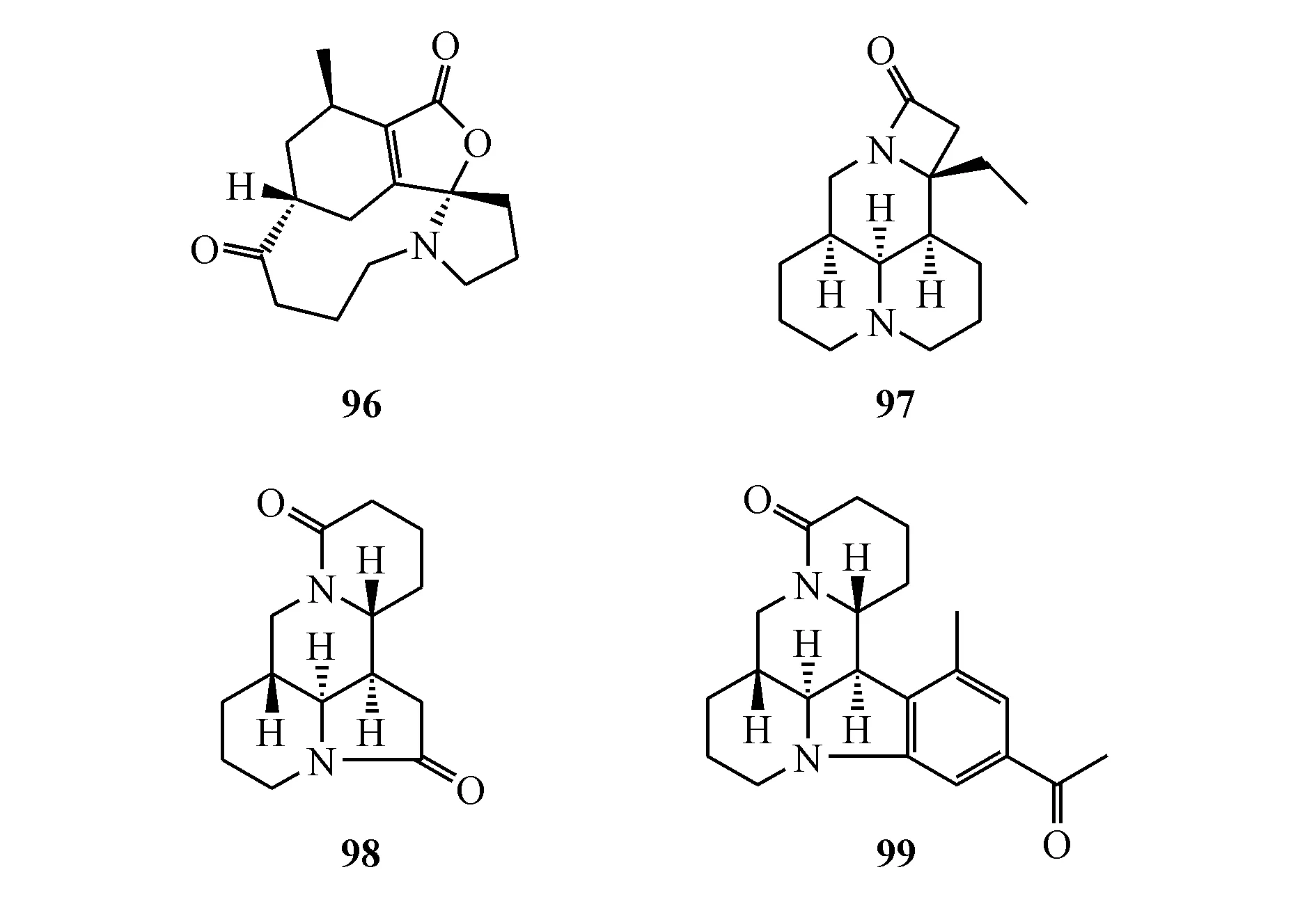
从扁枝石松(Lycopodiumcomplanatum)中分离得到的lycoplanine A(96),是较强的T型钙离子通道Cav3.1的拮抗剂,IC50为6.1 μmol/L[84]。从苦豆子(Sophoraalopecuroides)的种子中发现几个苦参碱型生物碱:sophalines A(97)和B(98)分别具有全新6/6/6/4和6/5/6/6环系分子骨架;而sophaline C(99)则是一个苦参碱-乙酰苯杂合生物碱。化合物98和99在0.4 mmol/L无细胞毒作用浓度下显著抑制乙肝表面抗原(HBsAg)的分泌超过50%,强于阳性对照物拉米夫定(拉米夫定在1.0 mmol/L下抑制率为31.5%)[85]。
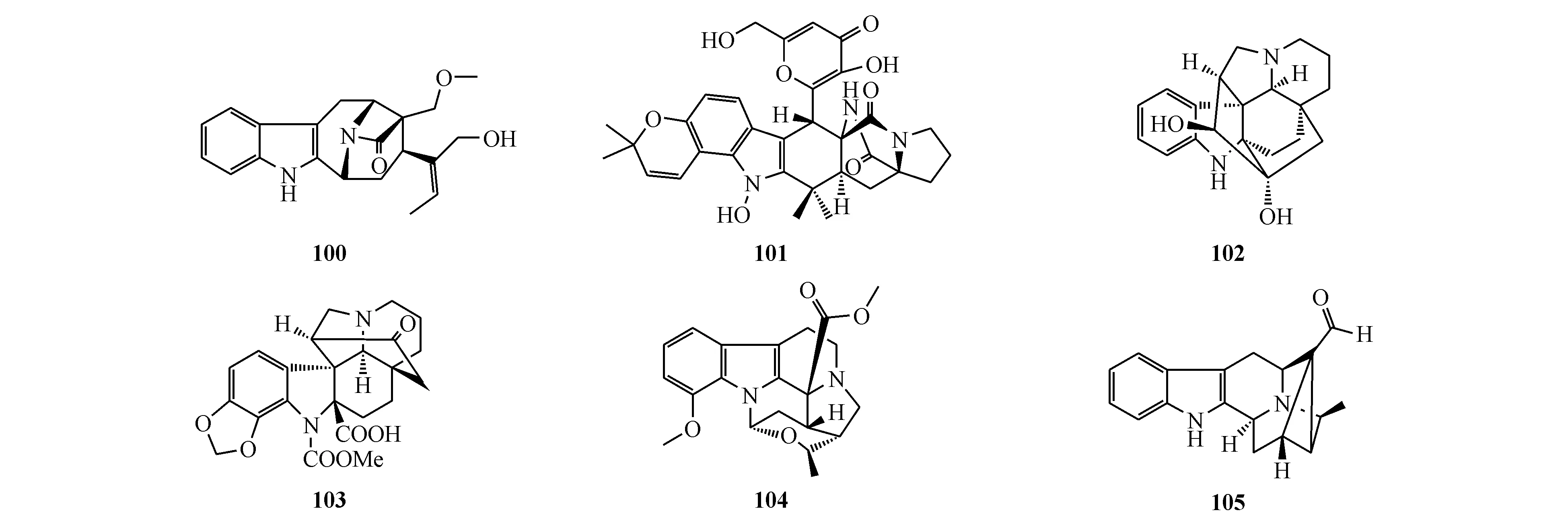
Khasuanine A(100)是从景东山橙(Melodinuskhasianus)的根中分离得到的一个单萜吲哚生物碱。它可以明显抑制PC3细胞增殖,IC50为0.5 mol/L;并能够通过激活半胱天冬蛋白酶3(caspase 3)和p53,抑制Bcl-2而引起PC3细胞凋亡[86]。Versicoamide F(101)是从曲霉属真菌Aspergillustennesseensis中分离得到,它对H460细胞显示弱的抗增殖作用[87]。单萜吲哚生物碱kopsinidine C(102)和11,12-methylenedioxychanofruticosinic acid(103)是从云南蕊木(Kopsiaofficinalis)的茎叶中得到分离[88]。Alstrostine G(104)是从盆架树(Alstoniarostrata)中分离到的含有全新的6/5/6/6/5/6-环系的化合物[89]。Rauvomine B(105)分离自催吐萝芙木(Rauvolfiavomitoria)的地上部分,是一个带有取代环丙烷的C18降碳单萜吲哚生物碱。此外,化合物105具有显著抗炎作用[90]。
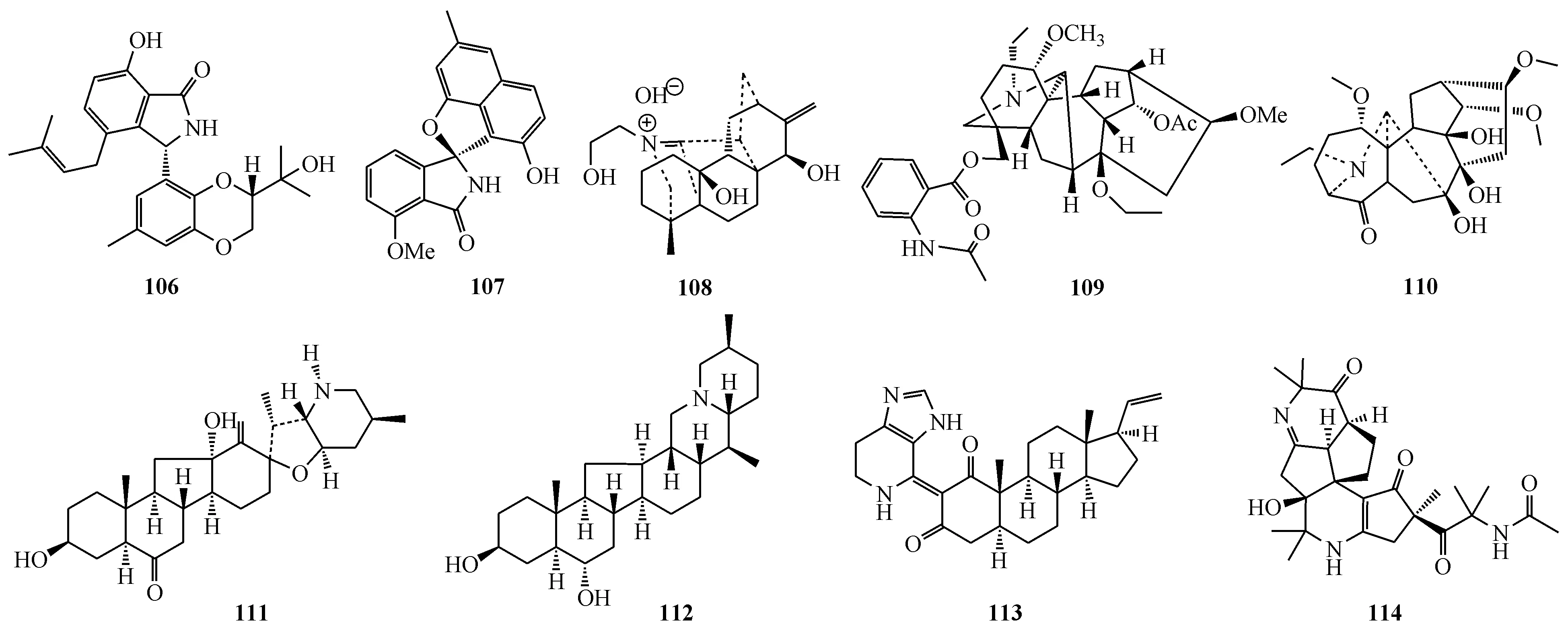
从红树内生菌Diaporthesp.SYSUHQ3中分离得到的生物碱diaporisoindole A(106)为异戊烯基取代的异吲哚类生物碱。它对结核杆菌蛋白酪氨酸磷酸酶B有抑制作用,IC50为4.2 μmol/L[91]。从海洋放线菌StreptomycespratensisKCB-132得到三对包含全新的螺环吲哚酮-萘并呋喃骨架的光学对映生物碱。其中,(±)-pratensilin A(107)对一小组肿瘤细胞显示中等细胞毒作用[92]。
Aconicarmicharcutinium A(108)属于稀有的arcutine型C20二萜生物碱,是以季铵碱的形式从乌头(Aconitumcarmichaelii)的侧根中分离得到[93]。Apetaldine A(109)是分离自空茎乌头(Aconitumapetalum)的C19二萜生物碱[94]。Sinomontadine(110)为高乌头(Aconitumsinomontanum)中分离而来的C18-二萜生物碱。它具有全新的A环为七元环的碳骨架[95]。Walujewines A(111)和C(112)属于异甾体生物碱,都是从新疆贝母(Fritillariawalujewii)的鳞茎中分离而得。此外,化合物111显示对AChE高度选择性抑制而化合物112则是强AChE-BChE双重抑制剂[96]。Scleronine(113)是从中国软珊瑚Scleronephthyasp.中分得的包含spinaceamine单元的孕甾烷。它具有显著抑制肿瘤细胞A549和B16迁移的作用[97]。
(+)-Tishaviolamine A(114)具有全新的6/5/5/6/5含氮杂环骨架特征,是从天山堇菜(Violatianschanica)中分离得到[98]。Conipyridoin E(115)分离自真菌Coniochaetacephalothecoides的固态培养物中,它对金黄色葡萄球菌及MRSA均有强抑制作用,MIC为1.0 μmol/L[99]。Gunnilactam A(116)为大环四内酰胺类化合物,是从无性型古尼虫草(Cordycepsgunnii)的昆虫寄生真菌古尼拟青霉(Paecilomycesgunnii)的发酵物中分得。化合物116对前列腺肿瘤细胞C42B具有选择性细胞毒作用,IC50为5.4 μmol/L[100]。从海洋来源的异壁放线菌(ActinoalloteichuscyanogriseusWH1-2216-6)的发酵物中得到一个5,5,6-多环含特特拉姆酸大环内酰胺(PTMs)的化合物16-hydroxymaltophilin(117),它对一小组人肿瘤细胞显示抑制作用,IC50范围为4.5~9.7 μmol/L[101]。Dahurelmusin A(118)是一个肽-聚酮的杂合体,是从感染了内生菌Epichlo⊇bromicola的披碱草(Elymusdahuricus)中分离。化合物118对稻麦蚜Rhopalosiphumpadi以及菜蚜Brevicorynebrassicae均具有杀灭作用,LC50分别为0.1和0.3 mmol/L[102]。
(+)-Nigegladine A(119)和(-)-nigegladine A为一对百里香醌二聚体的光学对映体,是从腺毛黑种草(Nigellaglandulifera)的种子中分离得到。二者对缺氧/复氧引起的H9c2心肌细胞损伤显示显著保护作用[103]。(±)-Uncarilin B是从钩藤(Uncariarhynchophylla)中分离而来的一对独特的具有对称四元核心结构的光学对映isoechinulin型二聚体。(-)-Uncarilin B(120)在0.25 mmol/L浓度下对褪黑激素受体MT1和MT2显示竞争性结合作用,竞争结合率分别为11.3%和52.4%[104]。Tabercorymines A(121)和B为两个具有新骨架的vobasinyl-ibogan型双吲哚生物碱,是从伞房狗牙花(Tabernaemontanacorymbosa)中分离而来。两者对包括长春新碱耐药的KB等几株人肿瘤细胞显示出较强的抗增殖作用[105]。Hunterizeyline F(122)是从仔榄树(Hunteriazeylanica)茎叶中得到的双吲哚类[106]。(±)-Peharmaline A(123)为罕见的-咔啉-鸭嘴花酮碱杂合的外消旋混合物,是从骆驼蓬(Peganumharmala)的种子中分离得到。它对肿瘤细胞HL-60、PC-3和SGC-7901具有抑制作用,IC50分别为9.2、21.6和25.4 μmol/L[107]。
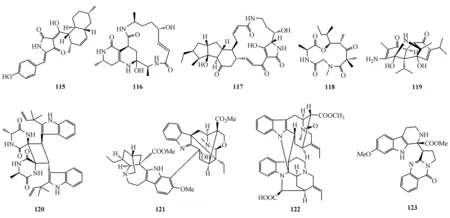
双吲哚生物碱Gelsekoumidine B(124)是从钩吻(Gelsemiumelegans)根中得到的一对阻旋异构体(124a/124b)。化合物124代表着第1个裂环钩吻素子-钩吻定类型的二聚化生物碱。其对LPS诱导RAW 264.7细胞中NO的生成具有中等抑制作用,IC50为33.2 μmol/L[108]。
Penicisulfuranol A(125)是从红树内生菌微紫青霉(PenicilliumjanthinellumHDN13-309)分离而来的一个多硫代二酮哌嗪类生物碱。该化合物对肿瘤细胞HeLa和HL-60显示出细胞毒作用,IC50分别为0.1和0.5 μmol/L[109]。Streptopertusacin A(126)为一个独特的以两性离子存在的indolizinium生物碱,是从海藻来源的链霉菌Streptomycessp.HZP-2216E的培养物中分得。它对MRSA显示中等抑制作用[110]。
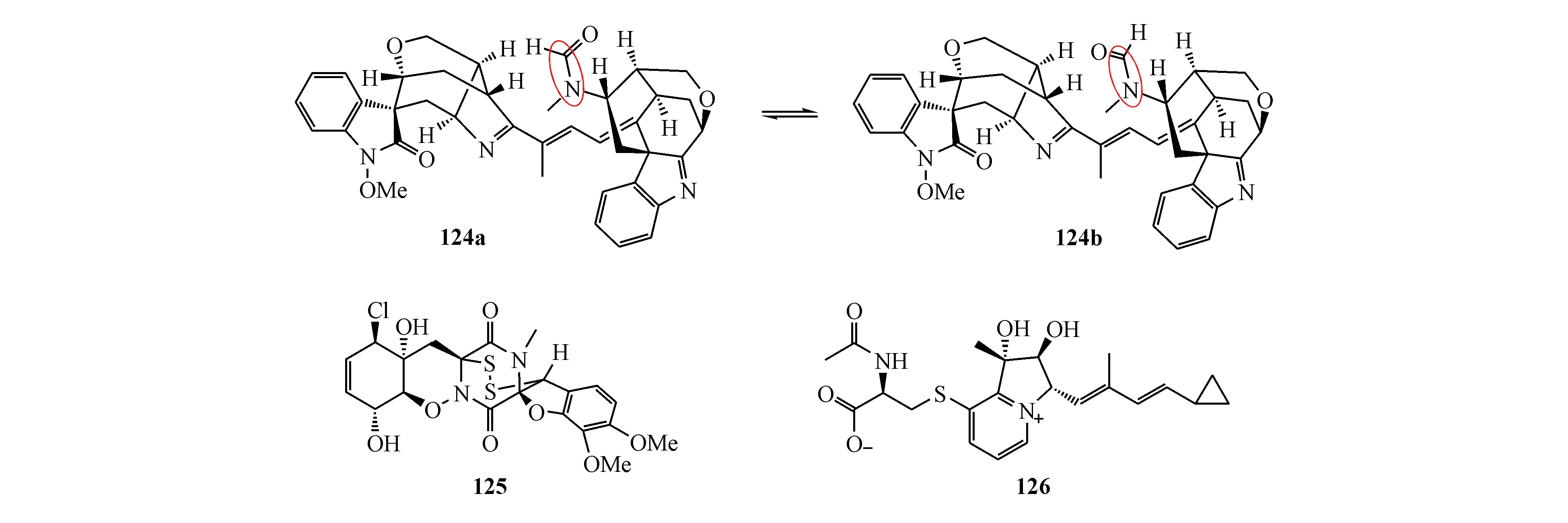
细胞松弛素(cytochalasan,亦称松胞素)类化合物通常是由真菌代谢产生。从黄柄曲霉(Aspergillusflavipes)的培养物中分离到一系列杂合松胞素。其中,aspergilasine A(127)具有全新的含环丁烷片段的笼状五环[7.2.0.14,11.02,7.05,10]十二烷骨架结构[111];asperflavipine A(128)具有两个松胞素单元和两个epicoccine单元,是已发现的首例松胞素杂四聚体;asperflavipine B(129)含一个松胞素单元和两个epicoccine单元。化合物128具有中等细胞毒作用,通过激活半胱天冬酶3(caspase-3)以及降解多聚腺苷二磷酸核糖聚合酶(PARP)从而诱导Jurkat、NB4和HL60在内的肿瘤细胞凋亡[112]。从海洋等足动物Ligiaoceanica肠道真菌Aspergillussp.的培养物中发现的aspochalazine A(130)是一个多环aspochalasin类松胞素型化合物。该化合物是第1个具有氮杂双环的aspochalasin衍生物[113]。
7 聚 酮
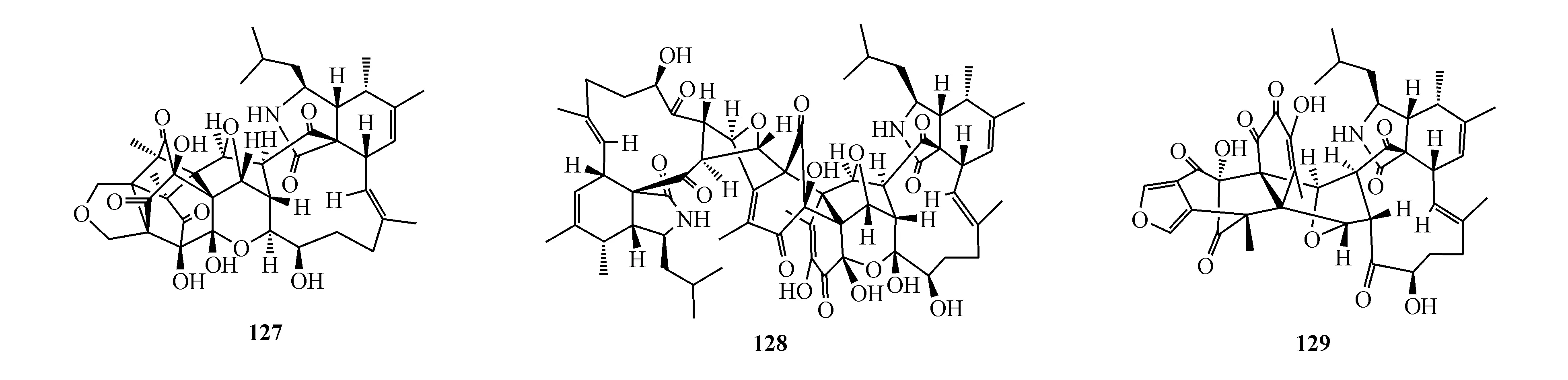
Libertalide D(131)是从珊瑚来源真菌Libertasomycessp.发酵产物中分得。它可以显著诱导CD3+T细胞增殖[114]。通过生物活性引导分离从植物来源真菌Emericellasp.TJ29的培养物中得到化合物varioxiranediol A(132),该化合物具有抑菌和杀菌作用[115]。
8 其 他
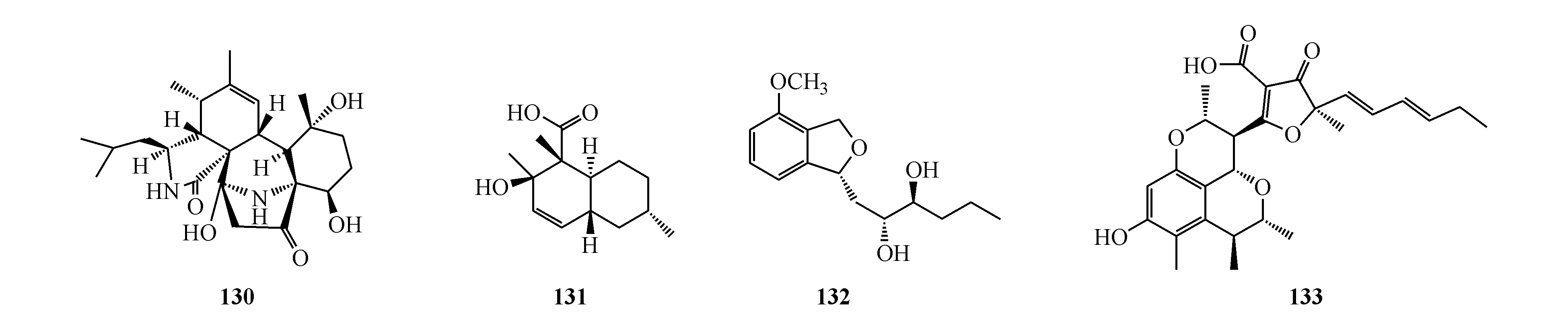
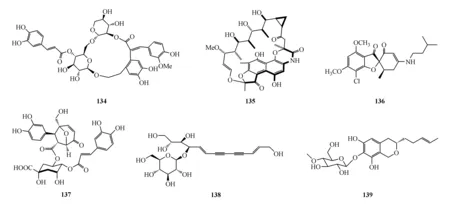
Citrifuran A(133)是蜈蚣肠道真菌Aspergillussp.的代谢产物,其对LPS诱导RAW264.7细胞生成NO具有中等抑制作用,IC50为18.3 μmol/L[116]。Forsythenethoside A(134)从连翘(Forsythiasuspensa)的果实中分得,它对撤除血清诱导的PC12细胞损伤显示强保护作用[117]。Rifamorpholine B(135)是从蝗虫相关的稀有放线菌Amycolatopsissp.HCa4的培养物中分得,该化合物对MRSA具有强抑制活性,MIC为4.0 μmol/L[118]。从灰黄青霉(PenicilliumgriseofulvumCPCC 400528)的发酵物中分离到4′-demethoxy-4′-N-isopentylisogriseofulvin(136)。该化合物为灰黄霉素的衍生物,具有抗HIV作用,IC50为33.2 μmol/L[119]。Chrysanthemorimic acid A(137)是从杭白菊(Chrysanthemummorifolium)的花中分离而来,它在10 μmol/L对H2O2引起的SH-SY5Y细胞损伤具有显著保护作用[120]。从苍术(Atractylodeslancea)的根茎分离得到化合物138。该化合物在10 μmol/L时对α-葡萄糖苷酶及PTP1B显示微弱抑制作用[121]。对昆虫病原真菌Metarhiziumrobertsii进行表观遗传调控因子的广泛基因删除,发现由于组蛋白乙酰转移酶基因Hat1的破坏意外激活孤儿次生代谢产物基因。此研究最终导致包括meromuside A(139)在内的8个类异香豆素的发现[122]。
9 结 语
综上可见,2017年我国天然产物化学工作者取得了许多重要成果,发现一批结构更加复杂和(或)生物活性更加突出的天然化学成分。受篇幅所限,部分相关研究成果未能在此得到归纳总结。特别需要指出的是,2017年我国天然产物化学研究在高活性药物先导化合物的发现及复杂天然产物化学结构的解析等方面,均取得了较好成果。比如,所发现的乌药烷型倍半萜fortunilide A对氯喹耐受恶性疟的抑制作用与青蒿素作用相当,较有希望成为一个有别于氯喹/青蒿素分子骨架类型的新型抗疟先导化合物[12];二萜化合物nepetaefolin F在体外试验中具有媲美紫杉醇的抗肿瘤活性[17],前景可期;蟾毒内酯类衍生物2′S-arenobufagin-3-O-lactate对人胃癌细胞BGC-823和人肺癌细胞A549均有超强的细胞毒作用[76],值得关注;而黄柄曲霉(Aspergillusflavipes)中多个复杂的松胞素杂聚体的化学结构得到成功解析[111-112],展现出中国学者在复杂天然产物结构鉴定方面的研究能力和水平。
与欧美国家和日本相比,中国学者在天然产物化学研究领域的工作毫不逊色。在多种本领域国际刊物上,中国学者论文的数量不但稳居前列,而且研究内容的深度和广度也在明显提升:①分离方面,微量复杂成分的分离已成常态,光学对映体常常得到拆分;②结构解析方面,在综合运用波谱学技术解析分子平面结构及相对构型的基础上,往往结合化学衍生化、ECD计算、X射线单晶衍射等方法进一步确定天然产物的绝对构型;③生物活性研究方面,依靠生命科学日新月异的进步,广泛采用新方法、新药物靶标对天然成分进行生物学功能评价;④复杂天然产物的全合成方面,通过基因调控方法获得目标分子或寻找新类型化合物等方面的工作亦可圈可点。相关学科的进步、多学科交叉渗透极大地促进了天然产物研究的繁荣。新技术、新方法、新策略的引进,不断推进人类认识天然产物分子结构多样性、生物功能多样性及复杂生物体系分子间的相互作用的极限。
事实上,大自然仍旧是最好的化学家,她所提供的结构新颖和多样的天然产物是新化学实体(New Chemical Entity)的重要来源。随着分离和分析新技术的发展与应用,天然药物先导化合物研究的高成本和长周期等问题均得到较大改善,尤其体现在大型“类药性”天然产物样品库的建立、微量活性成分的分离和快速结构鉴定上[123-124]。众所周知,生物多样性是化学多样性的前提。研究和统计表明,珍稀濒危植物代谢所产生的天然产物的结构多样性及其成药性远高于一般植物的平均水平[125-126]。但由于人口增长、气候变化以及人类活动等影响,自然界物种灭绝导致生物多样性在不断减少。珍稀濒危植物往往处于极端或特殊的生长环境,它们能产生结构和/或活性特殊的新型化学生态功能分子;不仅如此,它们还富含复杂而又独特的微生物组(内生菌)。珍稀濒危植物宿主及其内生菌的次生代谢产物是发现具有新颖结构和独特作用机制的创新药物的重要来源,在国际上正引起高度重视[125-127]。目前,全球已知植物物种中至少有13%被视为处于渐危或濒危状态,这一情况在中国尤为严重[128-131]。濒危植物处于物种灭绝的边缘,因此,亟需对这些珍稀物种潜在的抗重大(或恶性)疾病的活性化合物进行系统研究(甚至抢救性研究);研究成果将积极促进对这些宝贵但相对比较脆弱的植物资源的科学保护和利用(乃至深度开发),以对抗人类未来可能持续出现的新型疾病。作者所在课题组近几年率先在这方面开展了一系列探索性研究工作[132],这些研究结果将为从我国特有珍稀濒危药用植物宿主及其内生菌中开发新型药物先导化合物奠定基础。
总之,结构新颖与多样的天然产物无论对化学生物学和有机化学学科的发展还是对药物研发均具有重要意义与独特价值。创新药物的研发不仅在于新靶标的发现与功能确证,亦取决于被筛化合物的结构新颖性和多样性。利用天然活性化合物作为小分子探针对恶性疾病相关基因/蛋白进行化学生物学等方面的深入研究,进一步发现与确证该基因/蛋白靶标的功能,探讨相关发病机制;同时为找到治疗该恶性疾病的药物先导化合物提供新的线索和科学依据,这也是后基因组时代创新药物研发的最新途径之一。

