鱼源嗜水气单胞菌和维氏气单胞菌PCR-RFLP鉴别方法的建立
郭 睿
(福州市海洋与渔业技术中心,福建福州 350026)
气单胞菌(Aeromonasspp.)是一种遍布水环境的革兰阴性杆菌,是水生动物和包括人在内的多种陆生动物的条件致病菌,属于气单胞菌科(Aeromonadaceae),目前已明确鉴定到种的有26种[1-2]。大体分为两类:一类是不具运动性的嗜冷气单胞菌,以杀鲑气单胞菌(A.salmonicida)为代表;另一类是具运动性的嗜温气单胞菌,包括常见的嗜水气单胞菌(A.hydrophila)、维氏气单胞菌(A.veronii)等[3],其中一部分是运动性气单胞菌败血症(MotileAeromonassepticemia,MAS)的主要病原,严重危害淡水鱼养殖[4]。这些细菌一般是条件致病菌,鱼类感染后会出现非特定体征,如鳍条腐烂、溃疡、出血、凸眼、水肿等[5]。
在气单胞菌的鉴定上,采用传统的细菌形态分类和生理生化鉴定费时费力,而且对血清型复杂、生化特征不稳定的病原菌容易发生误判[6],而使用分子生物学方法,具有快速、准确、灵敏度较高等优点,其中在基因序列分析基础上发展的聚合酶链反应-限制性(核酸内切酶酶切)片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)分子标记技术具有较好的应用前景,选取常规和应用广泛的16 S rDNA基因,进行PCR-RFLP分析,在种水平鉴定气单胞菌是一种快速和有效的方法[7-10],已有较多研究应用16 S rDNA PCR-RFLP对气单胞菌进行鉴定,其中大部分是医学临床菌株,在内切酶的选择上大多使用AluⅠ和MboⅠ进行双酶切[5,10-14],但这一双酶切是为了对当时所有气单胞菌种进行分类鉴定,使得每一种菌对应一种RFLP带型[7-8],其带型较为复杂,对于临床和水产上常见的致病菌针对性不强[9],有时为提高电泳分辨率还要用到聚丙烯酰胺凝胶电泳[5,13],不适用于快速鉴定。对于水产鱼源常见气单胞菌有必要选择针对性较强的内切酶开展16 S rDNA PCR-RFLP,以达到快速鉴别菌种的目的。
本文选取福建地区养殖场分离的12株鱼源致病气单胞菌,通过对16 S rDNA序列的分析,结合GenBank中相关致病菌株的序列,筛选出鉴别嗜水气单胞菌和维氏气单胞菌的限制性核酸内切酶,用PCR-RFLP分子标记的方法对这2种气单胞菌的鉴别,可用于对于水产鱼类嗜水气单胞菌和维氏气单胞菌病害的快速鉴别检测。
1 材料与方法
1.1 材料
1.1.1 菌株来源 试验用12株鱼源致病气单胞菌,包括嗜水气单胞菌5株,维氏气单胞菌6株,温和气单胞菌(A.sobria)1株,其中1株嗜水气单胞菌(CHS-3)和2株维氏气单胞菌(AH13-3,HB-2)由福建省农业科学院生物技术研究所馈赠,1株嗜水气单胞菌(JS)由福建省淡水水产研究所馈赠,其余8株由笔者所在福州市水生动物疫病预防控制中心鉴定保种(表1)。
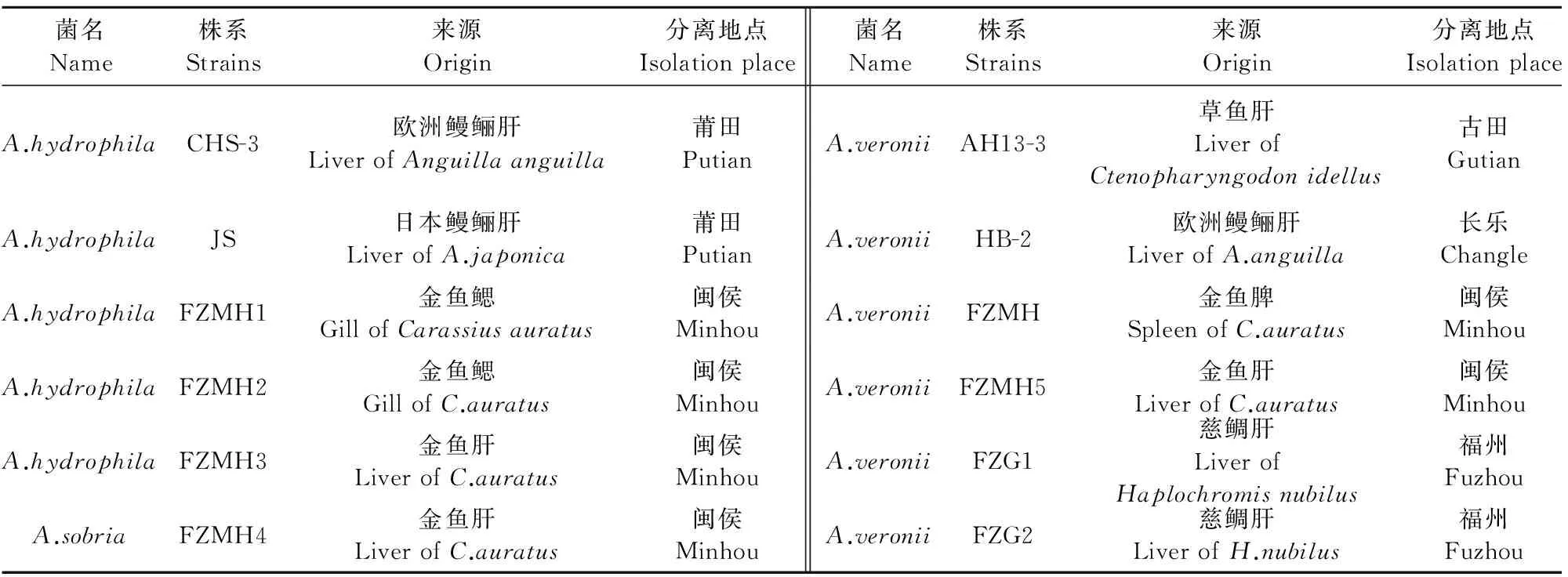
表1 12株气单胞菌菌株来源
1.1.2 主要试剂 营养肉汤(NB)培养基,广东环凯微生物科技有限公司产品;细菌基因组DNA提取试剂盒,北京百泰克生物技术有限公司产品;2 ×TaqPCR Master Mix、DNA标准DL 2 000,天根生化科技(北京)有限公司产品;琼脂糖,英国OXOID公司产品;限制性核酸内切酶SnaBⅠ、BseNⅠ、NruⅠ,美国Fermentas-Thermo Scientific公司产品。其他试剂均为国产分析纯。
1.2 方法
1.2.1 16 S rDNA序列测定与系统发育分析
1.2.1.1 PCR模板的制备 将纯化培养后的菌株无菌挑取单克隆于NB中培养24 h,取2 mL菌液10 000 r/min离心30 s;收集菌体,按照细菌基因组DNA提取试剂盒提取基因组DNA,作为PCR模板,置-20℃保存备用。
1.2.1.2 16 S rDNA基因序列的扩增与测序 细菌16 S rDNA通用引物,27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),退火温度50℃,目的片段大小约1 500 bp。PCR反应体系(50 μL)包括:2 ×TaqPCR Master Mix 25 μL,25 mmol/L的引物各1 μL,模板DNA 1 μL,用超纯水调整终体积至50 μL。反应结束后按常规琼脂糖凝胶电泳方法进行检测。PCR产物经ABI 3730 DNA 测序仪测序后,用Mega 5.2对测序结果进行校正。
1.2.1.3 系统发育树的构建 将菌株的16 S rDNA基因序列与GenBank中已公布的核酸序列进行在线Blast分析(http://blast.ncbi.nlm.nih.gov/),调出与该序列同源性较高的核酸序列,并参照LPSN(http://www.bacterio.cict.fr/a/aeromonas.html)下载气单胞菌属的部分相关模式菌株的16 S rDNA基因序列及同种不同株系的16 S rDNA基因序列。将上述序列使用Mega 5.2完成序列比对后,以大肠埃希菌(Escherichiacoli)和霍乱弧菌(Vibriocholerae)为外群,采用临接近法(Neighbor-Joining method,NJ)构建系统发育树,通过自举分析(Bootstrap)进行置信度检测,自举次数1 000次,以估算其内分支的支持率。
1.2.2 限制性片段长度多态性分析
1.2.2.1 序列分析和限制性内切酶的筛选 采用DNA Man Version 6对嗜水气单胞菌、温和气单胞菌和维氏气单胞菌的16 S rDNA的测序结果进行比对,并结合GenBank中相关菌株的序列,应用引物设计软件Primer 5.0查找序列中的可用酶切位点并筛选其中高度稳定的位点,使用在线Fast Digest Enzyme Selection Tool选取合适的限制性核酸内切酶。
1.2.2.2 PCR制备酶切底物和16 S rDNA-RFLP分析 PCR体系和参数同上,经琼脂糖凝胶电泳检测PCR产物,将检测良好的产物用于后续酶切试验。依据限制性核酸内切酶的说明书,在冰上配制酶切反应体系(15 μL),每管反应体系加入PCR产物5 μL进行酶切,反应参数按照说明书分别设置。酶切结束后进行琼脂糖凝胶电泳,电泳后使用凝胶成像系统显现目的条带,对3种气单胞菌的酶切电泳图谱进行PCR-RFLP分析。
2 结果
2.1 序列分析与系统发育树的构建
12个菌株的16 S rDNA基因测序结果经校正后获得约1 500 bp,其中嗜水气单胞菌的序列(GenBank登录号为KC812104、KC812105、KC812106、KF483980、KF483982)和维氏气单胞菌的序列(GenBank登录号为KC633849、KY767546、KY767547、KY767548、KY767550、KY767551),分别与GenBank中多株嗜水气单胞菌和维氏气单胞菌的16 S rDNA基因序列高度同源,同源性达到99%以上;作为参考的温和气单胞菌序列(GenBank登录号为KY767549)与GenBank中温和气单胞菌的16S rDNA基因序列高度同源,同源性达到99%以上(图1)。
采用NJ法基于16 S rDNA基因序列构建的系统发育树,本试验的5株嗜水气单胞菌、6株维氏气单胞菌和1株温和气单胞菌分别与已报道的同一种气单胞菌聚为一大支,其中嗜水气单胞菌和豚鼠气单胞菌(A.caviae)构成姊妹群,维氏气单胞菌与简达气单胞菌(A.jandaei)构成姊妹群,杀鲑气单胞菌和兽生气单胞菌(A.bestiarum)依据16 S rDNA序列不能区分,二者一起与温和气单胞菌构成姊妹群(图1)。

图1 12株气单胞菌与同属相关种之间基于16 S rDNA基因序列的系统发育树
2.2 限制性核酸内切酶的选择及PCR-RFLP分析
经比对,发现所扩增的3种气单胞菌的16 S rDNA基因序列同源性为99.1%。依据16 S rDNA基因的种间序列差异,选取限制性核酸内切酶SnaBⅠ,酶切位点为TAC↓GTA,可酶切嗜水气单胞菌中的特异序列;选取限制性核酸内切酶BseNⅠ,酶切位点为ACTGGN↓,可酶切3种气单胞菌中的差异序列;选取限制性核酸内切酶NruⅠ,酶切位点为TCG↓CGA,可酶切温和气单胞菌中的特异序列。对经电泳验证的重新扩增的16 S rDNA PCR酶切底物使用PCR仪进行酶切试验,反应体系按照说明书,反应参数依次设置为SnaBⅠ37 ℃ 5 min;BseNⅠ65 ℃ 5 min;NruⅠ37 ℃ 5 min。酶切结束后上样电泳,PCR-RFLP结果见图2。
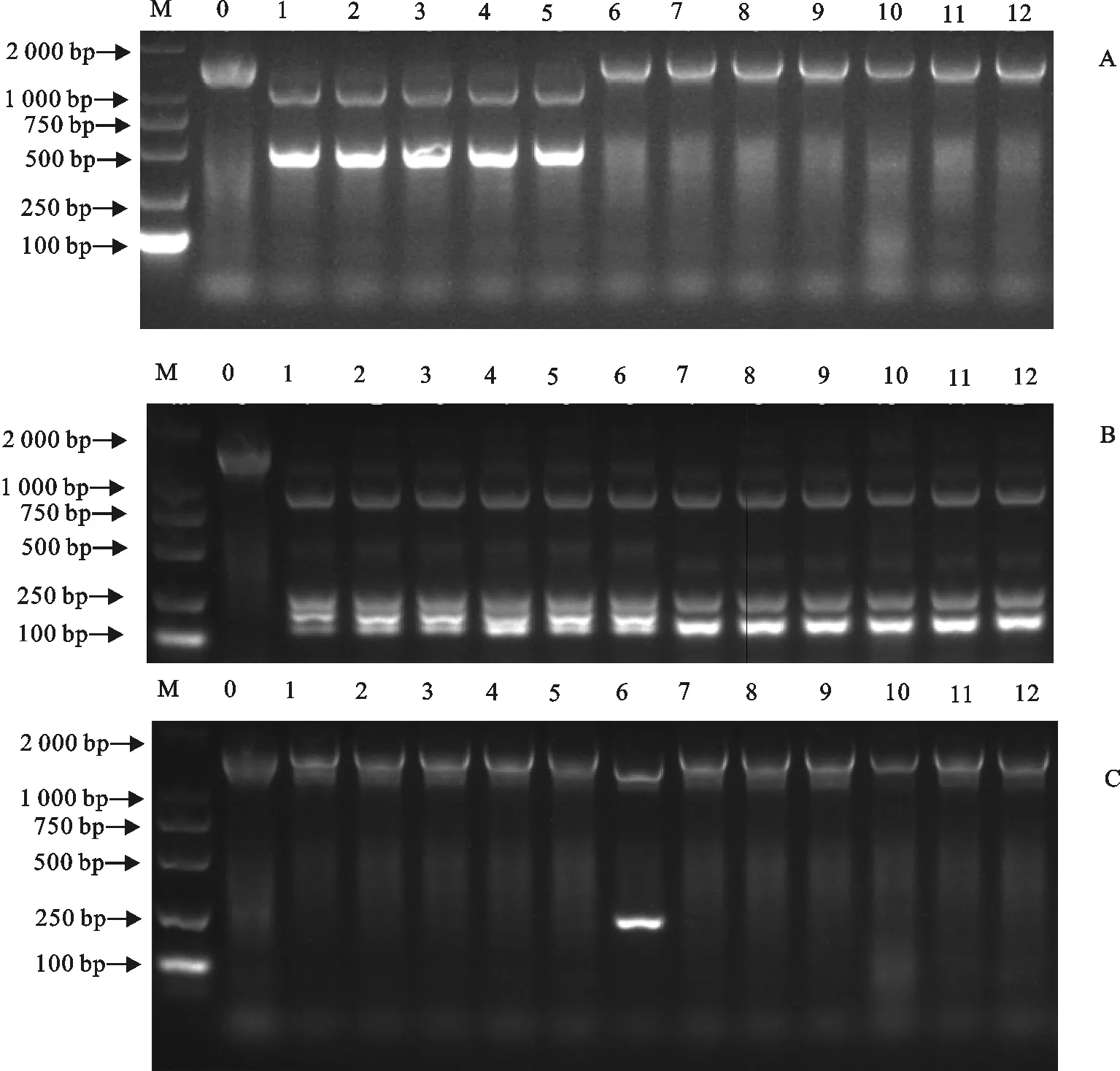
A.SnaBⅠ;B.BseNⅠ;C.NruⅠ
M.DNA 标准DL 2 000;0.对照;1~5.为嗜水气单胞菌;6.温和气单胞菌;7~12维氏气单胞菌
M.DNA Marker DL 2 000;0.Control;1-5.A.hydrophila;6.A.sobria;7-12.A.veronii
图2 12株气单胞菌16 S rDNA PCR-RFLP酶切电泳
Fig.2 Electrophoretic patterns of 16 S rDNA PCR-RFLP analysis of twelve aeromonads
用SnaBⅠ可以将嗜水气单胞菌的16 S rDNA酶切为1 000 bp和500 bp的2条条带,但对温和气单胞菌和维氏气单胞菌没有作用(图2A);用BseNⅠ可以将气单胞菌的16 S rDNA酶切为900、250、250 bp以下的短带,其中嗜水气单胞菌和温和气单胞菌的带型一样,二者250 bp以下短带较易区分,而维氏气单胞菌的短带大小相近,据此可鉴别维氏气单胞菌(图2B);用NruⅠ可以将温和气单胞菌的16 S rDNA酶切为1 250 bp和250 bp的2条条带,但对嗜水气单胞菌和维氏气单胞菌没有作用(图2C)。
3 讨论
嗜水气单胞菌是引起鱼类暴发性疾病的一种重要条件致病菌,致病范围广,可导致鲤(Cyprinuscarpio)、青鱼(Mylopharyngodonpiceus)、草鱼(Ctenopharyngodonidellus)、鲢(Hypophthalmichthysmolitrix)、鳙(Aristichthysnobilis)、黄鳝(Monopterusalbus)、西伯利亚鲟(Acipenserbaeri)、欧洲鳗鲡(Anguillaanguilla)等多种鱼类患细菌性败血症。维氏气单胞菌又称维罗纳气单胞菌,有报道称与小鱼气单胞菌(A.ichthiosmia)为同一物种[15],可导致罗非鱼(Oreochromissp.)、西伯利亚鲟(Acipenserbaeri)、泥鳅(Misgurnusanguillicaudatus)、欧洲鳗鲡(Anguillaanguilla)等鱼类致病,此外在孔雀鱼(Poecilliareticulata)、锦鲤(Cyprinuscarpio(koi))、吻鲈(Helostomatemminckii)、泰国搏鱼(Bettasplendens)等患有败血症的观赏鱼脏器中也有检出维氏气单胞菌[5]。这2种气单胞菌对淡水鱼类危害较大,若使用常规方法难以在种水平鉴别,有必要使用分子生物学手段开发一种快速鉴别的方法。
限制性片段长度多态性(RFLP)是分子标记的一种,当前使用较多的是基于聚合酶链反应(PCR)的PCR-RFLP,其酶切底物是PCR扩增的目的片段,可以在种水平快速和有效鉴定气单胞菌[7-10]。Borrell N等[7]于1997年最初使用16 S rDNA PCR-RFLP技术对当时的所有15种气单胞菌进行分类鉴定,其中11种可以使用AluⅠ和MboⅠ进行双酶切,依据差异带型同时鉴别,其余相同带型的4种可以结合其他限制酶鉴定。近年来,对气单胞菌使用PCR-RFLP进行鉴定的报道也大多使用AluⅠ和MboⅠ进行双酶切[5,10-14],这一双酶切组合产生的RFLP带型中条带多而复杂,主要差异条带集中在207 bp以下且长度差异不大,会出现非典型的RFLP带型,用琼脂糖凝胶电泳分辨率不高而且需要电泳较长时间,其中的小片段不易识别,有研究者为提高分辨率用聚丙烯酰胺凝胶电泳[5,13],加大了工作量和延长了鉴定时间。
本研究对福建地区12株鱼源致病气单胞菌在采用传统分子生物学细菌鉴别方法的基础上(即对16 S rDNA扩增、测序和构建系统发育树鉴定菌种),避开序列中种内差异位点并选择稳定的种间差异位点,筛选出嗜水气单胞菌16 S rDNA的特异性限制性核酸内切酶SnaBⅠ和可以快速鉴别维氏气单胞菌的限制性核酸内切酶BseNⅠ,同时筛选出鉴别温和气单胞菌的限制性核酸内切酶NruⅠ,以上内切酶产生的RFLP带型较为明显,酶切后可鉴别菌种的可辨条带在4条以内,酶切试验和常规的琼脂糖凝胶电泳可以在1 h内完成。结合GenBank中相关致病气单胞菌的16 S rDNA序列,SnaBⅠ可以特异鉴定嗜水气单胞菌;BseNⅠ对嗜水气单胞菌、温和气单胞菌、豚鼠气单胞菌、维氏气单胞菌和简达气单胞菌都可酶切产生RFLP带型,理论上豚鼠气单胞菌和嗜水气单胞菌以及温和气单胞菌酶切带型一致,可以结合SnaBⅠ以鉴别嗜水气单胞菌和温和气单胞菌,而豚鼠气单胞菌需要补充发酵葡萄糖是否产气等试验来鉴别,维氏气单胞菌和简达气单胞菌酶切带型一致,可以通过维氏气单胞菌利用蔗糖,而简达气单胞菌不利用蔗糖来鉴别;NruⅠ除了酶切温和气单胞菌外,还可酶切杀鲑气单胞菌和与其仅有2碱基序列差异的兽生气单胞菌[16],但理论上酶切杀鲑气单胞菌和兽生气单胞菌会产生3个条带,不同于温和气单胞菌的2个条带(图2C),由于本研究温和气单胞菌仅有1株,考虑到种内不同株系可能存在差异或异质性而没有深入试验,但若结合GenBank中报道的温和气单胞菌相关序列,该种间差异位点相对保守,限制性核酸内切酶NruⅠ具有一定的开发潜力。本研究所建立方法与传统理化鉴别方法相比,减少了病原菌的误判和大量繁重耗时的培养鉴别工作[6];与常规分子生物学检测方法相比,可以避免每次对同一菌种鉴定时的重复测序和后续的序列比对、分析。
本研究用16 S rDNA PCR-RFLP的分子标记方法对福建地区的2种鱼源致病气单胞菌进行了分子鉴定,筛选出嗜水气单胞菌16 S rDNA的特异性限制性核酸内切酶SnaBⅠ和可以较为快速鉴别维氏气单胞菌的限制性核酸内切酶BseNⅠ,对于这2种鱼源常见气单胞菌的鉴定时间较当前基于测序构建系统发育树以鉴定气单胞菌所用时间大大缩短,其中PCR后酶切和常规琼脂糖凝胶电泳可以在1 h内完成。本研究对于水产鱼类嗜水气单胞菌和维氏气单胞菌病害的快速鉴别具有参考和应用价值。
[1] Parker J L,Shaw J G.Aeromonasspp. clinical microbiology and disease[J].J Infect,2011,62(2):109-118.
[2] 李欣悦,李凤娟,杜鹏程,等.rpoD和gyrA基因对气单胞菌鉴定的比较分析[J].疾病监测,2016,31(3):200-204.
[3] Puthucheary S D,Puah S M,Chua K H.Molecular characterization of clinical isolates ofAeromonasspecies from Malaysia[J].PLoS One,2012,7(2):e30205.
[4] Lewbart G A.Bacteria and ornamental fish[J].Semi Avian Exot Pet,2001,10(1):48-56.
[5] Jagoda S S,Wijewardana T G,Arulkanthan A,et al.Characterization and antimicrobial susceptibility of motile aeromonads isolated from freshwater ornamental fish showing signs of septicaemia[J].Dis Aquat Organ,2014,9(2):127-137.
[7] Borrell N,Acinas S G,Figueras M J,et al.Identification ofAeromonasclinical isolates by restriction fragment length polymorphism of PCR-amplified 16S rRNA genes[J].J Clin Microbiol,1997,35(7):1671-1674.
[8] Figueras M J,Soler L,Chacón M R,et al.Extended method for discrimination ofAeromonasspp. by 16S rDNA RFLP analysis[J].Int J Syst Evol Microbiol,2000,50(6):2069-2073.
[9] Ghatak S,Agarwal R K,Bhilegaonkar K N.Species identification of clinically importantAeromonasspp. by restriction fragment length polymorphism of 16S rDNA[J].Lett Appl Microbiol,2007,44(5):550-554.
[10] Skwor T,Shinko J,Augustyniak A,et al.AeromonashydrophilaandAeromonasveroniipredominate among potentially pathogenic ciprofloxacin- and tetracycline-resistantAeromonasisolates from lake erie[J].Appl Environ Microbiol,2014,80(3):841-848.
[11] Beaz-Hidalgo R,Alperi A,Buján N,et al.Comparison of phenotypical and genetic identification ofAeromonasstrains isolated from diseased fish[J].Syst Appl Microbiol,2010,33(3):149-153.
[12] Onuk E E,Findik A,Turk N,et al.Molecular identification and determination of some virulence genes ofAeromonasspp. in fish and water from Turkish coastal regions[J].Rev Med Vet (Toulouse),2012,164(4):200-206.
[13] Vega-Sánchez V,Acosta-Dibarrat J,Vega-Castillo F,et al.Phenotypical characteristics,genetic identification,and antimicrobial sensitivity ofAeromonasspecies isolated from farmed rainbow trout (Onchorynchusmykiss) in Mexico[J].Acta Trop,2014,130(1):76-79.
[14] Yadav S,Dev K V,Pravata K P,et al.Phenotypic and genotypic identification ofAeromonasspecies from aquatic environment[J].Int J Aquat Sci,2014,5(1):3-20.
[15] Collins M D,Martinez-Murcia A J,Cai J.AeromonasenteropelogenesandAeromonasichthiosmiaare identical toAeromonastrotaandAeromonasveronii,respectively,as revealed by small-subunit rRNA sequence analysis[J].Int J Syst Bacteriol,1993,43(4):855-856.
[16] Martinezmurcia A J,Benlloch S,Collins M D.Phylogenetic interrelationships of members of the generaAeromonasandPlesiomonasas determined by 16S ribosomal DNA sequencing:lack of congruence with results of DNA-DNA hybridizations[J].Int J Syst Bacteriol,1992,42(3):412-421.

