人工感染细粒棘球蚴犬粪中蛋白质组的分析
李双男,闫鸿斌,李 立,姚 刚,田文俊,李文卉,张念章,吴燕涛,付宝权, 2,贾万忠, 2*
(1.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室/农业部兽医公共卫生重点实验室/甘肃省动物寄生虫病重点实验室,甘肃兰州 730046;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
棘球蚴病俗称包虫病,是由细粒棘球绦虫(Echinococcusgranulosus)的中绦期(幼虫)——细粒棘球蚴寄生于动物和人的肝、肺及其他器官而引起的一种呈世界性分布人兽共患病[1-4]。在中国,棘球蚴病主要流行于北方和西北地区,其中青藏高原为主要高发区之一;年人体手术病例2 000余例,流行区5 000万人受到本病的严重威胁;患病家畜3 000万头(只),年新发病例700万头(只);年直接经济损失超过8亿元[5-6]。棘球蚴病属法定上报的传染病,列为中国重点防控的寄生虫病之一,已引起各级政府部门和研究机构的高度重视。棘球蚴病对人体健康和畜牧业发展都产生了严重的危害,它不仅是一个特殊的医学和兽医学问题,而且更是一个严重的社会经济问题。该病仅中南亚地区就有2.7亿人遭受威胁,估计全球患者达300万之多,每年诊断出的新增病例达20万人,家畜感染数目达数千万头(只),每年造成的直接经济损失高达19亿美元[1,7-8]。细粒棘球绦虫的成虫以犬科动物为终末宿主,虫卵可以随着犬的粪便排出,人或羊等其他中间宿主吞食这些被污染过的污染物后虫卵经胃进入十二指肠,六钩蚴穿过肠壁,随血液循环移行至肝、肺等器官,由此引起棘球蚴病。犬粪中虫卵是该病传播的一个关键要素,因此,对犬粪中细粒棘球绦虫相关蛋白进行研究,为建立粪抗原检测方法提供科学依据,进而对防控棘球蚴病具有重大意义。本文利用以高分辨率的分离技术、质谱鉴定技术以及生物信息学技术为基础的蛋白质组学技术,研究犬粪中细粒棘球绦虫相关分泌蛋白,为宿主-寄生虫相互作用和寄生虫病的免疫病理学研究提供有价值的见解。到目前为止,已有7篇关于棘球绦虫蛋白质组学研究的报道,其中有5篇报道是针对细粒棘球绦虫的。Chemale G等首次使用二维电泳分析细粒棘球蚴阶段的蛋白质成分,并获得一定进展[9-10]。细粒棘球蚴的分泌蛋白和排泄蛋白在宿主免疫应答机制中起着至关重要的作用,这些蛋白被认为是蛋白组学研究的主要内容[11-15]。宿主中存在与包囊或原头蚴相关的蛋白质,这表明寄生虫可能吸附于宿主表面伪装抗原,夺取营养,影响宿主的免疫应答[10,13]。蛋白质组学的研究揭示了棘球绦虫的抗原特性和免疫特性,然而,对细粒棘球绦虫从感染终末宿主到成熟排卵时期蛋白的动态变化尚缺乏系统研究。本研究中,通过人工感染细粒棘球蚴原头节,收集感染后不同时间的犬粪样品,进行蛋白质提取和质谱分析,试图阐明不同时间细粒棘球绦虫的蛋白分泌变化和功能,从分子生物学角度为细粒棘球绦虫感染的早期诊断奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物与材料 试验中所涉及到的犬只均来源于中国农业科学院兰州兽医研究所动物饲养场;所涉及到的细粒棘球蚴来自于西宁动物屠宰场采样,病羊肝脏抽取,经显微镜下确认虫体形态。
1.1.2 主要试剂及仪器设备 硫酸钛、考马斯亮兰G-250、硫脲、Tris 碱、3-3-(胆酰胺丙基)二甲氨基丙磺酸内盐、二硫苏糖醇等,Amresco公司产品;GTP(固定钛离子亲和色谱材料),中国科学院大连化物所产品;碘乙酰胺,Merk 公司产品;尿素,Solarbio公司产品;Trypsin酶,Promega公司产品;zip-tip,Millipore公司产品;ACN(乙腈),Fisher公司产品;丙酮和三氟乙酸,Baker公司产品;甲酸,MREDA Technology公司产品。所有试剂都是分析纯或者更高级别。Q Executive质谱仪,UAS Thermo Fisher Scientific公司产品;LC-20AD纳升液相色谱仪,岛津公司产品。
1.2 方法
1.2.1 动物感染与粪便处理 试验前对犬进行驱虫,取粪便进行PCR和ELISA[16-17]鉴定,确保选用的动物均无细粒棘球绦虫感染。犬喂饲20 000个细粒棘球蚴原头节,分别在感染前和感染后16、21、25、30、34、40 d收集犬粪,样品分别标记为Eg0、Eg1、Eg2、Eg3、Eg4、Eg5、Eg6。参照Terry L A等[18]的方法,粪便解冻后加3×磷酸盐缓冲液和2×蛋白酶抑制剂(不含EDTA)(Roche,Welwyn Garden City,UK),每份犬粪上清涡旋振荡5 min~10 min直至均匀,转移至15 mL离心管内,置-80℃保存备用。
1.2.2 蛋白与肽段提取 每2 g犬粪上清中加入300 mL LB(裂解缓冲液lysis buffer),冰浴充分研磨、超声,直至充分溶解。4℃、13 500 r/min离心15 min,离心2次,吸取上清液,丙酮冰浴沉淀30 min,4℃、13 500 r/min离心15 min,离心2次,弃掉上清液,4℃干燥5 min,40 mmol/L NH4HCO3充分溶解沉淀后测定蛋白浓度。取蛋白做SDS-PAGE凝胶电泳,整个蛋白条带用刀切成约1 mm3的小块,放入EP管中,向管中加入500 μL纯水,洗涤10 min,重复2次;向管中加入500 μL乙腈,脱水10 min;加入二硫苏糖醇(DTT)终浓度为10 mmol/L的25 mmol/L NH4HCO3,56℃水浴1 h;加入碘代乙酰胺(IAM)终浓度为55 mmol/L的25 mmol/L NH4HCO3,暗室室温放置45 min;向管中加入500 μL的25 mmol/L NH4HCO3,洗涤10 min,重复2次;向管中加入500 μL乙腈,脱水10 min;抽干乙腈,加入0.01 μg/μL的Trypsin 50 μL,37℃酶解过夜;加1 mL/L甲酸(FA)终止反应。用200 μL含500 mL/L乙腈和 1 mL/L甲酸的混合物提取1次;用100%乙腈200 μL 1 mL/L甲酸提取2次;收集所有上清,并真空干燥。
1.2.3 基于QE(美国通用电气公司,General Electric Company)的液质联用分析 参考Huo X等[19]的方法,除去蛋白中的不溶物质后通过纳升液相色谱仪进行分离。设置分离程序后,依据参数在母离子中挑选电荷为2+~5+,峰强度超过20 000的15个母离子进行二级分析,用碰撞能量为27的HCD模式对肽段进行碎裂,碎片在Orbi中检测。
1.2.4 蛋白的生物信息学分析 对质谱数据进行从头测序(De novo)计算后,进行数据库(http://www.uniprot.org/)的检索,利用Overlapping Peaks软件对所得质谱分析数据进行生物信息学分析,然后选择细粒棘球绦虫蛋白数据库和犬蛋白数据库进行搜库,假阳性率(FPR, false positive rate)利用反库(decoy)估算FDR 值(estimate FDR with decoy-fusion),并控制在1%以下,被鉴定蛋白至少应有2个以上的特有(unique)肽段,且验证正确的概率>95%。用kobas软件在P<0.05的条件下,对感染犬不同时间犬粪中细粒棘球绦虫蛋白进行功能富集[20-21]。
2 结果
2.1 未感染细粒棘球虫的犬粪样品蛋白鉴定结果
搜索细粒棘球绦虫和犬的混合蛋白数据库,在FDR<1%、UNIQUEpeptide>2的搜索条件下搜索到的12个细粒棘球绦虫蛋白,定义为细粒棘球绦虫蛋白同源蛋白或相似物,即假阳性(表1),在所有鉴定到的蛋白中排除这12个蛋白质。
2.2 感染细粒棘球虫不同时间点犬粪蛋白的鉴定
在Eg0~Eg6共6个时间点共鉴定到了78个蛋白。Eg1鉴定到了31个蛋白,其中21个蛋白为该时间特有;Eg2鉴定到了15个蛋白,其中有3个为该时间特有;Eg3中共鉴定到26个蛋白,其中11个为该时间特有;Eg4中鉴定到14个蛋白,其中3个蛋白为该时间特有;Eg5中共鉴定到24个蛋白,其中10个为该时间特有;Eg6中鉴定到10个蛋白,其中6个为该时间特有(表2)。
2.3 犬粪中细粒棘球虫蛋白的功能富集
用Kobas软件对感染细粒棘球绦虫的犬不同时间的犬粪中细粒棘球绦虫蛋白进行功能富集,P<0.05的条件下,Eg1富集到嘌呤代谢(purine metabolism)、肌醇磷酸盐代谢(inositol phosphate metabolism)和氧化磷酸化(oxidative phosphorylation);Eg2富集到RNA降解(RNA degradation)和氧化磷酸化(oxidative phosphorylation);Eg3和Eg4共同富集到富集到碳代谢(carbon metabolism)、氧化磷酸化(oxidative phosphorylation)和糖酵解(glycolysis/gluconeogenesis);Eg5富集到RNA降解(RNA degradation)和氧化磷酸化(oxidative phosphorylation);Eg6富集到氧化磷酸化(oxidative phosphorylation)、碳代谢(carbon metabolism)、RNA降解(RNA degradation)和糖酵解(gycolysis/gluconeogenesis)等代谢通路(图1)。

表1 犬粪样品中细粒棘球绦虫蛋白同源蛋白或相似物的鉴定
注:蛋白登录号是一种蛋白质与Uniprot蛋白数据库唯一对应的编号。
Note:Protein accession number is the unique corresponding number of a protein in the Uniprot protein data bank.

表2 感染犬不同时间粪中细粒棘球绦虫蛋白的鉴定
续表2

蛋白质登录号Proteinaccessionnumber类型描述Description时间TimeE1E2E3E4E5E6tr|A0A068WJX2|A0A068WJX2-ECHGR组蛋白H4HistoneH4√tr|A0A068WMG7|A0A068WMG7-ECHGR组蛋白H4HistoneH4√tr|A0A068WPV2|A0A068WPV2-ECHGR组蛋白H4HistoneH4√tr|A0A068X0X0|A0A068X0X0-ECHGR糖原磷酸化酶Glycogenphosphorylase√tr|W6U8C7|W6U8C7-ECHGR染色质域-解旋酶-DNA-结合蛋白Chromodomain-helicase-DNA-bindingprotein√tr|W6UB03|W6UB03-ECHGR卡塞林素-1Calsyntenin-1√tr|W6UN17|W6UN17-ECHGR卡塞林素-1Calsyntenin-1√tr|W6UP55|W6UP55-ECHGR包含缓冲区域蛋白Cachedomaincontainingprotein√tr|W6V269|W6V269-ECHGR基底膜特异性硫酸乙酰肝素蛋白聚糖核心蛋白Basementmembrane-specificheparansulfateproteoglycancoreprotein√tr|W6V2K4|W6V2K4-ECHGR基底膜特异性硫酸乙酰肝素Basementmembranespecificheparansulfate√tr|A0A068WDS5|A0A068WDS5-ECHGRATP依赖性RNA解旋酶DDX20ATPdependentRNAhelicaseDDX20√√√√tr|W6V0W8|W6V0W8-ECHGRATP依赖性DNA解旋酶2亚单位2ATPdependentDNAhelicase2subunit2√√√√tr|U6JN05|U6JN05-ECHGR*ATP结合盒亚家族BMDR:TAPATPbindingcassettesubfamilyBMDR:TAP√√√√√tr|W6TZP8|W6TZP8-ECHGR*膜联蛋白Annexin√√√√√tr|W6ULY2|W6ULY2-ECHGR*α-14葡聚糖磷酸化酶Alpha-14glucanphosphorylase√√√√√tr|W6V4D7|W6V4D7-ECHGRα-11葡聚糖磷酸化酶Alpha-11glucanphosphorylase√√√tr|W6UKC4|W6UKC4-ECHGR腺苷酸激酶2Adenylatekinase2√√tr|A0A068WJD9|A0A068WJD9-ECHGR线粒体腺苷酸激酶2Adenylatekinase2mitochondrial√√tr|A0A068WP10|A0A068WP10-ECHGR腺苷酸环化酶9Adenylatecyclase9√√tr|U6JN02|U6JN02-ECHGR78ku糖相关蛋白78kuglucose-regulatedprotein√√tr|A0A068W8V8|A0A068W8V8-ECHGR核糖体蛋白L40RibosomalproteinL40√tr|A0A068WH84|A0A068WH84-ECHGR剪接因子3b亚基1Splicingfactor3bsubunit1√tr|W6UA56|W6UA56-ECHGR细胞质氨基肽酶Cytosolaminopeptidase√tr|W6USS6|W6USS6-ECHGR泛素Ubiquitin√tr|A0A068WM60|A0A068WM60-ECHGR聚泛素Polyubiquitin√√tr|A0A068WQT5|A0A068WQT5-ECHGR泛素核糖体蛋白L40UbiquitinribosomalproteinL40√√
续表2

蛋白质登录号Proteinaccessionnumber类型描述Description时间TimeE1E2E3E4E5E6tr|A0A068WVL5|A0A068WVL5-ECHGR*泛素核糖体蛋白L40UbiquitinribosomalproteinL40√√tr|W6TYX3|W6TYX3-ECHGR*泛素Ubiquitin√√tr|W6UDU1|W6UDU1-ECHGR*泛素Ubiquitin√√tr|A0A068W862|A0A068W862-ECHGR血影蛋白β链Spectrinbetachain√tr|A0A068WMT0|A0A068WMT0-ECHGR微管连接蛋白4Sortingnexin4√tr|A0A068WNJ6|A0A068WNJ6-ECHGR磷酸簇分选蛋白Phosphofurinacidicclustersortingprotein√tr|A0A068WRJ7|A0A068WRJ7-ECHGR组蛋白赖氨酸N甲基转移酶HistonelysineNmethyltransferase√tr|A0A068WVV7|A0A068WVV7-ECHGRRUN结构域含有蛋白1RUNdomaincontainingprotein1√tr|A0A068WZ77|A0A068WZ77-ECHGR线粒体延长因子GElongationfactorGmitochondrial√tr|U6JHZ3|U6JHZ3-ECHGR116kuU5小核核糖核蛋白116kDaU5smallnuclearribonucleoprotein√tr|U6JKF3|U6JKF3-ECHGR*ATP合酶亚基OATPsynthasesubunitO√tr|W6U1F9|W6U1F9-ECHGR功能不明蛋白Uncharacterizedprotein√tr|W6UJ46|W6UJ46-ECHGR线粒体延长因子GElongationfactorGmitochondrial√tr|W6V4I2|W6V4I2-ECHGR磷酸簇分选蛋白Phosphofurinacidicclustersortingprotein√tr|U6JF50|U6JF50-ECHGRRas相关蛋白RABD2ARas-relatedproteinRABD2A√√tr|A0A068WC57|A0A068WC57-ECHGR*Ras蛋白rab8bRasproteinrab8b√√√tr|W6U129|W6U129-ECHGR*组蛋白HistoneH4√√√tr|W6USR3|W6USR3-ECHGR*Ras蛋白rab8bRas-relatedproteinRab-8B√√√tr|A0A068WXI3|A0A068WXI3-ECHGR红细胞膜蛋白Erythrocytemembraneprotein√√tr|A0A068X0R4|A0A068X0R4-ECHGRATP合酶α亚基ATPsynthasesubunitalpha√√√tr|A0A068WKF3|A0A068WKF3-ECHGR钙转运ATP酶Calcium-transportingATPase√√tr|W6UDK0|W6UDK0-ECHGR钙转运ATP酶Calcium-transportingATPase√√tr|A0A068WRP1|A0A068WRP1-ECHGR糖蛋白N乙酰半乳糖胺GlycoproteinNacetylgalactosamine√tr|A0A068X2X2|A0A068X2X2-ECHGR热激蛋白70Heatshockprotein70√tr|W6UN55|W6UN55-ECHGR天冬氨酰-tRNA合成酶Aspartyl-tRNAsynthetase√tr|A0A068WKN2|A0A068WKN2-ECHGR动力蛋白重链Dyneinheavychain√tr|A0A068WNX7|A0A068WNX7-ECHGR生长停滞特异性蛋白8Growtharrestspecificprotein8√
续表2

蛋白质登录号Proteinaccessionnumber类型描述Description时间TimeE1E2E3E4E5E6tr|A0A068WQE8|A0A068WQE8-ECHGR胶原蛋白α1V链Collagenalpha1Vchain√tr|A0A068WZV7|A0A068WZV7-ECHGR神经母细胞瘤扩增序列Neuroblastomaamplifiedsequence√tr|U6JEY5|U6JEY5-ECHGRADP核糖基化因子4ADPribosylationfactor4√tr|W6U4B3|W6U4B3-ECHGR动力蛋白重链5轴突Dyneinheavychain5axonemal√tr|W6U8Q5|W6U8Q5-ECHGR生长停滞特异性蛋白Growtharrest-specificprotein√tr|W6UFG1|W6UFG1-ECHGRADP核糖基化因子ADP-ribosylationfactor√tr|W6US03|W6US03-ECHGR胶原α-2I链核仁蛋白Collagenalpha-2(I)chain√tr|W6UVD7|W6UVD7-ECHGR核蛋白Nucleolarprotein√tr|W6URL4|W6URL4-ECHGR真核翻译起始因子3亚基CEukaryotictranslationinitiationfactor3subunitC√tr|A0A068WB35|A0A068WB35-ECHGR染色体蛋白的结构维持Structuralmaintenanceofchromosomesprotein√√tr|A0A068WTN7|A0A068WTN7-ECHGR磷脂酰肌醇4磷酸3激酶C2Phosphatidylinositol4phosphate3kinaseC2√tr|A0A068WW50|A0A068WW50-ECHGR甲状腺激素α受体Thyroidhormonereceptoralpha√tr|W6U2Y8|W6U2Y8-ECHGR平滑肌肌球蛋白轻链激酶Myosinlightchainkinasesmoothmuscle√tr|W6UT79|W6UT79-ECHGR染色体结构维持蛋白1AStructuralmaintenanceofchromosomesprotein1A√
注:E1、E2、E3、E4、E5、E6为感染细粒棘球绦虫后不同时期的犬粪样品。画有“√”符号的为该时期具有的蛋白。画有“*”符号的为该时间肽段覆盖结合可信度较高蛋白。
Note: E1, E2, E3, E4, E5 and E6 represent dog feces at different time post-infection withEchinococcusgranulosus. "√" indicates the protein at the special time."*" means the high abundance proteins at the special time.
3 讨论
目前,市场上还没有出现具备检测犬细粒棘球绦虫感染21 d之前的粪抗原试剂盒。有研究表明,细粒棘球绦虫感染犬25 d左右,虫体已具备头节、颈节、吸盘和吻突等结构。感染35 d左右,虫体节片数增多且生殖器官发育完全,但无虫卵。细粒棘球绦虫在犬体内发育40 d左右进入成熟阶段开始排卵即具有感染性[22-23]。因此,选择感染细粒棘球绦虫0、16、21、25、30、34、40 d等不同时间对细粒棘球绦虫蛋白进行分析。感染16 d所富集到的蛋白功能主要是参与嘌呤代谢、氧化磷酸化、肌醇磷酸盐代谢;感染21 d和34 d后所富集到的蛋白功能主要是参与氧化磷酸化和RNA降解;感染25 d和30 d后所富集到的蛋白功能主要是参与碳代谢、糖酵解、氧化磷酸化;感染40 d后所富集到的蛋白功能主要是参与碳代谢、糖酵解、氧化磷酸化和RNA降解。本研究结果显示,细粒棘球绦虫发育的各个时间均存在氧化磷酸化供能现象。E1~E5时期共有的蛋白是ATP binding cassette subfamily B MDR:TAP、Annexin和Alpha-1 4 glucan phosphorylase,这些蛋白均与氧化磷酸化过程直接相关。
在犬感染细粒棘球绦虫16 d时所富集到的特有蛋白共21个,其功能主要是参与嘌呤代谢、氧化磷酸化、肌醇磷酸盐代谢。嘌呤代谢是动物含氮废物排出体外的重要途径之一。肌醇是一类具有不同细胞功能的分子,最常见的是环己烷的异构体,是所有真核生物体内产生肌醇磷酸和肌醇磷脂的一种重要前体。寄生虫的体表覆盖大量的葡糖基磷脂酰肌醇(GPI)锚定蛋白[24-25]、脂磷酸聚糖及糖基肌醇磷脂(GIPLs)等多种成分[24,26-27]。这些分子都具有非常重要的功能,包括逃避宿主的免疫应答[28]、激发炎症反应[29-30]、附着于宿主特定的组织[31-32]以及防止自身蛋白酶降解[33-34]等。另外,GPI锚定的脂质部分对宿主的信号传导通路起调节作用[33]。犬感染细粒棘球绦虫16 d后,富集到这些与肌醇代谢相关的蛋白,该时间的特有蛋白可能提示细粒棘球绦虫肌醇代谢非常活跃,然而目前在临床检测方面,该时间的感染尚不能被检测到,这就提示我们研究该时间有关蛋白,可为建立早期检测方法提供分子依据。寄生虫可以通过周期性地改变由GPI锚定的变异表面糖蛋白(VSG),逃避宿主的免疫应答。因此,特异性地抑制细粒棘球绦虫GPI生物合成可以成为治疗该病或消除感染的有效途径。
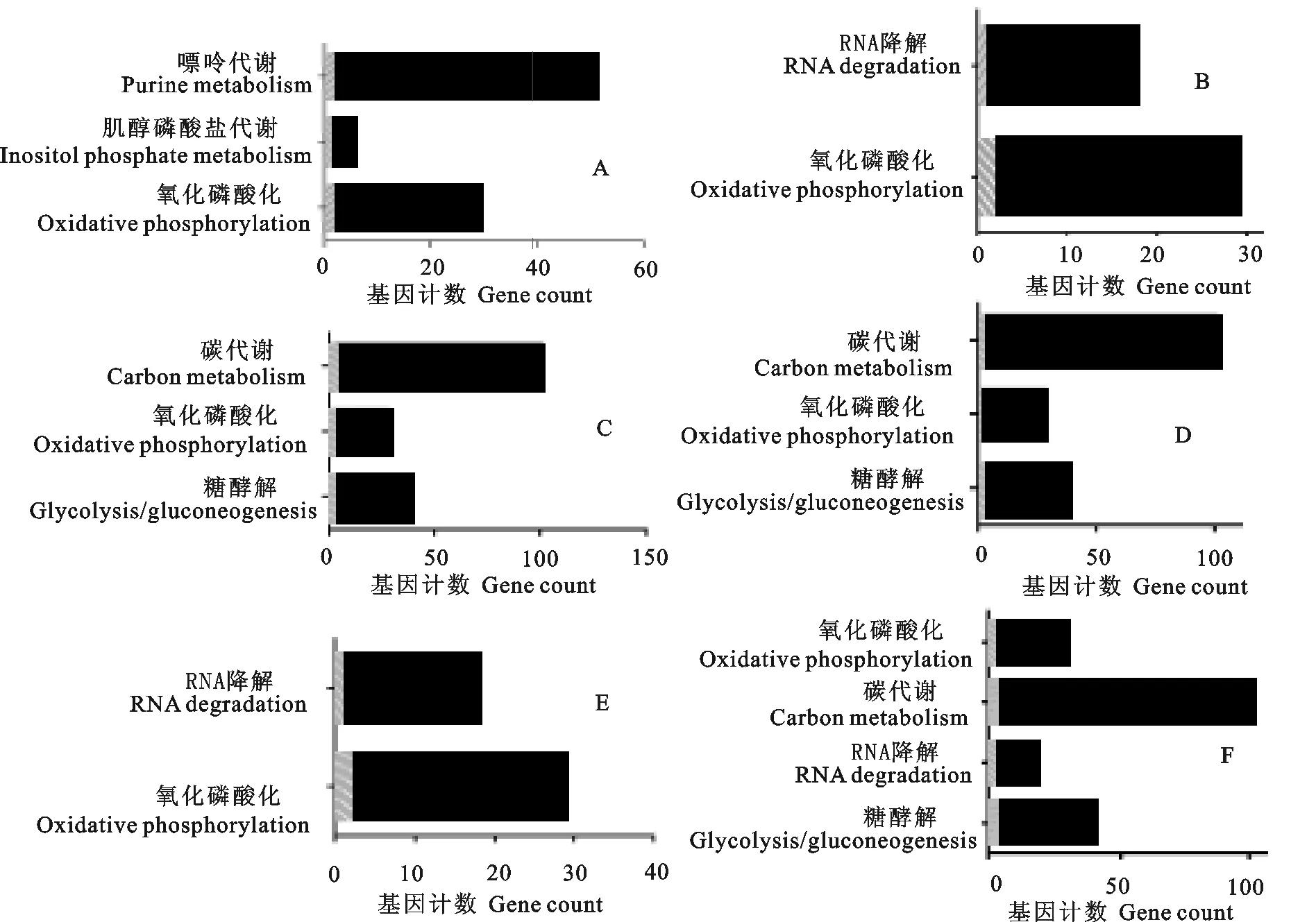
A~F分别为Eg1~Eg6样品蛋白的功能富集结果。图中黑色部分代表的是该代谢通路中所有的基因,阴影部分为细粒棘球绦虫蛋白基因所占比例。X轴为代谢通路中基因的数量,Y轴为所富集到的功能目录
A-F display the enrichment results of the functions of proteins respectively from Eg1-Eg6 samples.The black part of the figure represents all the genes involved in the metabolic pathways,and the shadow mapping part is the proportion ofEchinococcusprotein genes accounting for the genes.X axis denotes the number of genes in metabolic pathways,while Y axis does the directory of the functions which were enriched
图1感染细粒棘球虫不同时间犬粪蛋白功能的富集
Fig.1 Enrichment functions of proteins in dog feces at different time post-infection withEchinococcusgranulosus
犬感染细粒棘球绦虫21、34、40 d后,均发现了与RNA降解相关功能的蛋白。结合细粒棘球绦虫的生长规律,我们推测,犬感染细粒棘球绦虫21 d后,宿主产生免疫应答,抑制细粒棘球绦虫的生长,宿主分泌的相关酶对寄生虫RNA进行降解;犬感染细粒棘球绦虫34 d左右,细粒棘球绦虫的生殖器官基本发育完好,虫体发育已趋于成熟,但宿主机体免疫应答仍存在,虫体可能启动免疫逃避机制,导致RNA降解的发生;在犬感染细粒棘球绦虫40 d左右,成虫已经开始排出虫卵,孕节脱落,功能衰退的虫体可能会自行衰亡,由于对生存环境的适应,自身分泌RNA降解酶导致RNA降解的发生。RNA 降解影响很多生命活动,是基因表达调节的重要途径,有时mRNA对基因的调控可以占到基因表达调节作用的50%,因此研究mRNA的稳定性对基因表达调节具有十分重要意义[35]。在不同生物中,mRNA往往会由于甲基化的程度或位置不同而存在多种不同的帽子结构,目前已经有研究发现发现曼氏血吸虫(Schistosomamansoni)和线虫与哺乳动物的mRNA有着不同的帽子结构,而且人类对这种帽子结构的亲和力比寄生虫低数百倍,深入了解寄生虫结合帽子的机制,将非常有利于研发新型且广谱的抗寄生虫药物[36]。对犬感染细粒棘球绦虫不同时期RNA降解机制进行针对性的研究有助于阐明细粒棘球绦虫在宿主体内的生活机制,为该病的诊断与治疗提供基础。
犬感染细粒棘球绦虫25、30、40 d后,与碳代谢和糖酵解过程有关酶的表达丰富,这些酶可能与生物合成和葡萄糖代谢有关。Gan W J等[37]通过生物信息学分析发现细粒棘球绦虫中与碳代谢和糖酵解有关的酶是乳酸脱氢酶(LDH),在生理条件下负责催化丙酮酸还原成乳酸。重组蛋白的酶活性被蛋白质抗体或包含催化中心的关键残基或底物结合位点的抗原表位所抑制,认为LDH是抗细粒棘球绦虫药物和疫苗研究的一个潜在靶标。这表明对生物代谢途径的研究会给治疗细粒棘球绦虫感染的研究提供新思路。另外,在临床检测方面,犬细粒棘球绦虫25 d~40 d时间段的感染已经能被检测出来,因此,本研究这个时间段有关蛋白的结构与功能会对细粒棘球绦虫诊断抗原的筛选与研究奠定一定的基础,并为疫苗的开发与研制提供新的方向。但值得注意的是,犬感染细粒棘球绦虫34 d并未富集到与生物合成和葡萄糖代谢有关蛋白,这可能是由于该时期存在功能尚不明确的蛋白,也可能是此时不表达这些相关蛋白。这项研究提示,对于鉴定到的肽段覆盖结合可信度较高的蛋白将作为后期重点研究对象进行克隆表达与进一步验证,通过动物试验获得多克隆抗体,建立ELISA,并对收集的细粒棘球绦虫犬粪阳性样品进行检测,进一步筛选得到特异性强、敏感度高的诊断抗原,并挑选几种理想的抗原,有目的地制备相应蛋白的单克隆抗体,从而为试剂盒的研发提供新的方法和途径。
[1] McManus D P,Zhang W B,Li J,et al.Echinococcosis[J].Lancet,2003,362(9392):1295-1304.
[2] Eckert J,Deplazes P.Biological,epidemiological,and clinical aspects of echinococcosis,a zoonosis of increasing concern[J].Clin Microbiol Rev,2004,17(1):107-135.
[3] Craig P S,McManus D P,Lightowlers M W,et al.Prevention and control of cystic echinococcosis[J].Lancet Infect Disea,2007,7(6):385-394.
[4] Zheng H J,Zhang W B,Zhang L,et al.The genome of the hydatid tapewormEchinococcusgranulosus[J].Nat Genetics,2013,45(10):1168-1302.
[5] 棘球蚴病研究协作组.包虫(棘球蚴)病在我国的流行情况[J].新疆农业科学,1989(3):35-38.
[6] 齐普生,王进成,张壮志,等. 棘球蚴病在我国流行及防治[J].中国农业大学学报,1998(S2):94-97.
[7] Budke C M,Deplazes P,Torgerson P R.Global socioeconomic impact of cystic echinococcosis[J].Emerg Infect Disea,2006,12(2):296-303.
[8] Atkinson J A M,Gray D J,Clements A C A,et al.Environmental changes impactingEchinococcustransmission:research to support predictive surveillance and control[J].Global Change Biol,2013,19(3):677-688.
[9] Chemale G,van Rossum A J,Jefferies J R,et al.Proteomic analysis of the larval stage of the parasiteEchinococcusgranulosus:Causative agent of cystic hydatid disease[J].Proteomics,2003,3(8):1633-1636.
[10] Monteiro K M,de Carvalho M O,Zaha A,et al.Proteomic analysis of theEchinococcusgranulosusmetacestode during infection of its intermediate host[J].Proteomics,2010,10(10):1985-1999.
[11] Hewitson J P,Grainger J R,Maizels R M.Helminth immunoregulation:The role of parasite secreted proteins in modulating host immunity[J].Mol Biochem Parasitol,2009,167(1):1-11.
[12] Mejri N,Hemphill A, Gottstein B.Triggering and modulation of the host-parasite interplay byEchinococcusmultilocularis:a review[J].Parasitology,2010,137(3):557-568.
[13] Aziz A,Zhang W B,Li J,et al.Proteomic characterisation ofEchinococcusgranulosushydatid cyst fluid from sheep,cattle and humans[J].J Proteomics,2011,74(9):1560-1572.
[14] Vacirca D,Perdicchio M,Campisi E,et al.Favourable prognostic value of antibodies anti-HSP20 in patients with cystic echinococcosis:a differential immunoproteomic approach[J].Parasit Immunol,2011,33(3):193-198.
[15] Virginio V G,Monteiro K M,Drumond F,et al.Excretory/secretory products from in vitro-culturedEchinococcusgranulosusprotoscoleces[J].Mol Biochem Parasitol,2012,183(1):15-22.
[16] Ni X W,McManus D P,Yan H B,et al.Loop-mediated isothermal amplification (LAMP) assay for the identification ofEchinococcusmultilocularis infections in canine definitive hosts[J].Parasit Vector,2014,7(1):254-262.
[17] Liu C N,Lou Z Z,Li L,et al.Discrimination betweenE.granulosussensu stricto,E.multilocularisandE.shiquicususing a multiplex PCR assay[J].PloS Neglect Trop Dis,2015,9(9):1-14.
[18] Terry L A,Howells L,Bishop K,et al.Detection of prions in the faeces of sheep naturally infected with classical scrapie[J].Vet Res,2011,42(1):65-71.
[19] Huo X,Wu B,Mao F,et al.Proteomic analysis reveals the molecular underpinnings of mandibular gland development and lipid metabolism in two lines of honeybees (Apismelliferaligustica)[J].J Proteome Res,2016,15(8):3342-3357.
[20] Xie C,Mao X,Huang J,et al.KOBAS 2.0:a web server for annotation and identification of enriched pathways and diseases[J].Nucleic Acids Res,2011,39:316-322.
[21] Wu J,Mao X,Cai T,et al.KOBAS server: a web-based platform for automated annotation and pathway identification[J].Nucleic Acids Res,2006,34:W720-W724.
[22] Hayashi S,Fujiwara S,Noguchi T.Evolution of urate-degrading enzymes in animal peroxisomes[J].Cell Biochem Biophys,2000,32:123-129.
[23] 张文宝,哈斯也提,张状志,等.细粒棘球绦虫的发育时限观察[J].中国兽医科技,1991(11):30-31.
[24] McConville M J,Ferguson M A.The structure,biosynthesis and function of glycosylated phosphatidylinositols in the parasitic protozoa and higher eukaryotes[J].Biochem J,1993,294(Pt2):305-324.
[25] Pays E,Nolan D P.Expression and function of surface proteins inTrypanosomabrucei[J].Mol Biochem Parasitol,1998,91(1):3-36.
[26] Ferguson M A J.The structure,biosynthesis and functions of glycosylphosphatidylinositol anchors,and the contributions of trypanosome research[J].J Cell Sci,1999,112(17):2799-2809.
[27] Ilgoutz S C,McConville M J.Function and assembly of theLeishmaniasurface coat[J].Int J Parasitol,2001,31(9):899-908.
[28] Cross G A M.Antigenic variation in trypanosomes:Secrets surface slowly[J].Bioessays,1996,18(4):283-291.
[29] Almeida I C,Camargo M M,Procopio D O,et al.Highly purified glycosylphosphatidylinositols fromTrypanosomacruziare potent proinflammatory agents[J].Embo J,2000,19(7):1476-1485.
[30] Ropert C,Gazzinelli R T.Signaling of immune system cells by glycosylphosphatidyl inositol (GPI) anchor and related structures derived from parasitic protozoa[J].Current Opinion Microbiol,2000,3(4):395-403.
[31] Lekutis C,Ferguson D J P,Grigg M E,et al.Surface antigens ofToxoplasmagondii:variations on a theme[J].Int J Parasitol,2001,31(12):1285-1292.
[32] Sacks D L.Leishmania-sand fly interactions controlling species-specific vector competence[J].Cell Microbiol,2001,3(4):189-196.
[33] Tachado S D,Gerold P,Schwarz R,et al.Signal transduction in macrophages by glycosylphosphatidylinositols ofPlasmodium,Trypanosoma,andLeishmania:Activation of protein tyrosine kinases and protein kinase C by inositolglycan and diacylglycerol moieties[J].Proc Nat Acad Sci U S A,1997,94(8):4022-4027.
[34] Acosta-Serrano A,Vassella E,Liniger M,et al.The surface coat of procyclicTrypanosomabrucei:Programmed expression and proteolytic cleavage of procyclin in the tsetse fly[J].Proc Nat Acad Sci U S A,2001,98(4):1513-1518.
[35] Cheadle C,Fan J S,Cho-Chung Y S,et al.Control of gene expression during T cell activation: alternate regulation of mRNA transcription and mRNA stability[J].Bmc Genomics,2005,6(1):75-91.
[36] Yoffe Y,Leger M,Zinoviev A,et al.Evolutionary changes in theLeishmaniaeIF4F complex involve variations in the eIF4E-eIF4G interactions[J].Nucleic Acids Res,2009,37(10):3243-3253.
[37] Gan W J,Zhang Z P,Lv G,et al.The topological structure and function ofEchinococcusgranulosuslactate dehydrogenase,a tegumental transmembrane protein[J].Mol Biochem Parasitol,2012,184(2):109-117.

