副猪嗜血杆菌的分离鉴定及其OmpP5基因序列分析
王 超,陈 欣,张梦南,黄 晨,李 睿,刘梦志,刘宝山,姚龙泉,陈新亮,尹荣焕
(沈阳农业大学畜牧兽医学院,辽宁沈阳 110866)
副猪嗜血杆菌(Haemophilusparasuis,Hps)是一种革兰阴性菌,属于巴氏杆菌属,能够引起猪的多发性浆膜炎、脑膜炎以及关节炎综合征,其导致的疾病被称为Glãseer病[1]。现已确定的Hps血清型有1~15血清型,其中血清型1、5、10、12、13和14株是强毒株,猪感染后4 d内可引起死亡;血清型6、7、9和11株是无毒力株;血清型2、3、4、8和15株是中等毒力菌株,只有在特定情况下才可使猪发生浆膜腔积液或死亡[2-4]。强毒株能够通过破坏鼻黏膜进入血液,随着血液流动到达中枢神经系统,通过血脑屏障,最终造成脑膜炎的发生[5-6]。还证实该菌的大多数临床分离株能够黏附并侵入宿主细胞。Cerda-Cuellar和 Aragon发现大部分毒力菌株都为血清抗性[7]。总之,强毒株能够逃避宿主的免疫反应,从而扩散到内脏,导致全身性疾病的发生。
外膜蛋白A(outer membrane protein A,OmpA)是革兰阴性菌外膜成分的重要组成部分,高度保守,具有膜结构的完整性。研究表明,OmpA与血清抗性,对细胞的黏附及侵袭都有密切关系[8-10]。Hps外膜蛋白P5(OmpP5)是由OmpP5基因编码的,现已确定为OmpA家族成员[11]。Euba B等[12]在研究非典型流感嗜血杆菌时发现,OmpP5基因与小鼠肺部病变相关。Zhang B等[13]敲除Hps SC096菌株基因组中的OmpP5基因后发现菌株生长速度变慢。已证实OmpP5是副猪嗜血杆菌产生毒力的相关基因[14]。迄今为止,还没有针对副猪嗜血杆菌辽宁分离株OmpP5基因的分析报道。本研究对从辽宁省某猪场分离到1株Hps,对其外膜蛋白编码基因OmpP5进行克隆测序,并和已发表的不同血清型Hps OmpP5基因序列进行对比分析,以期发现不同Hps OmpP5基因间的差别,为阐明辽宁省副猪嗜血杆菌的毒力相关性、免疫原性及疫苗开发等提供参考。
1 材料与方法
1.1 材料
1.1.1 病料来源及菌种 从辽宁省阜新市某猪场发生疑似副猪嗜血杆菌病的病死猪中采集典型的病变猪肺作为待检病料;金黄色葡萄球菌ATCC 29213,沈阳农业大学人兽共患病重点实验室保存;副猪嗜血杆菌参考菌株,华中农业大学微生物实验室赠予的临床分离株。
1.1.2 培养基及主要试剂 胰蛋白大豆琼脂(tryptic soy agar,TSA)、胰蛋白大豆肉汤(tryptic soy broth,TSB) 、烟酰胺腺嘌呤二核苷酸(NAD)和无菌胎牛血清,北京索莱宝科技有限公司产品;2×TaqPCR Master Mix、高纯度质粒小提中量试剂盒,北京艾德莱生物科技有限公司产品;pEASY-T5 zero Cloning kit、Trans1-T1 Phage Resistant感受态细胞、DNA Marker DL 2 000,北京全式金生物技术有限公司产品;DNA胶回收试剂盒,上海生工生物工程技术服务有限公司产品;特异性引物由上海生工生物工程服务有限公司合成;葡萄糖、木糖、山梨醇等生化管,杭州天和微生物试剂有限公司产品。
1.1.3 主要仪器设备 立式压力蒸汽灭菌器,上海申安医疗器械厂产品;高速台式离心机,上海安亭科学仪器厂产品;核酸水平电泳仪和电泳槽,北京六一仪器厂产品;AIRTECH苏净安泰洁净工作台,苏净集团苏州安泰空气技术公司产品;电子天平,德国Sartorious公司产品;PCR基因扩增仪,杭州博日科技有限公司产品; LEICA DM750显微镜,LEICA公司产品;数码凝胶图像处理系统Tanon-1600,上海将来实业有限公司产品。
1.2 方法
1.2.1 细菌分离培养及染色镜检 用已灭菌的手术刀将病料切开,取内层病变组织,放入生理盐水中,混匀后,吸取100 μL放入TSA平皿中涂布均匀后,放入体积分数为5%的CO2培养箱中37℃培养24 h。培养后挑取边缘圆滑、表面凸起光滑、针尖状、半透明的菌落继续划线纯化直至长出形态单一菌落,命名为LNFX0225,然后进行革兰染色及镜检。
1.2.2 生化试验 挑取上述单个菌落接种于TSB试管中,37℃培养18 h。用接种针蘸取试管中菌液分别接种于麦芽糖、氧化酶、吲哚等微量生化鉴定管中,同时在每个微量生化鉴定管添加5 μL 0.1 mg/mL的NAD,并设置对照管。37℃培养24 h后,观察判定结果。 此外,将分离菌与金黄色葡萄球菌接种于无NAD的血平板上,两种菌株垂直划线培养,观察有无溶血及卫星现象[15]。
1.2.3 DNA提取及16 S rRNA PCR鉴定 将TSB中的菌液吸取1 mL放入灭菌1.5 mL离心管中,10 000 r/min离心3 min,弃掉上清液,加入200 μL的灭菌蒸馏水,抽吸混匀后,100℃水浴8 min,取出后12 000 r/min离心2 min,取上清作为DNA模板。副猪嗜血杆菌16 S rRNA的引物设计参照宋帅等[16]的方法,上游引物:5′-GATGAGGAAGGGTGGTGT-3′;下游引物:5′-GGCTTCGTCACCCTCTGT-3′,预期扩增片段大小822 bp。引物由上海生工生物工程技术服务有限公司合成。反应体系为20 μL:2×TaqPCR Master Mix 10 μL,上游引物1 μL,下游引物1 μL,DNA模版2 μL,ddH2O 6μL。PCR扩增程序:95 ℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,共30个循环;72 ℃ 7 min,4℃结束反应。PCR产物经10 g/L琼脂糖凝胶电泳验证后,送上海生工生物工程技术服务有限公司测序,将测得的序列在NCBI核酸数据库中进行Blastn搜索。
1.2.4 OmpP5基因的扩增和克隆 根据HaemophilusparasuisSH0165基因序列(GenBank登录号:CP001321)用生物软件Premier Primer5.0设计1对扩增副猪嗜血杆菌OmpP5基因片段的特异性引物,预期扩增目的片段大小为1 116 bp。上游引物(P1)序列为5′-CATGAAAAAATCTTTAATTGC-3′,下游引物(P2)序列为:5′-TTACATAGAAACTTCTTTTG-3′,引物由上海生工生物工程技术服务有限公司合成。以测序结果为副猪嗜血杆菌的DNA作为模板,反应体系为20 μL:2×TaqPCR Master Mix 10 μL,上游引物1 μL,下游引物1 μL,DNA模版2 μL,ddH2O 6 μL。PCR扩增程序:94℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,共30个循环;72℃ 10 min,4 ℃结束反应。扩增产物经10 g/L琼脂糖凝胶电泳后观察。
用DNA琼脂糖凝胶回收试剂盒回收OmpP5基因的PCR产物,进行和载体的连接,连接体系为5 μL,包括胶回收产物4 μL,Peasy-T5 Zero Cloning载体 1 μL。反应条件为25℃ 15 min。将连接产物全部转入至刚解冻的Trans1-T1 Phage Resistant感受态细胞中,冰浴30 min后,42℃水浴热激30 s,然后快速将管转移至冰浴中2 min,之后加入250 μL的LB培养基,200 r/min 37℃培养1 h,取100 μL菌液涂布于含氨苄青霉素抗性的LB琼脂平板上, 37℃培养12 h 后,挑取白色单个菌落,接种于含有氨苄青霉素的LB液体培养基中,37℃培养8 h。然后以碱裂解法小剂量制备质粒, 并进行PCR鉴定, 将初步鉴定为阳性的重组质粒送上海生工生物工程技术服务有限公司测序。
1.2.5 OmpP5核苷酸序列分析 将分离菌株的OmpP5核苷酸序列与GenBank上其他副猪嗜血杆菌参考株OmpP5序列用DNA Star中的MegAlign软件进行核苷酸序列比对,分析同源性并构建系统进化树,确定副猪嗜血杆菌阜新株OmpP5基因遗传进化情况。
2 结果
2.1 临床症状和病理变化
患病猪呼吸困难,关节肿大,体温高达41.3℃,寒颤,精神沉郁,不喜食。剖检后发现患病猪肺脏有化脓性纤维渗出物,心包积液、心包膜增厚粗糙,腹腔积液,肝脾肿大并与腹腔粘连,关节发生病变,有絮状沉积物。
2.2 细菌分离纯化及镜检结果
将TSA平板上生长出来的疑似Hps的菌落用接菌环挑出后继续划线培养18 h,生长出边缘整齐、液滴状、半透明、直径约为1 mm的单一菌落后,进行革兰染色,证实为革兰阴性菌(图1),细菌形态呈现出短小杆状,无芽胞,多单在,也有短链排列,长短不一的细菌形态(图2)。

图1 分离菌株在TSA培养基上的菌落形态(400×)

图2 分离菌株革兰染色结果
2.3 生化试验结果
将分离菌接入TSB培养基培养18 h后,用接种针沾取菌液接种到含有NAD的生化管中, 37℃培养18 h。结果显示,分离菌株与副猪嗜血杆菌的生化特性相符(表1)。将分离菌和金黄色葡萄球菌共培养时,未出现溶血现象,但产生了卫星现象 (图3)。
2.4 分离菌16 S rRNA 基因扩增结果
取5 μL PCR产物进行琼脂糖凝胶电泳后在凝胶成像仪中观察显示,目的条带822 bp,与预期结果一致(图4)。将PCR产物送往上海生工生物工程技术服务有限公司测序后,将测序结果在NCBI数据库中进行比对分析。结果显示,与参考菌株Haemophilusparasuisstrain RU15-5P 16 S rRNA(GU226377.1)序列的同源性达99%,因此可以确定分离菌为Hps。

表1 分离菌株生化试验结果
注:-.阴性;+.阳性。
Note:-.Negative;+.Positive.

图3 分离菌和金黄色葡萄球菌共培养出现卫星现象

M.DNA 标准DL 5 000;1.分离菌株16 S rRNA PCR扩增产物;2.ddH2O阴性对照;3.阳性对照
M.DNA Marker DL 5 000;1.16 S rRNA PCR amplification products;2.Negative control with H2O;3.Positive control
图4分离菌株16 S rRNA PCR结果
Fig.4 PCR amplification results of the 16 S rRNA of the isolate
2.5 OmpP5基因扩增结果
提取分离菌DNA为模板,扩增其OmpP5基因,结果扩增到1 116 bp的目的条带(图5)。将目的条带与载体连接后转入大肠埃希菌感受态细胞中,并在含有氨苄抗性的培养基上培养12 h,之后进行PCR鉴定,鉴定结果显示扩增到1 116 bp的目的条带(图6)。

M.DNA 标准DL 5 000;1.分离菌株OmpP5 PCR扩增产物;2.ddH2O阴性对照
M.DNA Marker DL 5 000;1.OmpP5 PCR amplification products;2.Negative control with H2O
图5分离菌株OmpP5基因的PCR扩增结果
Fig.5 PCR amplification results of the isolate OmpP5 gene
2.6 OmpP5基因序列比对及基因进化分析
将测序结果在NCBI数据库中Nucleotide Blast进行比对分析。结果显示,与Hps的OmpP5相匹配,与Hps参考菌株的同源性为89%~99%。利用DNA Star中的MegAlign功能对测得的序列与参考序列进行同源性比较和进化树分析,结果显示,分离株与№4菌株位于同一分支上,与参考菌株№4(EU741877.1)、SW140(EU741870.1)、SW114(EU741871.1)、131(EU741874.1)、SH0165(CP001321.1)、HS1072(FJ667986.1)、174(EU741875.1)、C5(HM172045.1)、D74(EU741869.1)、H367(HM172046.1)、H465(HM172047.1)、H425(HM172048.1)、SC030(HM747110.1)、IA-84-22113(HM172050.1)、SD-84-15995(HM172051.1)的同源性为89.8%~99.5%(图7和图8)。
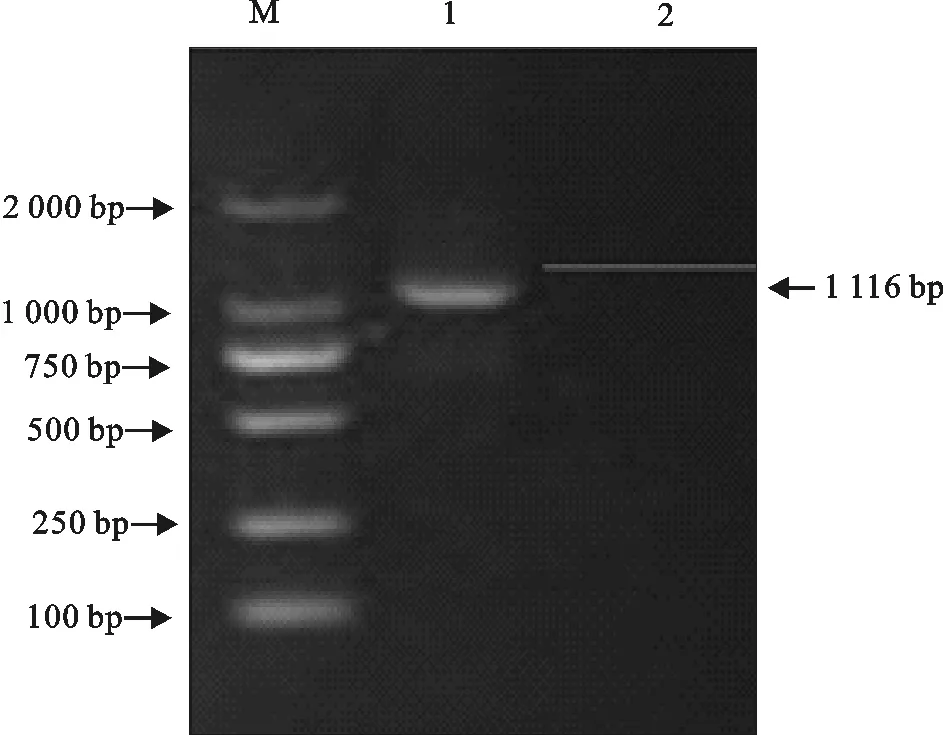
M.DNA 标准DL 2 000;1.分离菌株OmpP5 PCR扩增产物;2.ddH2O阴性对照
M.DNA Marker DL 2 000;1.OmpP5 PCR amplification products;2.Negative control with H2O
图6重组质粒OmpP5基因的PCR鉴定结果
Fig.6 PCR identification of recombinant plasmid OmpP5 gene
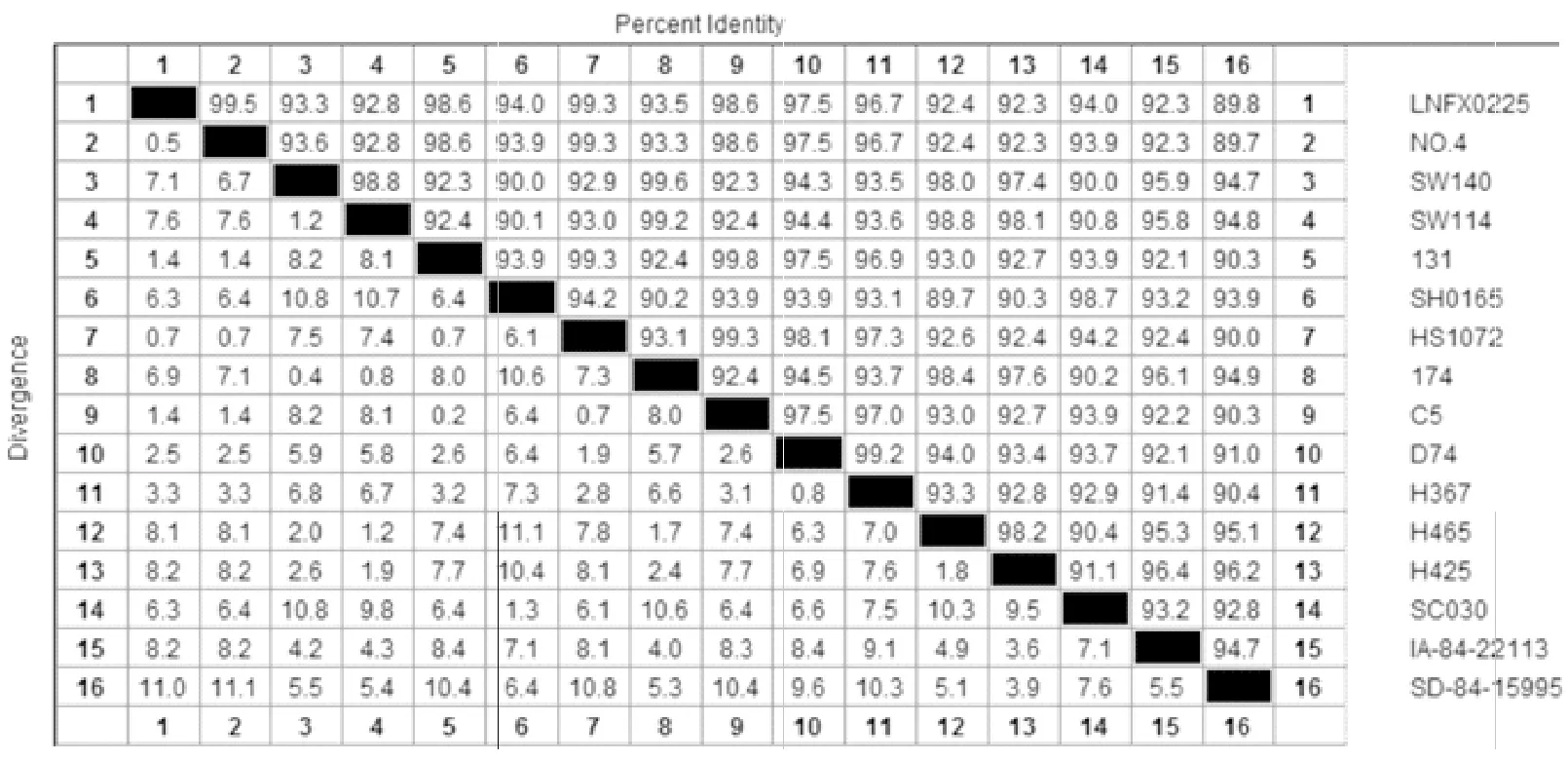
图7 Hps分离株LNFX0225 OmpP5基因核苷酸序列同源性比较
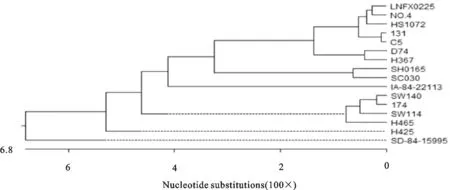
图8 Hps分离株LNFX0225 OmpP5基因核苷酸序列系统进化树
3 讨论
目前,Hps的分离还是比较困难的,原因在于Hps的生长要求比较苛刻,营养要求较高,生长速度慢。首次分离培养时需要环境中有体积分数为5%的CO2,体外培养时需要烟酰胺腺嘌呤二核苷酸(NAD或V因子)以及50 mL/L的胎牛血清[17]。Hps与金黄色葡萄球菌在血平板共培养时能产“卫星现象”的原因就是因为金黄色葡萄球菌能分泌Hps生长所需的NAD,使得金黄色葡萄球菌周边的Hps生长良好,而稍远处的Hps生长缓慢。研究表明,从病料分离该菌的最佳时间为12 h之内[18]。正是由于这些培养特性,使得Hps的实际发病率远远高于临床分离率。
Hps有15个血清型,另有20%是不能分型的。不同血清型致病力也不尽相同。近年来,根据Hps血清型的流行调查显示,4、5及13型是国内外主要流行血清型,东北地区主要流行5型和13型[19]。发病呈现季节性,一般秋冬季节高发。Hps除强毒株能够引起发病外,中毒和弱毒株常与其他病原体混合感染,最常见的混合病原体有猪圆环病毒2型、猪肺炎支原体、猪繁殖与呼吸综合征病毒、猪流感病毒和猪呼吸道冠状病毒等[20-21]。所以,防控本病除提高饲养管理水平外,还需做好其他病原体的免疫工作以及减少应激的发生。
本试验所用的载体为pEASY-T5 Zero Cloning kit,该载体的特点是连接速度快,并且该载体能够通过是否表达自杀基因来筛选阳性重组子。当片段与载体连接成功时,自杀基因无法表达,倒入感受态细胞后可以正常生长。当片段没有与载体连接成功,载体导入感受态细胞后,自杀基因表达,导致感受态细胞不能存活。使用该载体可以略去蓝白斑筛选试验,减化了试验的操作流程。
关于Hps毒力基因的报道已经很多,现已确定Hps编码的外膜蛋白OmpP5基因与该菌的黏附及定植相关,OmpP5蛋白能够参与机体早期的免疫应答反应,给受体猪感染Hps菌液或注射灭活苗后均能检测到OmpP5抗体,说明OmpP5蛋白可能成为疫苗的候选蛋白[22-23]。张斌等[24]在研究Hps外膜蛋白P5的免疫保护性时发现,OmpP5蛋白具有较强的抗原性和部分免疫保护作用。本研究对Hps辽宁株的OmpP5基因进行了鉴定并与Hps不同菌株的OmpP5基因进行了同源性比较及发育树的构建,结果显示,该分离株的OmpP5基因与№4在同一分支上,与所有参考菌株的同源性在89.7%~99.5%之间,并且与HS1072瑞士分离株、131日本分离株、C5菌株和№4菌株同源性均达到98%以上,说明OmpP5基因具有一定的保守性。至于毒力基因OmpP5的致病机理还需进一步研究。
[1] Bigas A,Garrido M E,Badiola I,et al.Colonization capacity and serum bactericidal activity ofHaemophilusparasuisthy mutants[J].Int Microbiol,2006,9(4):297-301.
[2] 江 军,姜 平,王一成,等.浙江省副猪嗜血杆菌血清型调查及其潜在毒力相关基因分析[J].畜牧与兽医,2016,48(8):1-7.
[3] 李曦婷,王 超,薛彦杰,等.一例副猪嗜血杆菌的分离鉴定及16S rRNA生物信息学分析[J].沈阳农业大学学报,2016,47(4):438-444.
[4] Brockmeier S L,Register K B,Kuehn J S,et al.Virulence and draft genome sequence overview of multiple strains of the swine pathogenHaemophilusparasuis[J].PLoS One,2014,9(8):e103787.
[5] Dai K,Jin J,Wen Y P,et al.Complete genome sequence of highly virulentHaemophilusparasuisserotype 11 strain SC1401[J].Genome Announc,2016,4(4):e00628-00616.doi:10.1128/genomeA.00628-16.
[6] Vanier G,Szczotka A,Friedl P,et al.Haemophilusparasuisinvades porcine brain microvascular endothelial cells[J].Microbiology,2006,152(1):135-142.
[7] Cerda-Cuellar M,Aragon V.Serum-resistance inHaemophilusparasuisis associated with systemic disease in swine[J].Vet J,2008,175(3):384-389.
[8] Smith S G,Mahon V,Lambert M A,et al.A molecular Swiss army knife:OmpA structure,function and expression[J].FEMS Microbiol Lett,2007,273(1):1-11.
[9] Novinrooz A,Zahraei Salehi T,Firouzi R,et al.In-silico design,expression,and purify ication of novel chimericEscherichiacoliO157:H7 OmpA fused to LTB protein inEscherichiacoli[J].PLoS One,2017,12(3):e0173761.
[10] Macedo N,Cheeran M C,Rovira A,et al.Effect of enrofloxacin onHaemophilusparasuisinfection,disease and immune response[J].Vet Microbiol,2017,199:91-99.
[11] 陈小飞,张 斌,郭定乾,等.副猪嗜血杆菌血清型和外膜蛋白P5基因型多样性的研究[J].中国畜牧兽医,2013,40(2):143-146.
[12] Euba B,Moleres J,Viadas C,et al.Relative contribution of P5 and Hap surface proteins to nontypableHaemophilusinfluenzae interplay with the host upper and lower airways[J].PLoS One,2015,10(4):e0123154.
[13] Zhang B,Xu C,Zhou S,et al.Comparative proteomic analysis of aHaemophilusparasuisSC096 mutant deficient in the outer membrane protein P5[J]. Microb Pathog,2012,52(2):117-124.
[14] 乐 敏.副猪嗜血杆菌基因组学及毒力相关因子研究[D].湖北武汉:华中农业大学,2010.
[15] 蒋增海,徐耀辉,邓同炜,等.副猪嗜血杆菌分离鉴定及药敏试验[J].动物医学进展,2016,37(6):124-128.
[16] 宋 帅,李春玲,杨冬霞,等.副猪嗜血杆菌hhdA基因的鉴定和分析[J].湖南农业大学学报:自然科学版,2011,37(3):291-301.
[17] 李曦婷.辽宁地区副猪嗜血杆菌的分离鉴定及耐药性研究[D].辽宁沈阳:沈阳农业大学,2017.
[18] 陈 勇,高 艳,张定全,等.副猪嗜血杆菌的分离鉴定与培养基筛选[J].动物医学进展,2013,34(10):67-71.
[19] Zhang J,Xu C,Guo L,et al.Prevalence and characterization of genotypic diversity ofHaemophilusparasuisisolates from southern China[J].Can J Vet Res,2012,76(3):224-229.
[20] Kavanová L,Prodělalová J,Nedbalcová K,et al.Immune response of porcine alveolar macrop hages to a concurrent infection with porcine reproductive and respiratory syndrome viru s andHaemophilusparasuisinvitro[J]. Vet Microbiol,2015,180(1-2):28-35.
[21] 左明开,曾文斌,刘悦欣,等. 猪蓝耳病病毒、猪链球菌及副猪嗜血杆菌混合感染的诊治[J].畜牧与兽医,2016,48(6):146-147.
[22] Olvera A,Pina S,Pérez-Simó M,et al.Virulence assoeiated trimeric autotran sporters ofHaemophilusparasuis are antigenic proteins expressedinvivo[J].Vet Res,2010,41(3):26.
[23] Zheng X,Yang X,Li X,et al.Omp16-based vaccine encapsulated by alginate-chitosan micros pheres provides significant protection againstHaemophilusparasuisin mice[J].Vaccine,2017;35(10):1417-1423.
[24] 张 斌,海 泉,汤 承,等.副猪嗜血杆菌外膜蛋白P5的抗原特性研究[J].中国兽医科学,2012,42(12):1230-1236.

