环丝氨酸在耐多药结核病化学治疗中应用价值的探讨
李杨 王飞 吴琍敏 朱敏 何贵清 孙峰 王晓萌 张文宏
环丝氨酸是D-丙氨酸类似物,能通过抑制D-丙氨酸消旋酶和D-丙氨酸连接酶阻碍细菌细胞壁的合成,从而起到广谱抗菌的作用[1]。1955年Epstein等[2]首次报道了环丝氨酸在结核病治疗中的应用;1962年环丝氨酸用于耐药结核病的治疗,取得了满意的疗效[3]。但环丝氨酸应用不久后,其神经系统不良反应逐渐显现,根据早期报道,用药后惊厥发生的比率可达10%[4]。随着之后更有效药物的发明,环丝氨酸在抗结核治疗中的地位稳定在二线抗结核药物之列。由于环丝氨酸的胃肠道耐受性好,与其他抗结核药物交叉耐药少[5],世界卫生组织(World Health Organization,WHO)推荐将环丝氨酸作为耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)标准治疗方案的组成药物之一,与丙硫异烟胺(或乙硫异烟胺)、氯法齐明、利奈唑胺共同组成C组(其他核心二线抗结核药物组)药物[6]。2012年环丝氨酸经批准进入中国市场,陆续应用在MDR-TB患者的治疗中。笔者对2014—2016年浙江省2家医院的MDR-TB患者按照含环丝氨酸的标准治疗方案治疗后的结果、痰菌阴转情况及不良反应发生情况进行总结、分析。
对象和方法
一、研究对象
回顾性分析2014—2016年浙江省纳入中国全球基金耐多药结核病防治项目进行治疗的143例MDR-TB患者,其中83例来自杭州市红十字会医院,60例来自温州市中心医院。纳入标准包括:(1)基线菌株来自经药物敏感性试验(简称“药敏试验”)证实的MDR-TB患者,即菌株鉴定为结核分枝杆菌,且至少同时对利福平和异烟肼2种药物耐药;(2)初始治疗方案的制定符合《世界卫生组织耐药结核病治疗指南(2016年更新版)》[6],且治疗方案中包含环丝氨酸;(3)自愿参加本研究。排除标准包括:(1)治疗前存在精神疾病及严重神经官能症者;(2)HIV抗体检测阳性和艾滋病患者。
二、研究方法
1. 病史收集:由经过培训的固定病史采集人员通过患者就诊医院所在病案系统进行资料收集,包括:人口社会学资料、既往治疗病史、基线菌株药物敏感性信息、初始治疗方案及治疗记录、治疗过程中痰培养情况及不良反应记录。
2. 药敏试验:采用改良罗氏培养基和比例法进行分枝杆菌药物敏感性测定。
3. 治疗方案制定:根据WHO推荐方案,初始治疗方案中分为6个月强化期和18个月巩固期。强化期须包括吡嗪酰胺、氟喹诺酮类药物(左氧氟沙星、莫西沙星)、二线注射类药物(卷曲霉素、阿米卡星、卡那霉素)、丙硫异烟胺、环丝氨酸;巩固期须包括吡嗪酰胺、氟喹诺酮类药物(左氧氟沙星、莫西沙星)、丙硫异烟胺、环丝氨酸。如以上药物(环丝氨酸除外)缺货或患者药物不良反应强烈,应按照WHO指南推荐,在D组药物(高剂量异烟肼、乙胺丁醇、贝达喹啉、德拉马尼、对氨基水杨酸、亚胺培南西司他丁、美罗培南、阿莫西林克拉维酸、氨硫脲)中再选用其他药物,达到5种有效药物作为初始治疗方案。
4. 随访与监测:在患者治疗过程中对其血常规、肝功能、肾功能、听力、痰抗酸杆菌培养等进行随访,频率为每个月1次。同时通过影像学检查对患者肺部病灶变化情况进行疗效随访。对治疗过程患者可能出现的不良反应进行监测,包括胃肠道反应、药物性肝损伤、中枢神经系统症状、精神异常、低钾血症、关节疼痛、甲状腺功能减退、耳毒性、周围神经病变等。其中中枢神经系统症状包括头痛、眩晕、嗜睡、失眠、惊厥、抽搐等;精神症状包括抑郁、自杀、焦虑或精神异常症状等。
5. 治疗结局判断:根据WHO《结核病定义和报告框架(2013年修订版)》[7],治愈是指规律完成治疗且无证据显示治疗失败,而且强化期后最少连续3次痰培养阴性,每次至少间隔30 d;完成治疗是指规律完成治疗且无证据显示治疗失败,但没有记录表明强化期后最少连续3次痰培养阴性,每次至少间隔30 d;治愈和完成治疗合称为治疗成功。治疗失败是指因为以下原因需要终止治疗或永久性更换至少2种抗结核药物,包括:①强化期末出现痰菌阴转;②痰菌阴转后在巩固期内出现痰菌复阳;③或药物不良反应。死亡是指治疗过程中由于任何原因出现的结核病患者死亡;失访是指治疗中断连续2个月或以上的结核病患者。痰菌阴转和痰菌复阳均需连续2次痰菌培养结果一致。
三、统计学分析
结 果
一、基线资料
纳入的143例MDR-TB患者年龄在15~72岁,平均年龄为(44.5±12.2)岁,以男性为主(69.2%,99/143)。初次就诊即诊断为MDR-TB的患者仅占5.6%(8/143),62.2%(89/143)的患者在接受本次MDR-TB规范治疗之前接受过一线抗结核药物治疗。56.6%(81/143)的患者基线胸部X线摄影检查提示病灶累及3个或3个以上肺野,80.4%(115/143)的患者有肺部空洞形成。二线抗结核药物药敏试验测定结果显示:30例患者除对利福平和异烟肼耐药外,还对一类氟喹诺酮类药物(左氧氟沙星、莫西沙星、加替沙星)或氨基糖苷类药物(阿米卡星、卡那霉素、卷曲霉素)耐药;另有8例患者临床分离菌株显示对氟喹诺酮类药物和氨基糖苷类药物均耐药。
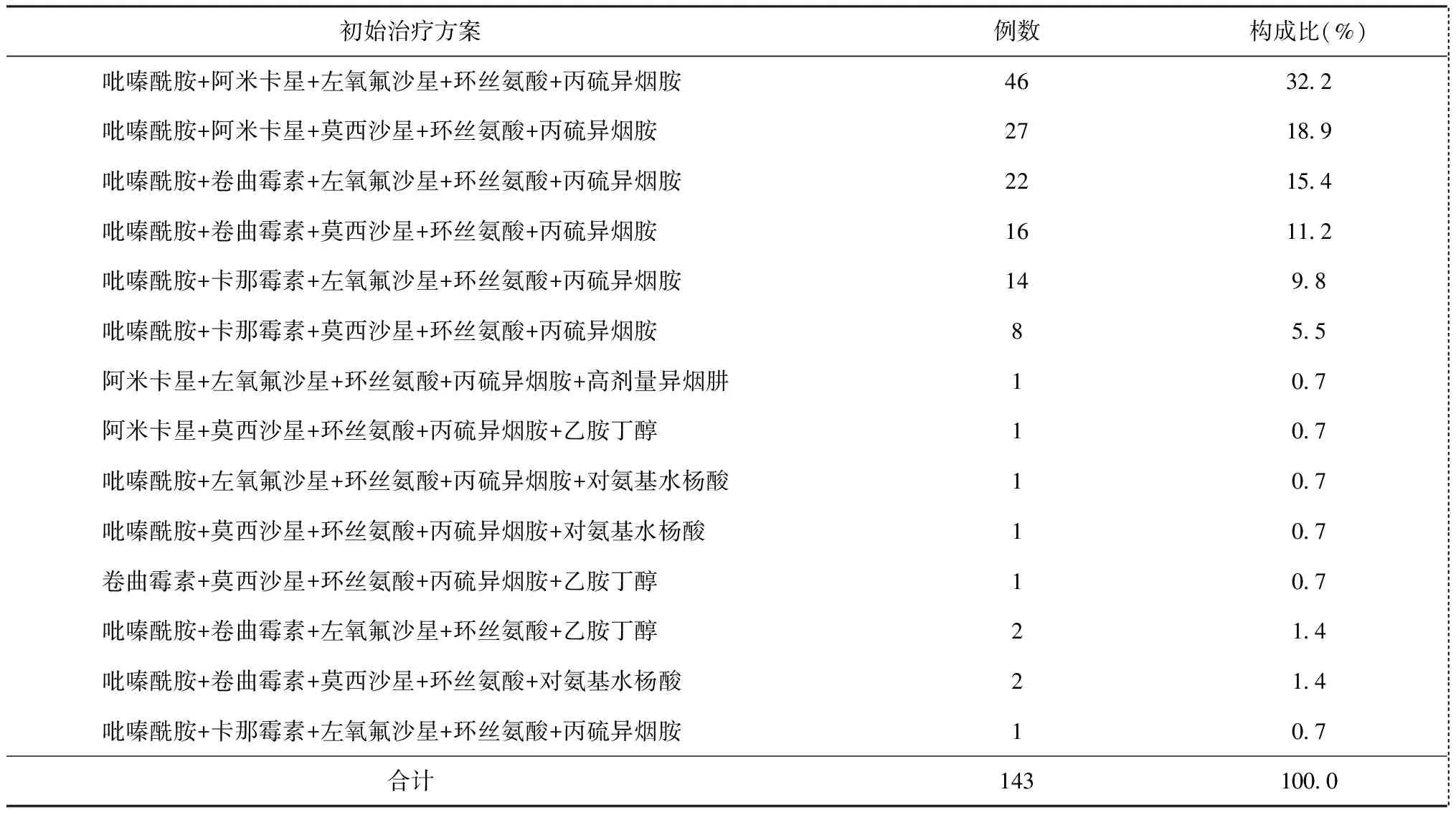
表1 143例患者初始治疗方案构成情况
二、初始治疗方案
143例患者初始治疗方案见表1。以吡嗪酰胺+阿米卡星+左氧氟沙星+环丝氨酸+丙硫异烟胺为最常见的初始治疗方案,高剂量异烟肼、乙胺丁醇、对氨基水杨酸作为备选药物,加入部分患者的初始治疗方案中。
三、治疗结果
143例患者中治愈和完成治疗患者的比率分别为65.0%(93/143)和4.2%(6/143),治疗成功率达到69.2%(99/143)。除去药敏试验证实对二线抗结核药物耐药的患者(38例)外,其余105例患者治疗成功率达到80.0%(84/105)。判断为治疗失败的患者中,因强化期末痰菌未阴转、痰菌阴转后复阳、不良反应造成治疗失败的例数分别为13、8和16例,各占失败患者例数的35.1%、21.6%、43.3%。总体失访率为4.9%(7/143)。
67.1%(96/143)的患者在治疗开始后3个月内实现痰菌阴转。强化期末(6个月)实现痰菌阴转的比率达到81.1%(116/143)。17例患者在治疗结束时仍未实现痰菌阴转,治疗失败。143例患者不同治疗时间痰菌转阴情况见表2。
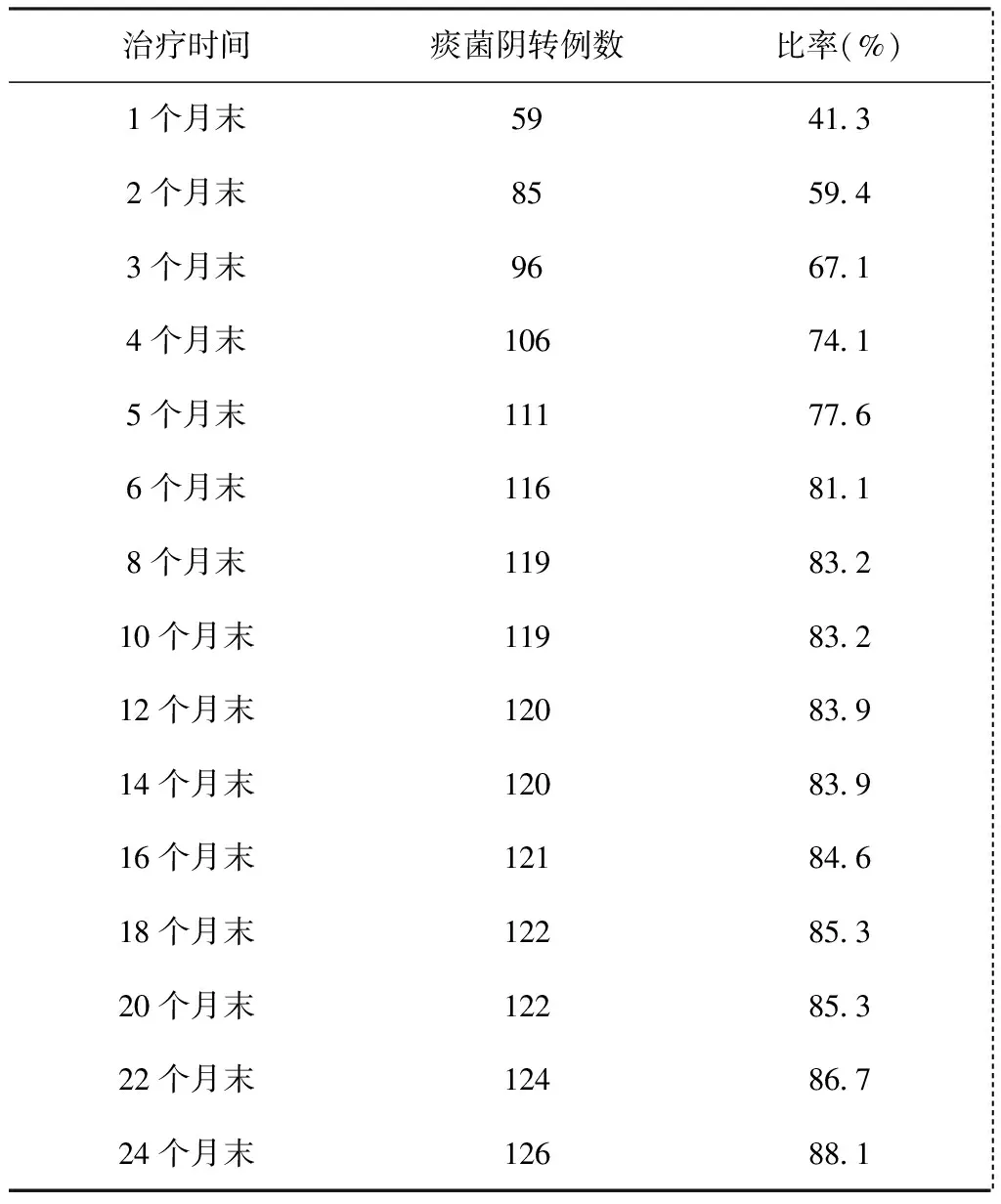
表2 143例患者不同治疗时间的痰菌阴转情况
四、不良反应监测
90.2%(129/143)的患者在治疗过程中发生过至少1次药物不良反应,所有不良反应在药物减量或者加用对症药物后可缓解。最常见的为高尿酸血症和关节疼痛,其余较常见的不良反应有药物性肝损伤和低钾血症。神经系统不良反应的发生率较低,包括失眠、头晕、头痛、四肢麻木、抽搐、癫痫,共计20例;其中有12例(7例头晕、头痛,3例四肢麻木,2例抽搐)考虑与环丝氨酸治疗相关,另外 8例则考虑与其他药物包括左氧氟沙星、莫西沙星、利奈唑胺的使用有关。另有1例患者使用环丝氨酸后出现情绪低落。具体用药后不良反应发生情况详见表3。
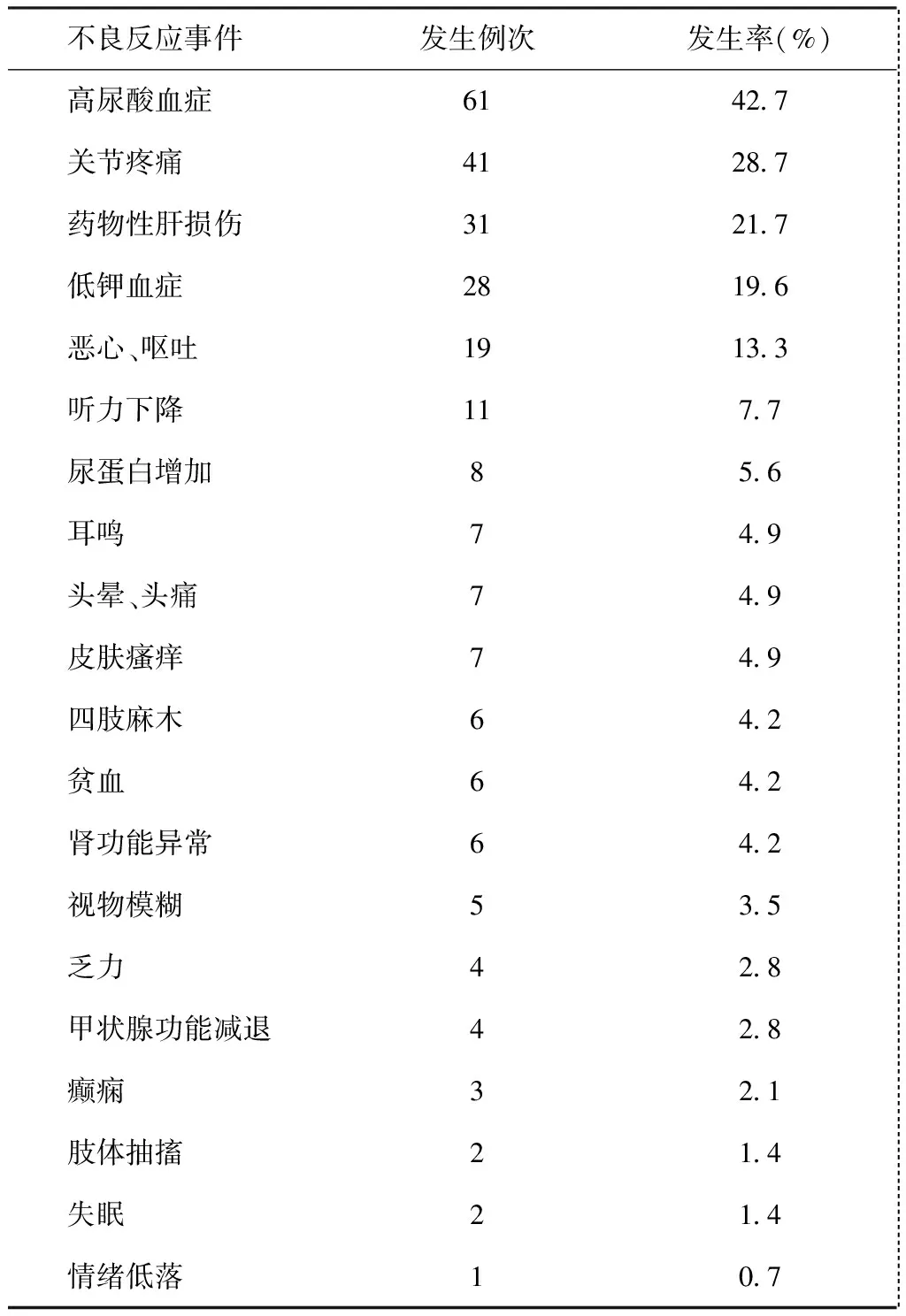
表3 143例患者药物不良反应发生情况
讨 论
耐药结核分枝杆菌的出现已经成为目前结核病控制的巨大威胁。2016年全球新发MDR-TB患者例数达到4900万,其严峻形势在高结核病负担国家中更加突出。印度、中国和俄罗斯3个国家共占全球MDR-TB患者例数的47%。中国2016年MDR-TB发病率为5.2/10万,新发患者例数居世界第二位[8]。MDR-TB较对药物敏感的结核病治疗所需药物种类更多、时间更长、花费更高。根据最新数据,随着WHO在全球推广DOTS策略和遏制结核病战略的开展,结核病总体治疗成功率已经达到83%,但与此同时,MDR-TB治疗成功率仅为54%,中国的这一比率更低,只有41%[8]。
WHO《耐药结核病治疗指南(2016年更新版)》[6]推荐MDR-TB的治疗至少包含5种不同的有效药物,包括吡嗪酰胺和4种核心药物[A组(氟喹诺酮类药物)1种药、B组(二线注射类药物)1种药,C组(其他核心二线药物)2种药]。如以上不能组成有效方案,可从D组(非MDR-TB核心治疗药物)中再挑选药物以组成含5种有效药物的联合用药方案。在4种C组药物中,除丙硫异烟胺已广泛应用在国内MDR-TB的治疗中,其他药物在国内的实际推广仍需进一步讨论。利奈唑胺的价格昂贵,口服药物供应受限;氯法齐明皮肤不良反应明显[9],目前仍主要用于麻风病的治疗[5]。相比之下,环丝氨酸药物可及性更高,不良反应也相对容易耐受。但环丝氨酸于2012年进入中国,对于MDR-TB治疗效果及药物不良反应的发生情况亟待总结。
本研究中,含环丝氨酸的标准MDR-TB治疗方案取得69.2%的治疗成功率,强化期内痰菌阴转的比率超过80%,这些结果提示环丝氨酸可能能够有效改善MDR-TB患者的治疗结局。多种药物联合使用引起的严重不良反应如急性肝衰竭、难以纠正的低钾血症、听力损伤等是造成治疗失败的重要原因。既往存在1个月以上的二线抗结核药物暴露史或对二线抗结核药物耐药也是引起痰菌阴转失败的关键因素[10]。
环丝氨酸是N-甲基-D-天冬氨酸(NMDA)受体的部分激动剂[11],能很好地透过血脑屏障而引起一系列神经、精神相关的不良反应,包括头痛、晕眩、抑郁、异常精神行为等[12-16]。故WHO指南并不推荐在既往有精神疾病或心理障碍的MDR-TB患者中应用。本研究纳入的患者中,共有13例患者的不良反应(包括头晕、头痛7例,四肢麻木3例,肢体抽搐2例,情绪低落1例)被认为与环丝氨酸的使用有关,发生率为9.1%,其余均可以良好耐受。其中2例发生肢体抽搐的患者均在治疗期间有饮酒史;7例患者发生头晕、头痛等不良反应,其中部分患者初始治疗剂量过大(0.5 g/次,2次/d),调整剂量后(0.25 g/次,2次/d)头痛症状好转。发生情绪低落不良反应者为1例老年女性,既往有8年肺结核病史,本次治疗中还出现过因服用吡嗪酰胺出现关节疼痛导致无法耐受,以及严重胃肠道反应,在治疗第5个月出现情绪低落,后经心理支持治疗后继续采用环丝氨酸治疗。本研究环丝氨酸的不良反应发生率与早期的国际报道基本一致,但国外报道精神症状如情绪低落较神经系统损伤如头痛、抽搐更为常见[17];一种可能的解释是这些精神症状往往是各类因素的综合作用,包括社会支持网络缺乏、长期治疗后心理创伤等[18]。而随着临床医生对MDR-TB治疗的重视程度加深,现对MDR-TB治疗的多方面支持较以往有所进步。
综上,环丝氨酸作为目前MDR-TB治疗的核心药物有着良好抗结核活性。根据目前国内前期研究及本研究数据,含环丝氨酸的标准MDR-TB治疗方案能实现满意的治疗结局与痰菌转归,同时药物耐受性较好,值得在临床上推广应用。
[1] David HL, Laszlo A, Rastogi N. Mode of action of antimycobacterial drugs. Acta Leprol, 1989, 7 Suppl 1: 189-194.
[2] Epstein IG, Nair KG, Boyd LJ. Cycloserine, a new antibiotic, in the treatment of human pulmonary tuberculosis: a preliminary report. Antibiotic Med Clin Ther (New York), 1955, 1(2):80-93.
[3] Somner AR, Brace AA. Ethionamide, pyrazinamide and cycloserine used successfully in the treatment of chronic pulmonary tuberculosis. Tubercle, 1962, 43: 345-360.
[4] Cohen AC. Pyridoxine in the prevention and treatment of convulsions and neurotoxicity due to cycloserine. Ann N Y Acad Sci, 1969, 166(1):346-349.
[5] Caminero JA, Sotgiu G, Zumla A, et al. Best drug treatment for multidrug-resistant and extensively drug-resistant tuberculosis. Lancet Infect Dis, 2010, 10(9):621-629.
[6] Falzon D, Schünemann HJ, Harausz E, et al. World Health Organization treatment guidelines for drug-resistant tuberculosis, 2016 update. Eur Respir J, 2017, 49(3). pii: 1602308.
[7] World Health Organization. Definitions and reporting framework for tuberculosis-2013 revision. Geneva: World Health Organization, 2013.
[8] World Health Organization. Global tuberculosis report 2017. Geneva: World Health Organization, 2017.
[9] Xu HB, Jiang RH, Xiao HP. Clofazimine in the treatment of multidrug-resistant tuberculosis. Clin Microbiol Infect, 2012, 18(11):1104-1110.
[10] Hu Y, Zheng X, Ning Z, et al. Impact of genotypic and phenotypic resistance to second-line anti-tuberculosis drugs on treatment outcomes in multidrug-resistant tuberculosis in China. Int J Mycobacteriol, 2016, 5 Suppl 1: S34-S35.
[11] Prosser GA, de Carvalho LP. Kinetic mechanism and inhibition ofMycobacteriumtuberculosisD-alanine:D-alanine ligase by the antibiotic D-cycloserine. FEBS J, 2013, 280(4):1150-1166.
[12] A PILOT study of cycloserine toxicity; a United States Public Health Service Cooperative Clinical Investigation. Am Rev Tuberc, 1956, 74(2 Part 1):196-209.
[13] Kendig IV, Charen S, Lepine LT. Psychological side effects induced by cycloserine in the treatment of pulmonary tuberculosis. Am Rev Tuberc, 1956, 73(3):438-441.
[14] 马丙乾. 耐多药肺结核患者使用环丝氨酸的不良反应观察及处理. 中国防痨杂志, 2016, 38(2): 156-158.
[15] 唐志冈, 易恒仲, 罗丹霖, 等. 96例耐多药肺结核患者使用环丝氨酸导致神经、精神系统不良反应. 中国防痨杂志, 2015, 37(2): 203-205.
[16] 宋艳华, 郭少晨, 高孟秋, 等. 环丝氨酸治疗耐多药结核病的血药浓度及不良反应监测. 中国防痨杂志, 2014, 36(5): 399-401.
[17] Hwang TJ, Wares DF, Jafarov A, et al. Safety of cycloserine and terizidone for the treatment of drug-resistant tuberculosis: a meta-analysis. Int J Tuberc Lung Dis, 2013, 17(10):1257-1266.
[18] Vega P, Sweetland A, Acha J, et al. Psychiatric issues in the management of patients with multidrug-resistant tuberculosis. Int J Tuberc Lung Dis, 2004, 8(6):749-759.

