2013—2015年温州市耐多药肺结核患者队列标准化疗方案的治疗转归
何贵清 孙峰 苏菲菲 施伎蝉 朱海燕 戴建义 杨守峰 宁洪叶 崔小亚 李君桦 蒋贤高 张文宏
耐药结核病是一个重要的公共卫生问题。2016年,估计全世界有49万例耐多药结核病(MDR-TB)患者,另有11万例为利福平(R)耐药结核病(RR-TB)患者;其中印度、中国和俄罗斯联邦占全球MDR-TB和RR-TB患者总数的47%;2016年,约24万例患者死于MDR-TB和(或)RR-TB[1]。我国耐药结核病疫情严峻,初治患者中MDR-TB患者占5.7%,复治患者中占25.6%;广泛耐药结核病(XDR-TB)在MDR-TB患者中约占8%[2]。目前,耐多药肺结核传统标准化疗方案的疗程长,至少≥20个月,需含有4~5种有效的二线抗结核药物组成化疗方案[3],药品价格昂贵,而且不良反应大,严重影响患者的治疗依从性和治愈率[4]。全球MDR-TB患者的治疗成功率较低,2017年全球结核病年度报告MDR/RR-TB和XDR-TB患者队列研究的治疗成功率分别为54%和30%[1]。
2009—2013年浙江省在全球基金耐多药结核病项目支持下,分别在杭州、湖州、绍兴、嘉兴、衢州、丽水等6个市开展了耐多药肺结核防治项目,取得理想成绩,治疗成功率为69.6%,失访率仅为4.8%[5]。温州市中心医院是温州市唯一的MDR-TB患者定点诊治中心,自2013年8月开始进行耐多药肺结核标准化药物治疗方案的研究。因此,笔者对温州市2013年8月至2015年12月纳入耐多药肺结核标准化药物治疗方案的耐多药肺结核患者进行分析,评价治疗转归,了解基线耐药情况及临床特点,并分析与预后相关的影响因素。
资料和方法
一、研究对象
2013年8月至2015年12月温州市11个区(县)(鹿城区、龙湾区、瓯海区、洞头区、瑞安市、乐清市、永嘉县、平阳县、苍南县、文成县、泰顺县)结核病定点医院及市级定点医院(温州市中心医院),共筛查出耐多药肺结核患者198例,均转诊至温州市中心医院。其中10例患者拒绝接受治疗,3例患者治疗前已死亡,2例患者治疗前已失访;另43例患者化疗方案及转归不详;1例患者基线临床分离菌株经过3次药物敏感性试验(简称“药敏试验”)复核,结果对一线抗结核药物均敏感;另7例基线临床分离菌株16SrRNA和hsp65基因测序鉴定为非结核分枝杆菌(NTM)感染(胞内分枝杆菌3例、脓肿分枝杆菌3例、偶发分枝杆菌1例)。通过筛查,应该纳入MDR-TB治疗方案的患者有132例,其中16例为非标准化MDR-TB治疗方案,故最终纳入标准化MDR-TB治疗方案116例 (包括49例全球基金耐多药项目和67例地区性项目)。对116例患者的治疗转归结果进行分析。纳入MDR-TB治疗方案的患者均签署知情同意书,由市级专家组讨论制定MDR-TB治疗方案。患者信息详细登记于《耐多药与广泛耐药肺结核患者病案手册》并进行督导治疗,以便随访转归情况。
二、研究方法
1.耐药类型定义:(1) MDR-TB。为至少同时对异烟肼(H)和R耐药的结核病。(2) 早期广泛耐药结核病(pre-XDR-TB)。除对H和R耐药之外,对任何一种氟喹诺酮类药物,或对3种二线抗结核药物注射剂[卷曲霉素(Cm)、卡那霉素(Km)和阿米卡星(Am)]中的至少 1 种耐药。(3) XDR-TB。除对H和R耐药之外,同时对任何一种氟喹诺酮类药物及对 3种二线抗结核药物注射剂(Cm、Km和Am)中的至少 1 种耐药。
2. 治疗转归定义:(1) “治愈”指患者完成化疗疗程,在疗程的后12个月,至少最后5次痰MTB培养(每次间隔至少30 d)连续阴性者;如出现1次痰MTB培养阳性,其后痰MTB培养(其间隔至少30 d)最少连续3次阴性。(2) “完成治疗”指患者完成了疗程,但缺乏细菌学检查结果(即在治疗的最后12个月痰培养的次数少于5次),不符合治愈的标准。(3) “死亡”指在治疗过程中患者由于各种原因而导致的死亡。(4) “失败”指在疗程的后12个月,最后5次痰MTB培养中有2次或2次以上阳性;或最后的3次痰MTB培养中有任何一次是阳性即为失败。(5) “失访”指患者中断治疗达连续2个月或2个月以上。(6) “治疗成功”指包括治愈和完成治疗的患者。
3. 治疗原则:使用标准化耐多药肺结核化疗方案,全疗程分为注射期和非注射期;耐多药肺结核化疗疗程为24个月,注射期至少6个月,且痰培养阴转后至少4个月;广泛耐药肺结核疗程为30个月,注射期12个月。治疗方案的设计考虑患者的既往治疗史,尤其是氨基糖苷类和氟喹诺酮类药物的治疗史;采用4~5种有效的抗结核药物,药物的剂量应根据患者体质量而定。
4. 治疗方案:标准化耐多药肺结核化疗方案分为MDR-TB方案和XDR-TB方案,分别为:6Z-Km(Am,Cm)-Lfx(Mfx)-Cs(PAS,E)-Pto/18Z-Lfx(Mfx)-Cs(PAS,E)-Pto;12Cm-Mfx-PAS-Cs-Clr-“Amx-Clv”/18Mfx-PAS-Cs-Clr-“Amx-Clv”。化疗方案中,Z为吡嗪酰胺、E为乙胺丁醇、Km为卡那霉素、Am为阿米卡星、Cm为卷曲霉素、Lfx为左氧氟沙星、Mfx为莫西沙星、Pto为丙硫异烟胺、PAS为对氨基水杨酸、Amx-Clv为阿莫西林-克拉维酸、Clr为克拉霉素。
5. 药物不良反应处理及治疗方案调整:详细资料参考文献[6]。
6. 分枝杆菌培养和菌种鉴定:痰液和支气管肺泡灌洗液标本采用改良罗氏法或BACTEC MGIT 960 液体培养法。对于培养阳性菌株经抗酸涂片确认阳性,而在含对硝基苯甲酸培养基上生长或MPB64抗原检测阴性,初步鉴定为非结核分枝杆菌的菌株,进一步采用16SrRNA[7]和hsp65基因测序[8],测序结果在美国国立生物技术信息中心(NCBI)网站上进行BLAST(basic local alignment search tool)序列比对,以确认菌种。
7. 药敏试验:4种一线抗结核药物[包括H、R、链霉素(S)、E]采用BACTEC MGIT 960 液体药敏试验,药物浓度分别为0.1 μg/ml、1.0 μg/ml、5.0 μg/ml 和1.0 μg/ml;4种二线抗结核药物[包括氧氟沙星(Ofx)、Km、Am和Cm]的药敏试验采用罗氏比例法,药物浓度分别为 2 μg/ml、30 μg/ml、30 μg/ml和40 μg/ml。药物浓度参考文献[9]确定。
三、统计学分析
结 果
一、116例耐多药肺结核患者基线特征及其临床特点
其中,初治患者39例(33.6%)、复治患者77例(66.4%);男83例(71.6%)、女33例(28.4%);平均年龄(48.7±12.6)岁、年龄范围15~77岁,以30~60岁为主(69.0%)。患者入组时最常见症状为咳嗽(97.4%)和咯血(29.3%);并发糖尿病32例(27.6%);HIV抗体阴性108例(93.1%)、不详8例(6.9%);肺部病灶有空洞者89例(76.7%)。耐多药肺结核患者基线菌株二线抗结核药物药敏试验已做91例(78.4%),其中单纯MDR-TB患者 31例(26.7%),pre-XDT-TB 患者47例(40.5%),XDR-TB患者 13例(11.2%);另25例(21.6%)基线菌株未找到,故二线抗结核药物的药敏试验无法获得。失访发生于非注射期者20例(60.6%)。详见表1。
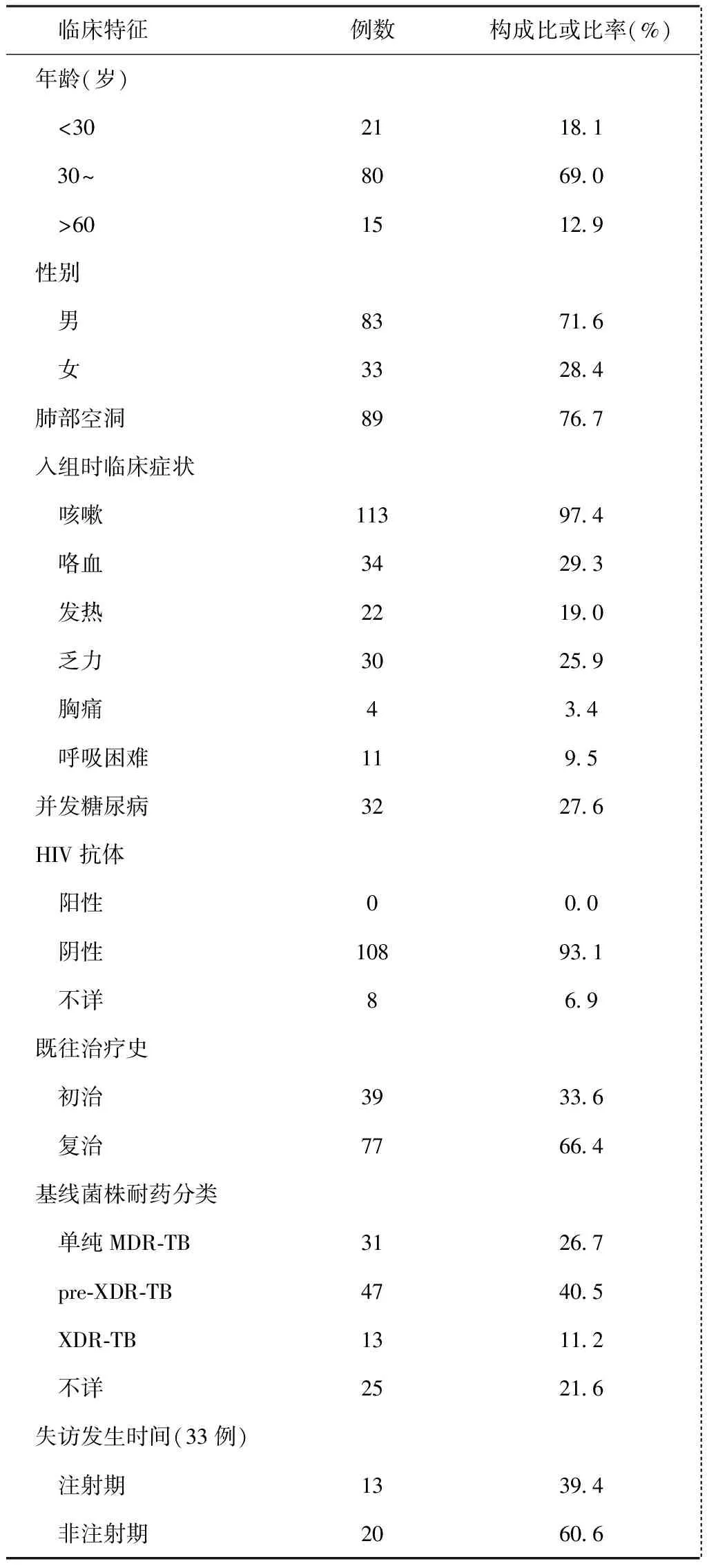
表1 本研究116例纳入标准化耐多药肺结核化疗患者的临床特征
注单纯MDR-TB指同时耐异烟肼和利福平,但不耐二线注射剂(氨基糖苷类)和氟喹诺酮类
二、耐多药肺结核患者的治疗转归
1.初治与复治患者的治疗转归比较:116例耐多药肺结核患者,治疗成功59例(50.9%)、治疗失败19例(16.4%)、死亡5例(4.3%)、失访33例(28.4%)。初治患者的治愈率(66.7%)、治疗成功率(69.2%)高于复治患者(分别为32.5%和41.6%),差异均有统计学意义(χ2=12.290,P=0.000和χ2=7.932,P=0.005)。初治患者的治疗失败率(2.6%)低于复治患者(23.4%),差异有统计学意义(χ2=8.187,P=0.004)。两组患者的死亡率和失访率比较,差异均无统计学意义。详见表2。
2.不同耐药类型患者治疗转归比较:单纯MDR-TB患者在治愈率上分别高于pre-XDR-TB患者和XDR-TB患者,差异有统计学意义(分别为χ2=9.648,P=0.002和χ2=10.064,P=0.002);单纯MDR-TB患者在治疗成功率上分别高于pre-XDR-TB患者和XDR-TB患者,差异有统计学意义(分别为χ2=4.753,P=0.029和χ2=10.064,P=0.002);单纯MDR-TB患者在治疗失败率上分别低于pre-XDR-TB患者和XDR-TB患者,差异有统计学意义(分别为χ2=4.914,P=0.027和χ2=12.645,P=0.000)。单纯MDR-TB患者在死亡率和失访率上分别与pre-XDR-TB患者和XDR-TB患者比较,差异均无统计学意义。详见表3。
三、耐多药肺结核患者基线菌株耐药情况
在已知二线抗结核药物药敏试验结果的91例耐多药肺结核患者中,单纯MDR-TB、pre-XDR-TB和XDR-TB患者分别占34.1%、51.6%和14.3%。其中对Ofx耐药者占63.7%(58/91);Km与Am完全交叉耐药,耐药比例占16.5%(15/91),而与Cm部分交叉耐药(占53.3%,8/15)。详见表4、5。
四、不同耐药类型对患者痰菌阴转率的影响
单纯MDR-TB患者痰菌阴转率(87.1%, 27/31)高于pre-XDR-TB患者(66.0%, 31/47)和XDR-TB患者(38.5%, 5/13),且三组间比较差异有统计学意义(log-rank趋势检验,χ2=14.500,P<0.001),见图1。有2例pre-XDR-TB患者治疗12个月后痰菌一直阳性,分别于第15个月和第16个月加用利奈唑胺后第3个月和第4个月痰菌出现阴转;有2例XDR-TB患者注射期后痰菌一直阳性,分别于第15个月和第21个月加用利奈唑胺治疗1个月后,均出现痰菌阴转。
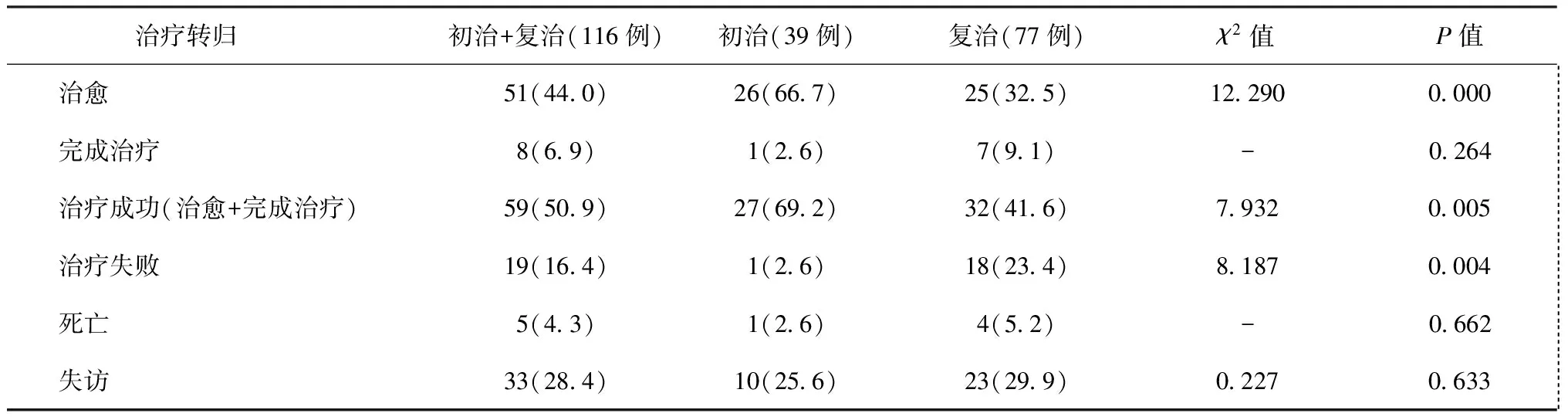
表2 116例耐多药肺结核患者治疗转归在既往不同治疗史分类中的分布与比较
注统计学检验及结果是指初治与复治患者治疗转归之间进行的比较;“-”为采用Fisher精确检验;表中括号外数值为“患者例数”,括号内数值为“比率(%)”
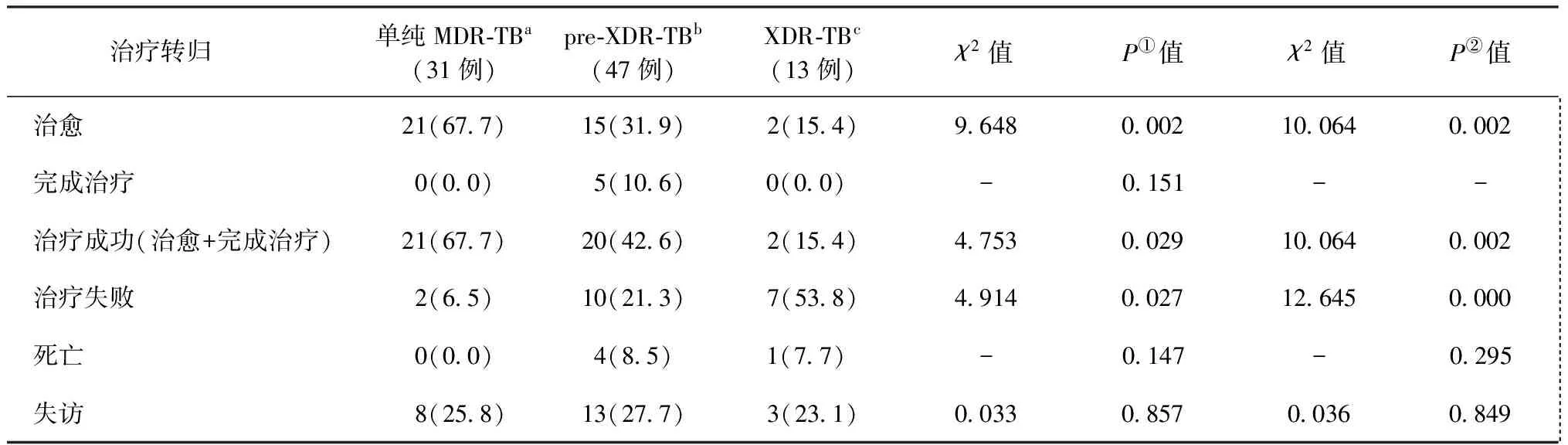
表3 91例耐多药肺结核患者治疗转归在不同耐药分类中的分布与比较
注单纯MDR-TB指同时耐异烟肼和利福平,但不耐二线注射剂(氨基糖苷类)和氟喹诺酮类;①:表示b与a比较;②:表示c与a比较;“-”为采用Fisher精确检验; 表中括号外数值为“患者例数”,括号内数值为“比率(%)”
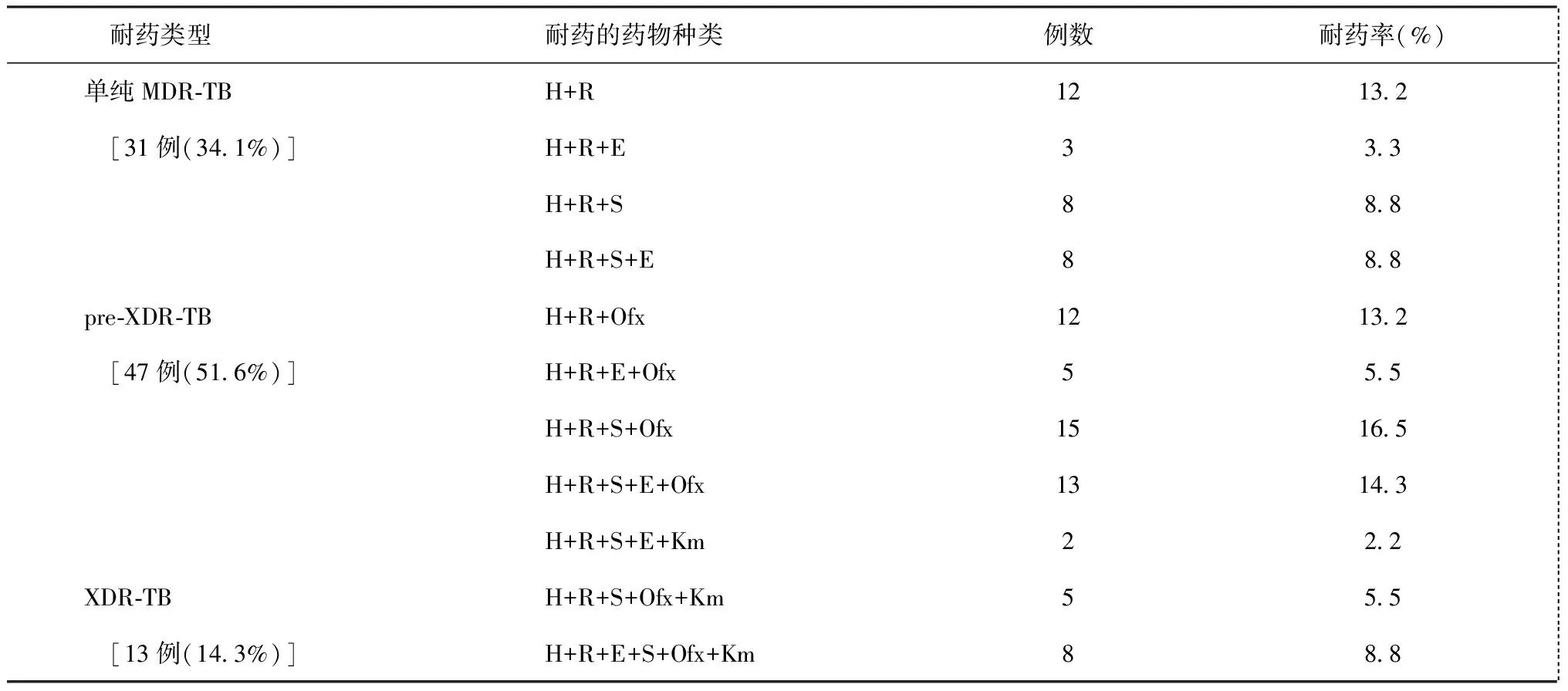
表4 91例耐多药肺结核患者基线菌株进行一、二线抗结核药物药敏试验的结果分析
注单纯MDR-TB指同时耐异烟肼和利福平,但不耐二线注射剂(氨基糖苷类)和氟喹诺酮类;H为异烟肼,R为利福平,E为乙胺丁醇,S为链霉素,Ofx为氧氟沙星,Km为卡那霉素
讨 论
本研究发现,温州市耐多药肺结核治疗成功率为50.9%(59/116),低于全球平均水平(54%)[1],亦低于浙江(69.6%)[5]、湖南(57%)[10],且远低于目标治疗成功率(75%)[11],更是低于韩国(91%)、缅甸(80%)、索马里(76%)、哈萨克斯坦(76%)等国家[1]。另外,本研究队列失访率高达28.4%,高于北京(17.4%)[12]、深圳(12.5%)[13]、广州(6%)[14]、浙江(4.8%)[5]等国内大多数研究,而与湖南(27%)相一致[10]。失访患者大部分发生在非注射期,可能与疗程长、不良反应大、患者难以坚持有关。因此,必须加强管理督导,及时处理不良反应,提高治疗依从性。二线抗结核药物价格昂贵,部分患者由于经济困难,短期内可以坚持,长期服药费用贵,往往中断治疗。另一部分患者自认为症状改善、胸部CT检查显示好转及痰菌阴转就意味着治愈,加上长期服药所产生的不良反应,拒绝进一步治疗,本该可以治疗成功的患者往往失访后返回,痰菌再次转阳,后期治疗相当棘手。
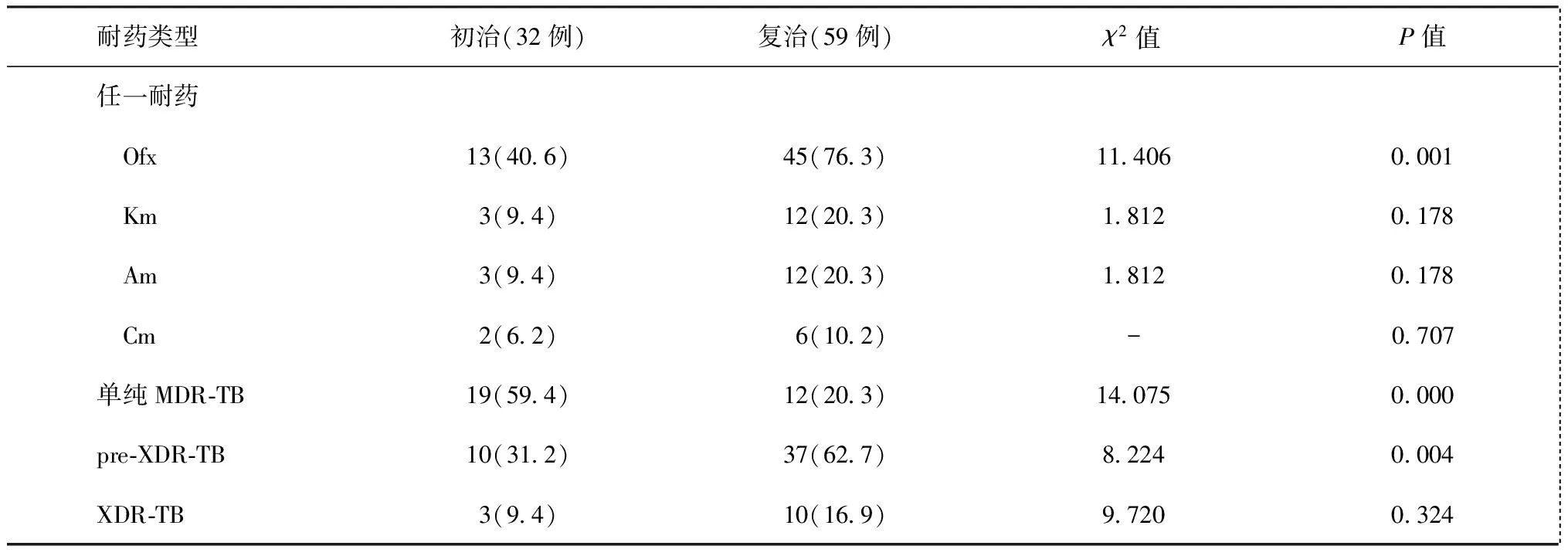
表5 基线二线药物不同耐药类型在初、复治患者中的分布与比较
注单纯MDR-TB指耐异烟肼和利福平,但不耐二线注射剂(氨基糖苷类)和氟喹诺酮类;表中括号外数值为“患者例数”,括号内数值为“耐药率(%)”;Ofx为氧氟沙星,Am为阿米卡星,Km为卡那霉素、Cm为卷曲霉素;“-”为采用Fisher精确检验
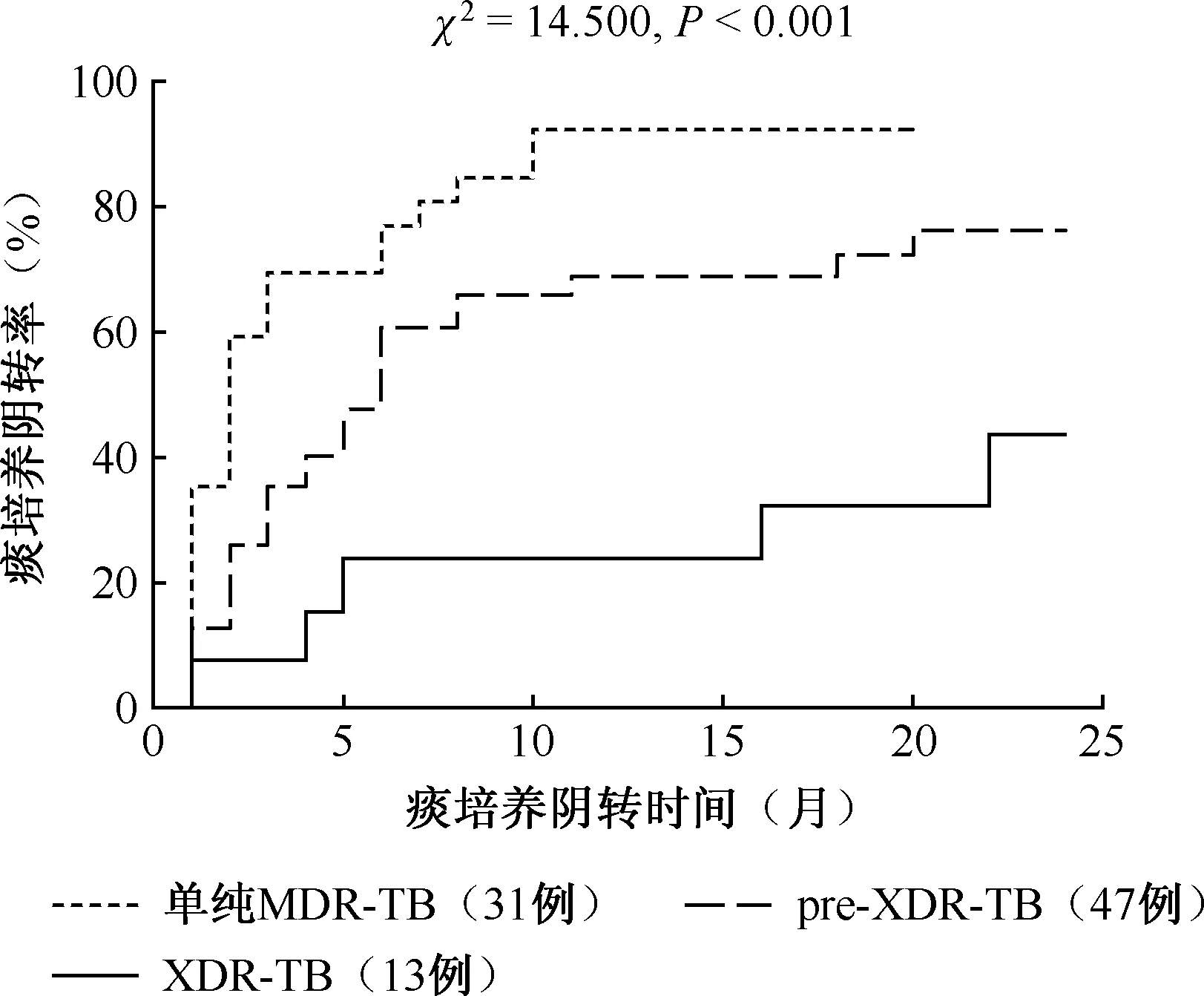
图1 不同耐药类型患者的痰菌阴转率比较
值得注意的是,通过对已知基线菌株二线抗结核药物药敏试验结果分类发现,pre-XDR-TB(51.6%)和XDR-TB(14.3%)耐药率高于浙江 (17%和11.9%)[5],而XDR-TB耐药率低于山东(27.9%)[15]。有研究报道,对氟喹诺酮类和(或)二线药物注射剂的耐药与治疗预后有相关性[10,16-17]。目前,国内绝大多数结核病实验室仅开展对一线抗结核药物的药敏试验,对二线抗结核药物的药敏试验并非常规开展,而是等待一线抗结核药物药敏试验结果报告为对R和H耐药后,才继续检测二线抗结核药物;考虑表型药敏试验结果的时间滞后性,部分患者因起始方案无效或不充分可能导致治疗失败或对抗结核药物的耐药种类扩大,更关键的是等二线抗结核药物表型药敏试验结果出来时,此时的结果并非反映此刻患者体内MTB的真正表型耐药性,特别对于温州pre-XDR-TB患者所占比率如此之高的队列而言,治疗成功率低是可想而知的。
本队列研究发现,初治患者的治疗成功率明显高于复治患者,考虑与复治患者对二线抗结核药物的耐药率较高有关。按耐药结核病分类比较,三组中单纯MDR-TB患者的治疗成功率(67.7%)高于pre-XDR-TB患者(42.6%)和XDR-TB患者(15.4%); XDR-TB治疗成功率远低于全球平均水平(30%)[1],而与山东相一致(14.6%)[15]。按耐药结核病分类比较三组的痰菌阴转率,同样发现单纯MDR-TB患者明显高于pre-XDR-TB和XDR-TB患者。以上数据更加证实温州队列pre-XDR-TB和XDR-TB患者所占比率高(>2/3)必然会影响治疗成功率。温州市队列中对Ofx耐药者占63.7%,可能与临床上抗生素使用不合理有关,特别是初治患者对Ofx的耐药率高达40.6%,可能是耐药分枝杆菌的传播所致,有待进一步证实。MDR-TB化疗方案中常见的氟喹诺酮类药物(如Lfx和Mfx)存在一定的交叉耐药[18],必须引起临床医生注意。在如此高耐药的情况下,如果没有及时完善应用的每种二线药物的药敏试验,将很难保证化疗方案的有效性。
传统标准化疗方案不仅疗程长,而且不良反应大,难以坚持,治疗成功率较低。然而,孟加拉、喀麦隆、尼泊尔等研究采用9~12个月的缩短疗程方案,治疗成功率竟高达89%~93.1%。因此,在这种背景下,2016 年WHO推出9~12个月缩短MDR-TB化疗疗程的方案[19];该方案不适用于对氟喹诺酮类或二线注射剂耐药的患者,特别在pre-XDR-TB高发地区,该方案可能会导致治疗失败。目前,MDR-TB疫情严峻,不仅需要探索更加合理有效的方案,期待有效安全的新药加入;而且需快速地准确进行对一、二线药物,特别是要开展对氟喹诺酮类和二线注射剂、Z等重要药物的药敏试验,以指导临床个体化治疗方案的制定,尽早实行有效的治疗方案,以控制传染源、减少耐药菌的传播。
综上所述,温州市治疗耐多药肺结核患者的成功率不高,且有较高的失访率。而初治患者及单纯MDR-TB患者治疗成功率较高。本队列pre-XDR-TB患者的比率较高,降低了痰菌阴转率和治疗成功率。应开展快速筛查MDR-TB患者和及时完善对二线抗结核药物的药敏试验,缩短等待报告的时间,以便尽早进行有效治疗;同时要加强督导,及时处理药物不良反应,减少对患者的失访率和提高治愈率。
[1] World Health Organization. Global tuberculosis report 2017. Geneva: World Health Organization, 2017.
[2] Zhao Y, Xu S, Wang L, et al. National survey of drug-resistant tuberculosis in China. N Engl J Med,2012, 366(23): 2161-2170.
[3] Falzon D, Jaramillo E, Schünemann HJ, et al. WHO guidelines for the programmatic management of drug-resistant tuberculosis: 2011 update. Eur Respir J, 2011,38(3): 516-528.
[4] Falzon D, Schünemann HJ, Harausz E, et al. World Health Organization treatment guidelines for drug-resistant tuberculosis, 2016 update. Eur Respir J,2017,49(3):pii: 1602308.
[5] Zhang L, Meng Q, Chen S, et al. Treatment outcomes of multidrug-resistant tuberculosis patients in Zhejiang, China, 2009—2013. Clin Microbiol Infect,2017, pii: S1198-743X(17)30363-4.
[6] 浙江省疾病预防控制中心.浙江省耐多药肺结核防治工作指南.杭州:浙江省疾病预防控制中心,2014.
[7] Turenne CY, Tschetter L, Wolfe J, et al. Necessity of quality-controlled 16SrRNAgene sequence databases: identifying nontuberculous Mycobacterium species. J Clin Microbiol, 2001,39(10): 3637-3648.
[8] Ringuet H, Akoua-Koffi C, Honore S, et al.hsp65 sequencing for identification of rapidly growing mycobacteria. J Clin Microbiol, 1999,37(3): 852-857.
[9] Barrera L, Cooreman E, de Dieu Iragena J, et al. Policy gui-dance on drug-susceptibility testing (DST) of second-line antituberculosis drugs. Geneva: World Health Organization,2008.
[10] Alene KA, Yi H, Viney K, et al. Treatment outcomes of patients with multidrug-resistant and extensively drug resistant tuberculosis in Hunan Province, China. BMC Infect Dis, 2017, 17(1): 573.
[11] World Health Organization. The global plan to stop TB 2011—2015: transforming the fight towards elimination of tuberculosis. Geneva: World Health Organization, 2010.
[12] Liu CH, Li L, Chen Z, et al. Characteristics and treatment outcomes of patients with MDR and XDR tuberculosis in a TB referral hospital in Beijing: a 13-year experience. PLoS One, 2011, 6(4): e19399.
[13] 吕德良, 杨应周, 谭卫国, 等.深圳市耐多药结核病治疗转归分析. 中国热带医学,2016,16(7):649-652.
[14] 杜雨华, 苏汝钊, 周惠贤, 等. 116例耐多药肺结核治疗转归情况影响因素分析. 中国防痨杂志, 2012, 34(1): 19-22.
[15] He XC, Tao NN, Liu Y, et al. Epidemiological trends and outcomes of extensively drug-resistant tuberculosis in Shandong, China. BMC Infect Dis, 2017, 17(1): 555.
[16] Farhat MR, Jacobson KR, Franke MF, et al. Fluoroquinolone resistance mutation detection is equivalent to culture-based drug sensitivity testing for predicting multidrug-resistant tuberculosis treatment outcome: A retrospective cohort study. Clin Infect Dis, 2017,65(8): 1364-1370.
[17] Oliveira O, Gaio R, Villar M, et al. Predictors of treatment outcome in multidrug-resistant tuberculosis in Portugal. Eur Respir J, 2013, 42(6): 1747-1749.
[18] 中国防痨协会.耐药结核病化学治疗指南(2015). 中国防痨杂志,2015,37(5): 421-469.
[19] World Health Organization. WHO treatment guidelines for drug-resistant tuberculosis, 2016 Update. Geneva: World Health Organization, 2016.

