一线抗结核药物血药浓度与早期痰菌阴转的相关性研究
刘其会 孙峰 孙涛 贾小芳 苏菲菲 施伎蝉 张丽军 蒋贤高 张文宏
我国是结核病高发国家,结核病患者例数约占全球8.3%。随着肝肾功能异常、并发糖尿病、并发艾滋病的结核病患者数量的增多,抗结核药物治疗方案的制定亟需个体化[1]。近年来,国外研究人员在抗结核药物的药代动力学研究方面进行了较多的工作,包括体外实验、动物实验及临床研究,并且在结核病治疗过程中进行治疗药物浓度监测,为临床个体化用药提供依据[2-5]。然而,在国内鲜有在结核病患者群体中进行抗结核药物药代动力学研究及其与疗效相关性的研究。因此,笔者定点收集服用利福平(R)、异烟肼(H)、乙胺丁醇(E)这3种药物进行抗结核药物治疗患者的血浆,测定这些一线抗结核药物血药浓度,了解其在我国结核病患者中的药代动力学特点,并探讨其药代动力学参数与患者早期痰菌阴转率的相关性。
材料和方法
1.研究对象:采用前瞻性研究方法,招募温州市中心医院感染科2015年10月1日至2016年1月31日住院部的肺结核患者作为研究对象,共72例。纳入标准:(1)初治或复治次数不超过1次的肺结核患者;(2)抗结核药物治疗方案为口服R、H、E、吡嗪酰胺(Z)超过7 d,不包括其他二线抗结核药物;(3)诊断为菌阳肺结核患者或菌阴肺结核患者[5];(4)菌阳肺结核患者采用BACTEC MGIT 960系统药物敏感性试验(简称“药敏试验”)对R、H、E均敏感。
2.病史资料收集:收集研究对象基本信息,包括性别、年龄、体质量、并发疾病、合并用药、影像学检查结果、初治或复治状态、用药方案等,完成病例记录表。
3.病原学检查:所有研究对象均行痰抗酸染色涂片、痰标本液体培养及药敏试验,有条件者可行GeneXpert MTB/RIF检测。
4.治疗方案的制定及记录:参照文献[1,5]的要求根据患者体质量确定具体用药剂量。R、H、E均为每天早餐前顿服,Z为3次/d、每次2片口服。记录入组的每例研究对象药物剂量及给药时间。
5.收集血浆标本:研究对象住院期间抗结核药物治疗超过1周后,服药前0.5 h、服药后2 h、4 h、6 h、8 h采用紫帽管采血1 ml,采血后30 min之内离心,取上清,干冰转移至-80 ℃冰箱保存。
6.血药浓度监测:将所采集的样本送至上海市公共卫生临床中心Ⅰ期临床试验中心处理,采用液相色谱-串联质谱联用(LC-MS-MS)方法测定所收集样本的血浆药物浓度。
7.随访:每例研究对象每月至少来院随访1次痰涂片检查;痰培养可于治疗2个月末复查。
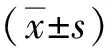
结 果
1.基本情况:本研究共招募72例口服H-R-Z-E四联抗结核药物治疗方案的肺结核患者,其中1例患者痰培养结果为耐多药肺结核,1例失访,最终纳入70例进行分析。70例研究对象中,男51例(72.9%),女19例(27.1%);平均年龄(37.01±17.07)岁,体质量指数(BMI)平均值为20.61±3.74。初治肺结核患者65例(92.9%),复治肺结核患者5例(7.1%)。10例并发糖尿病,1例并发矽肺,11例乙型肝炎病毒表面抗原阳性。既往有吸烟史者20例,有饮酒史者7例。18例患者胸部CT扫描提示有空洞病灶,5例并发结核性胸膜炎、胸腔积液。菌阳肺结核患者54例,其中47例痰或肺泡灌洗液抗酸染色涂片阳性;菌阴肺结核患者16例。所有患者HIV抗体均阴性。
2.药代动力学参数范围:所有研究对象均采用H-R-Z-E四联口服抗结核药物治疗方案。R、H、E为每天早餐前顿服。R给药剂量为(9.79±1.42) mg/kg,H为(5.29±0.96) mg/kg,E为(13.24±2.40) mg/kg。研究对象服药1周达到稳态药物浓度后进行采血,每例均采集5个时间点,即服药前0.5 h,服药后2 h、4 h、6 h、8 h,然后采用LC-MS-MS检测每份样品的药物浓度。70例研究对象共采集342份血浆标本,药代动力学参数分布情况见表1。国际上推荐的峰值浓度参考范围:R为8~24 μg/ml、H为3~6 μg/ml、E为2~6 μg/ml[6]。本次研究中,25.7%(18/70)的研究对象R峰值浓度低于推荐范围(<8 μg/ml),38.6%(27/70)H峰值浓度低于推荐范围(<3 μg/ml),65.7%(46/70)E的峰值浓度低于推荐范围(<2 μg/ml)。
3.早期痰菌阴转率与血药浓度的相关性:研究对象中54例为菌阳肺结核患者,抗结核药物治疗2个月末,进行痰涂片、痰培养检查,48例患者痰菌阴转,6例未阴转,治疗2个月末痰菌阴转率为88.9%。按照痰菌阴转和未阴转分为两组,两组患者R、H、E给药剂量接近,差异无统计学意义。对两组患者R、H、E的C2 h、Cmax、AUC0~8值进行比较,治疗2个月末痰菌阴转组患者E的C2 h、Cmax、AUC0~8值均明显高于未阴转组;H的C2 h、Cmax值均明显高于未阴转组,见表2。
讨 论
笔者收集并检测了70例肺结核患者采用抗结核药物化疗方案H-R-Z-E治疗后的血浆药物浓度,并探讨峰值浓度与治疗2个月末痰菌阴转率的相关性。目前,此类研究数量有限,国内鲜有报道。本次研究中,25.7%的患者R峰值浓度低于推荐范围,38.6%的患者H峰值浓度低于推荐范围,65.7%的患者E峰值浓度低于推荐范围。因此推测,我国部分肺结核患者血药浓度不能满足国际上推荐的参考范围,尤其是E的给药剂量为每例患者750 mg/d,平均给药剂量为(13.24±2.40) mg/kg,低于推荐的15~25 mg·kg-1·d-1[7],可能存在剂量上的不足。
70例患者中,54例为菌阳肺结核患者,一线抗结核药物治疗2个月末,48例痰菌阴转,6例未阴转,治疗2个月末痰菌阴转率为88.9%。笔者发现,治疗2个月末痰菌能否阴转可能与H、E的血药浓度相关,这个结果与H和E峰值浓度分布情况一致;38.6%的患者H峰值浓度未达到推荐范围,65.7%的患者E峰值浓度未达到推荐范围,H和E的峰值浓度符合有效浓度的患者比例偏低,故治疗2个月末痰菌未能阴转可能与H、E的血药浓度偏低有关。因此,国内H和E的给药剂量可能还需调整。本研究中,治疗2个月末痰菌阴转者R的峰值浓度与未阴转者比较未见差异,原因可能如下:一方面,此结果与上述R峰值浓度分布情况一致,大于70%的患者R的峰值浓度达到推荐范围,符合有效浓度的比例较高;另一方面,样本例数有限,2个月末痰菌未阴转者例数太少,只有6例,个体差异较大,需扩大样本量开展进一步研究。
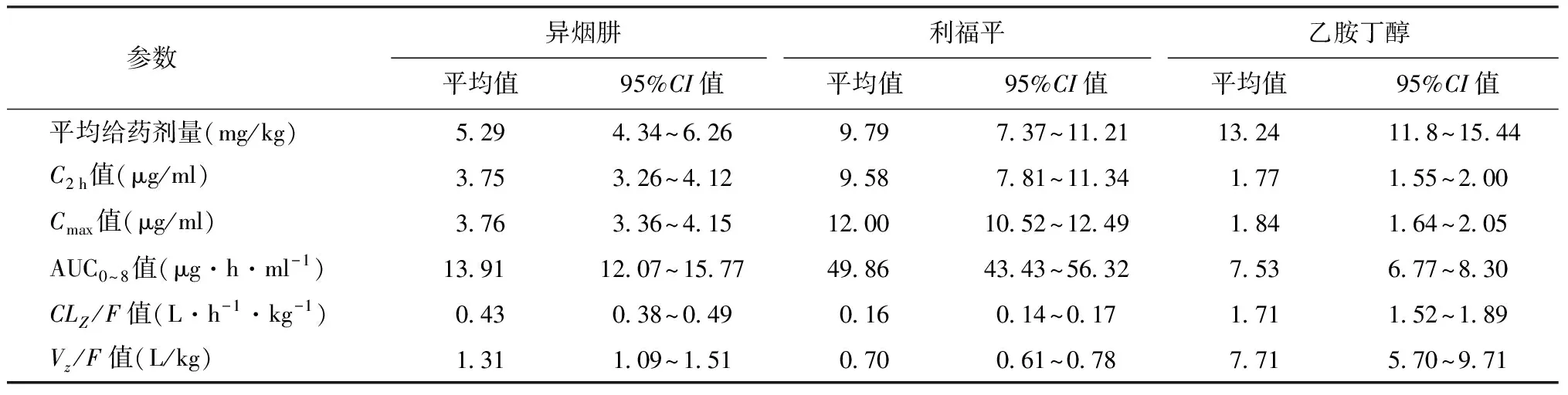
表1 研究对象异烟肼、利福平、乙胺丁醇的药代动力学参数
注C2 h:服药后2 h浓度;Cmax:峰值浓度;AUC0~8:服药后8 h曲线下面积;CLZ/F:经过生物利用度校正的清除率;Vz/F:经过生物利用度校正的表观分布容积
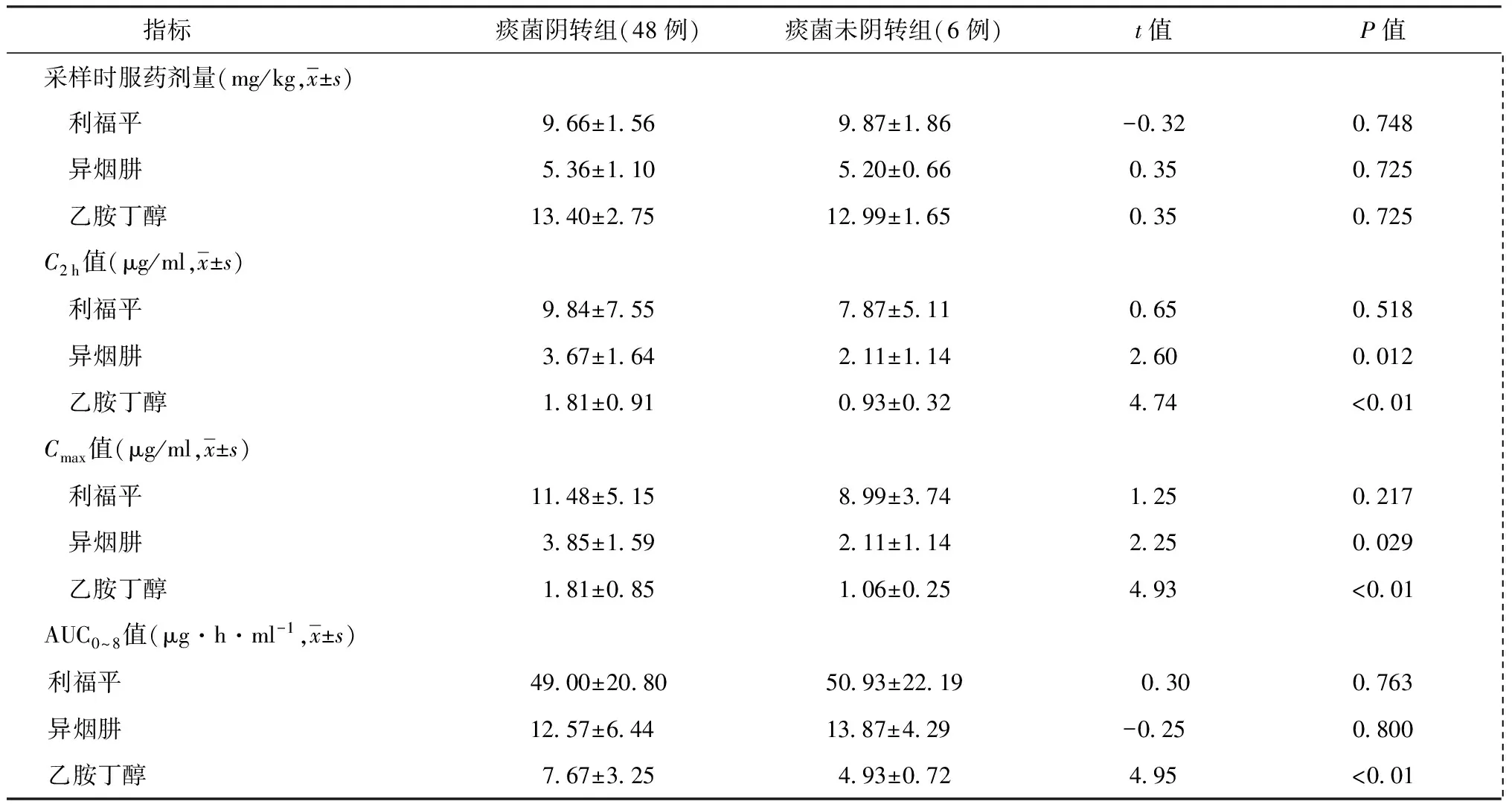
表2 治疗2个月末各类一线抗结核药物药代动力学参数在痰菌阴转组与未阴转组中的比较
注C2 h:服药后2 h浓度;Cmax:峰值浓度;AUC0~8:服药后8 h曲线下面积
本研究存在着一些不足之处:(1)样本量较小,样本量的不足可能会造成一些潜在的相关性未能发现;(2)因为Z的药物性肝损伤及胃肠道反应较大,本次研究对象的服用方案为3次/d,每次2片,口服。Z的药代动力学参数考察需要设置另一种采血方案,因此,本次研究未考察其峰值浓度及其与早期痰菌阴转率的相关性。此外,考虑到HIV感染的患者更容易出现药物吸收不良的情况,且常服用多种药物,药物与药物之间存在相互作用[8-9],HIV与MTB双重感染的患者可能相比于MTB单纯感染者更具有治疗药物浓度检测的必要性。但本次研究只检测了HIV阴性的肺结核患者,研究对象疾病类型较单一,检测的血药浓度分布范围结果可能不能向同时并发HIV感染的患者人群推广。
综上所述,肺结核患者采用标准四联抗结核药物化疗方案治疗后,部分患者血浆药物峰值浓度低于推荐参考水平,尤其是H和E,药物剂量可能需要调整。此外,本次研究发现治疗2个月末痰菌阴转率与H、E的血浆药物峰值浓度具有相关性,治疗2个月末痰菌阴转者H、E的峰值浓度明显高于未阴转者。治疗药物浓度监测广泛应用于肿瘤患者、器官移植患者及部分抗生素应用领域,但在肺结核治疗领域应用较少。因此,对活动性肺结核患者进行治疗药物浓度监测,具有临床意义和价值,值得临床医生和研究者关注和重视。
[1] World Health Organization. Global tuberculosis report 2016. Geneva: World Health Organization, 2016.
[2] Nielsen EI, Friberg LE. Pharmacokinetic-pharmacodynamic modeling of antibacterial drugs. Pharmacol Rev, 2013, 65(3): 1053-1090.
[3] Reynolds J, Heysell SK. Understanding pharmacokinetics to improve tuberculosis treatment outcome. Expert Opin Drug Metab Toxicol, 2014, 10(6): 813-823.
[4] van Heeswijk RP, Dannemann B, Hoetelmans RM. Bedaquiline: a review of human pharmacokinetics and drug-drug intera-ctions. J Antimicrob Chemother, 2014, 69(9): 2310-2318.
[5] 中华医学会结核病学分会. 肺结核诊断和治疗指南. 中国实用乡村医生杂志, 2013, 20(2): 7-11.
[6] Alsultan A, Peloquin CA. Therapeutic drug monitoring in the treatment of tuberculosis: an update. Drugs, 2014, 74(8): 839-854.
[7] 中国防痨协会. 耐药结核病化学治疗指南(2015). 中国防痨杂志, 2015, 37(5): 421-469.
[8] Tostmann A, Mtabho CM, Semvua HH, et al. Pharmacokinetics of first-line tuberculosis drugs in Tanzanian patients. Antimicrob Agents Chemother, 2013, 57(7): 3208-3213.
[9] Holland DP, Hamilton CD, Weintrob AC, et al. Therapeutic drug monitoring of antimycobacterial drugs in patients with both tuberculosis and advanced human immunodeficiency virus infection. Pharmacotherapy, 2009, 29(5): 503-510.

