76例哮喘儿童气道炎症表型分析
姚 彤, 郭 红, 陈若华
(1海军军医大学附属长海医院儿科, 上海 200433; 2新疆维吾尔自治区人民医院儿科, 乌鲁木齐 830000)
支气管哮喘(哮喘) 是被定义为典型慢性气道炎症的异质性疾病,它主要由肥大细胞、嗜酸粒细胞和T 淋巴细胞等参与。通常,哮喘的典型症状为喘息、气短、胸闷、咳嗽,但随着时间在病情轻重上有变化[1]。气道炎症是支气管哮喘患者的共同病理特征,是临床症状和气道高反应性的基础。表型常用来描述哮喘个体所表现出来的特性。迄今为止,各种各样的儿童哮喘表型分型方式已被建议,它包括首发症状的年龄、炎症细胞的类型和疾病严重程度等。气道炎症表型是最为常见的一种分型方式,哮喘的异质性决定了存在不同的气道炎症表型[2]。近年研究显示,除临床上常见的嗜酸粒细胞型哮喘(eosinophilic asthma,EA)外,还有其他炎症表型如中性粒细胞型哮喘(neutrophilic asthma,NA)、混合细胞型哮喘(mixedgranulocytic asthma,MA)和寡细胞型哮喘(paucianulocytic asthma,PA)。不同的炎症表型的发病机制有所差别,对疾病预后和治疗也产生重大影响[3]。并不是所有病人都能得到病情控制,有小部分的患者仍然为危重型哮喘,重症哮喘患者即使应用充足的治疗,在某些情况下甚至给予大剂量的治疗药物,仍然表现为难以控制的症状、频繁的发作、慢性的气流阻塞[4]。本研究对76例哮喘患儿的气道炎症表型及临床特征进行了探讨分析,为哮喘患儿不同的气道炎症表型采取个体化的治疗方案提供临床资料。
1 研究对象
1.1一般资料本次研究对象共76例,均为新疆自治区人民医院儿科2016年1月-2016年12月初诊的哮喘患儿。其中男43例,女33例;年龄6~16岁,平均年龄(10.32±3.01)岁。
1.2诊断标准哮喘诊断参照儿童支气管哮喘诊断与防治指南(2016年)[5]
1.3纳入标准(1)符合2016年发表的儿童支气管哮喘诊断与防治指南中的哮喘诊断标准[5];(2)年龄为6~16岁;(3)测定之前4 w内未使用吸入性糖皮质激素和全身糖皮质激素进行治疗;(4)能配合本研究拟进行的各项检查;(5) 2 w前无呼吸道感染,进行检查当日无发热、流涕、咽痛症状,C反应蛋白<8 mg/dL)
1.4排除标准(1)无法进行呼出气一氧化氮(FeNO)、诱导痰细胞学检查及肺功能测试者;(2)测量前四周内使用吸入或全身糖皮质激素;测量前12 h使用β2受体激动剂;前4 h 进食高氮食物;测量前剧烈运动者;(3)合并心、肺、肝、肾等重要脏器功能不全者;(4)患儿诱导痰细胞学及肺功能不符合质量控制要求。
1.5研究方法
1.5.1 FeNO测定 测定前对患儿及家长进行健康宣教,并知情同意,让患儿及其家长了解检测过程。使用FeNO测定系统(瑞典,NIOX公司),测定参照美国胸科协会1999年推荐的儿童FeNO测定标准方法进行,受试者吸不含一氧化氮(NO)气体至肺总容量,并以50 mL/s的恒定气流呼气,直至检测结束,应用NO分析仪检测并读取FeNO 浓度,重复3次,取平均值。测试患儿在测定前1 h内未进食含氮食物、蔬菜和饮料,无主动和被动吸烟,无剧烈运动,本测试均安排在肺功能检查之前进行。 FeNO 浓度判定标准:(5~19) ×109mol/L为正常,(20~34)×109mol/L为偏高,≥35×109mol/L为较高[6](1 ppb=1×109mol/L)。
1.5.2 肺功能测定 在上述测试操作完毕后,采用肺功能检测仪(型号YEGER,MS-PFT,德国耶格公司)进行测定,选取FEV1占预计值百分比(FEV1%)、FVC占预计值百分比(FVC%)、FEV1/FVC占预计值百分比作为主要评价指标,每位患儿至少测量3次,取最佳值。肺功能正常评定标准[7]: FVC占预计值百分比(FVC%)、FEV1占预计值百分比(FEV1%)均≥80% ,FEV1/FVC实测值占预计值≥92%;同时满足此标准视为正常。依据上述指标进行分组,分为肺功能正常组和肺功能异常组。
1.5.3 诱导痰细胞分类计数 使用3%的高渗盐水雾化诱导出痰液,使用0.1%二硫苏糖醇(DTT)处理痰液,经37℃水浴、过滤、离心沉淀、沉渣涂片、瑞氏染色后进行细胞分类计数,根据其结果进行气道炎症表型的划分。气道炎症表型的划分标准[8]:痰嗜酸粒细胞≥3% ,且中性粒细胞<61%为嗜酸粒细胞型;痰嗜酸粒细胞<3%,且中性粒细胞>61%为中性粒细胞型;痰本次研究对每组患者进行痰细胞学以及肺功能进行检查,嗜酸粒细胞≥3%,且中性粒细胞>61%为混合细胞型;痰嗜酸粒细胞<3%,且中性粒细胞<61%为寡炎细胞型。

2 结果
2.1根据诱导痰细胞学检查结果76例患儿中嗜酸性粒细胞型占51.3%(39/76),混合细胞型占28.9%(22/76),寡细胞型占10.5%(8/76),中性粒细胞型占9.2%(7/76) 。不同表型的哮喘患儿的痰嗜酸性粒细胞及中性粒细胞比例见表1。4种炎症表型患儿的年龄、 性别比较,差异无统计学意义(P均>0.05);嗜酸粒细胞型比其他3种炎症表型有更高的FeNO水平(P均<0.05);嗜酸粒细胞型(EA)与中性粒细胞(NA)型均较剩余两种炎症表型有显著的肺功能损害(P均<0.05),但嗜酸粒细胞型与中性粒细胞型之间肺功能差异无统计学意义(P>0.05);混合细胞型(MA)与寡细胞型(PA)肺功能比较差异无统计学意义(P>0.05)。
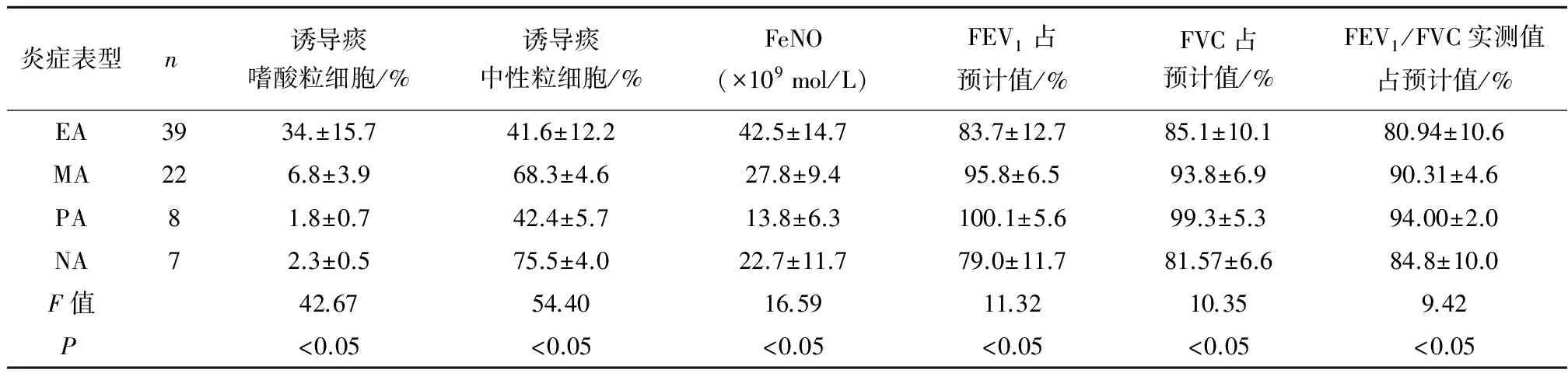
表1 76例哮喘患儿的不同气道炎症表型分布
注:EA: 嗜酸粒细胞型; MA:混合细胞型; PA:寡细胞型; NA:中性粒细胞
2.276例哮喘患儿诱导痰细胞学检查结果及气道炎症表型分布肺功能正常组27例,其中男性15例,女性12例,炎症表型构成比分别为EA22.2%、MA44.4%、PA29.6%、NA3.7%;肺功能异常组49例,其中男性28例,女性29例,炎症表型构成比分别为EA67.3%、MA20.4%、PA0.0%、NA12.2%。两组年龄均值比较差异有统计学意义(t=5.898,P<0.05);性别比差异无统计学意义(F=0.018,P<0.05)。肺功能正常组痰嗜酸性粒细胞百分比为(6.2±6.1)%、肺功能异常组痰嗜酸性粒细胞百分比为(27.9±19.2)%,2组比较差异有统计学意义(t=-14.23,P<0.05);肺功能正常组诱导痰中性粒细胞百分比为(57.3±13.3)%、肺功能异常组痰中性粒细胞百分比(49.9±18.0)%,2组比较差异有统计学意义(P<0.05);肺功能正常组FeNO水平为(21.3±9.2)×109mol/L,肺功能异常组FeNO水平为(40.0±14.9)×109mol/L,肺功能异常组比肺功能正常组有更高的FeNO水平(t=-7.8,P<0.05),结果见表2。
2.3肺功能异常组3种气道炎症表型的炎症标志物与肺功能比较对肺功能异常组3种气道炎症表型患儿的临床资料进行分析,结果见表3。嗜酸粒细胞型患儿的痰嗜酸粒细胞比例显著高于其他2组水平(P<0.05);中性粒细胞型患儿痰中性粒细胞比例显著高于其他2组(P<0.05);嗜酸性粒细胞型FeNO水平均高于其他2组(P<0.05); 3组肺功能异常哮喘患儿均表现出阻塞性通气功能障碍,其中,嗜酸性粒细胞型与中性粒细胞型的肺功能比较差异无统计学意义(P>0.05),嗜酸性粒细胞型与混合粒细胞型肺功能比著差异有统计学意义(P<0.05),嗜酸性粒细胞型肺功能损害更为严重。

表2 肺功能正常组与肺功能异常组患儿临床资料比较

表3 肺功能异常组不同气道炎症表型诱导痰细胞分类、FeNO及肺功能比较
3 讨论
本研究结果显示在哮喘患儿中,嗜酸性粒细胞型仍然是最常见的炎症表型,占51.3%,其次是混合细胞型、寡细胞型及中性粒细胞型;国外的研究结果显示,嗜酸粒细胞型哮喘约占50%,中性粒细胞型哮喘约占20%[9]。本研究中嗜酸粒细胞型比例与国外接近,中性粒细胞型哮喘比例与国外相差较远,分析其原因可能是样本量有限。肺功能正常组中混合细胞型比例最高;肺功能异常组中嗜酸性粒细胞型所占比例最高,未见到寡细胞型的炎症表型,可能也与样本量有限相关。
本研究中所有嗜酸粒细胞型哮喘患儿均具有较高的痰嗜酸粒细胞百分比和FeNO水平, 多项试验已证实FeNO与支气管哮喘者的外周血、痰液、肺泡灌洗液、支气管内膜中的嗜酸性粒细胞计数呈正相关[10]。本研究发现寡细胞型哮喘和中性粒细胞型哮喘均比嗜酸粒细胞型哮喘的痰嗜酸粒细胞水平及FeNO水平低,因此不能仅凭FeNO水平区分气道炎症表型,还需要通过诱导痰细胞学检查进一步分型。
本研究依据肺功能情况分为肺功能正常组和肺功能异常组,2组之间年龄比较差异有统计学意义,肺功能异常组平均年龄[(10.92±3.01)岁]较肺功能正常组[(9.22±2.77)岁]大。分析其原因,本研究中年长儿均为支气管哮喘初诊患儿,经历过学龄前多次病毒感染诱发的咳嗽或喘息,直至来本院就诊时仍然有咳嗽、喘息或气短等症状,随年龄增长,喘息发作总次数增加,这也符合国外较为有名的儿童哮喘研究-BASME队列研究[11],喘息发作越活跃,肺功能损害越严重,因此年长儿出现肺功能损害的可能性大,更容易分组到肺功能异常组。同时也不除外样本量小的因素。
常规药物治疗哮喘患者的效果差异较大,与不同的气道炎症表型对哮喘治疗的反应有差异相关,故通过针对不同炎症表型的治疗来改善重症哮喘患者的预后[12]。本研究中肺功能异常组比肺功能正常组有更高的痰嗜酸性粒细胞百分比和FeNO水平,肺功能异常组存在一定比例的嗜酸性粒细胞型哮喘及混合细胞型哮喘,提示这两种表型均具有Th2优势型的嗜酸粒细胞气道炎症特征。嗜酸粒细胞性气道炎症表型是激素敏感性气道疾病的标记。Berry等[13]研究表明,无论嗜酸粒细胞性炎症存在于哪种气道疾病,它比其他任何一种临床检测指标更与气道疾病激素治疗的敏感性密切相关。因此针对此种类型患者采取相应的手段如增加糖皮质激素的剂量或抗IgE单抗等靶向性治疗,以改善预后,保护肺功能[14]。根据诱导痰细胞学检查和FeNO检出嗜酸粒细胞性炎症表型的气道疾病患者,可以根据炎症反应特点,区分临床表型,选择最合适的临床治疗方法,达到最佳个体化治疗的目的。
本研究结果提示中性粒细胞型哮喘患儿其痰液嗜酸粒细胞水平及FeNO水平较低,FEV1%、FVC%、FEV1/FVC实测值占预计值百分比均显著低于混合细胞型及寡细胞型(P均<0.05),Shaw等[15]研究报道哮喘患者诱导痰液中的中性粒细胞数量与其吸入支气管舒张剂后的FEV1占预计值百分比呈负相关。Jung等[16]报道,中性粒细胞型的重症哮喘患者对激素的反应性较嗜酸性粒细胞型差,Green等[17]报道中性粒细胞性哮喘较非中性粒细胞哮喘对吸入激素治疗的反应性要差,症状难以控制,肺功能改善差。本研究发现中性粒细胞型哮喘患儿肺功能情况与上述研究结果相符,提示中性粒细胞可能在哮喘的气道炎症过程中扮演了重要角色。中性粒细胞可以分泌各种炎性因子, 引起气道黏液高分泌;哮喘患者气道中与中性粒细胞相关的IL-8、中性粒细胞弹性蛋白酶、高分子量金属蛋白酶9等增加,减少了组织抑制剂对金属蛋白酶的抑制,这些酶类的激活可能改变了气道的结构,从而导致气流受限,使得哮喘患者出现较低FEV1。但其具体的发生发展机制仍需更多的研究[18]。另外中性粒细胞表型并不是十分稳定的表型,多见于学龄前儿童的喘息、病毒或细菌感染,在感染期间,原来为嗜酸粒细胞表型的哮喘患儿可以暂时变为以中性粒细胞为主要表达的气道炎症[19]。本研究中嗜酸粒细胞型肺功能损害与中性粒细胞型相同,纳入标准中不包含感染急性期患儿,但此次检测是否能真实反映其气道炎症表型还有待长期观察。76例患儿均为初发哮喘患儿,还未能观察到中性粒细胞型哮喘患儿对治疗的反应,尚不能判断中性粒细胞型与嗜酸粒细胞型的预后是否也相当,此次观察数据可作为此型哮喘患儿长期随访的原始数据。
本研究中的寡细胞型在哮喘表型中占的比例很低,肺功能情况良好。既往研究结果显示,还有一些寡细胞型的重症哮喘患者,不存在明显的气道炎症,而以气道平滑肌增生为主要特征,其发生机制尚不清楚。因此对其临床特征和预后的判断还需要更大样本的研究来进行评价。
痰液中嗜酸粒细胞及中性粒细胞分类计数可评估哮喘相关的气道炎症,区分哮喘气道炎症表型。FeNO是目前监测哮喘嗜酸粒细胞气道炎症的简便有效的无创标志物,二者均有助于评估哮喘气道炎症表型,选择最佳哮喘治疗方案。糖皮质激素具有抑制诱导型一氧化氮合成酶的诱导作用,故使用激素治疗后会出现FeNO水平的下降。本研究中患儿为初诊患儿,测定之前4周内未使用吸入或全身用糖皮质激素,除外应用激素对FeNO测定的影响。但也有部分嗜酸性粒细胞型哮喘的FeNO在正常范围内,原因尚不明确,对于此种患儿需要长期随访,观察其动态变化。此外,动态监测FeNO还有助于评估吸入糖皮质激素(ICS)减量或停药的时机。一项在儿童哮喘中的研究结果表明,高FeNO水平(>47×109mol/L)可预测患者在ICS减量或停药后哮喘失控,其敏感度和特异度分别为71%和93%[20];而低FeNO水平(<22×109mol/L)能够预测成功减量或停止吸入激素治疗的可能性为92.5%[21]。本研究中将会在儿童哮喘门诊长期随访过程中监测FeNO的水平变化,为个体化的治疗方案提供依据。
综上所述,本研究认为嗜酸性粒细胞气道炎症是维吾尔族哮喘儿童中最常见的气道炎症,在肺功能损伤方面,中性粒细胞型与嗜酸粒细胞型相同,需要关注这两型患儿在接受抗哮喘治疗后肺功能的转归,同时监测治疗过程中气道炎症指标的变化,还可以帮助判断患儿对治疗的反应。虽然痰细胞学检查、FeNO等这些气道炎症标记物目前在哮喘管理中的作用还比较局限,但未来依照生物标记物的哮喘指南有可能取代依照临床症状的哮喘指南。这就是针对气道炎症的差异采取个性化的治疗方案的基础。儿童哮喘表型的判断标准很多,包括临床表现、遗传因素和生物标记物,本研究只仅限于探讨最为常见的气道炎症表型。目前还有哮喘内型这一概念的提出,从发病机制这一层面上反应疾病本质,并对哮喘进行分型,从功能学及病理学的角度来解释表型当中观察到的特性[22]。这些研究方法都有助于哮喘的诊断、管理和个性化治疗,更进一步体现了哮喘的异质性,为实现精准医疗打下基础。
[1] ANDREAS R,CLAUS F. New concepts in asthma:clinical phenotypes and pathophysiological mechanisms [J]. Drug Discovery Today,2017,22(2):388-396.
[2] 张永明, 林江涛, 苏楠,等. 支气管哮喘患者气道炎症表型研究[J]. 中华结核和呼吸杂志, 2015, 38(5):348-351.
[3] GIBSON P G. Inflammatory phenotypes in aduh asthma:clinical applications[J].Clin Respir J,2009,3(4):198-206.
[4] CHUNG K F. Targeting the interleukin pathway in the treatment of asthma[J].Lancet, 2015(386):1086-1096.
[5] 中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志,2016,54(3):167-180.
[6] TIBOSCH M,de RIDDER J,LANDSTRA A,et al. Four of a kind:asthma control,FEV1, FeNO, and psychosocial problems in adolescents[J]. Pediatr Pulmonol,2012,47(10):933-940.
[7] 中华医学会儿科学分会呼吸学组肺功能协作组.《中华实用儿科临床杂志》编辑委员会.儿童肺功能系列指南(二):肺容积和通气功能[J].中华实用儿科临床杂志,2016,31(10):744-750.
[8] BAKAKOS P, SCHLEICH F, Alchanatis M, et al.Induced sputum in asthma:from bench to bedside[J].Curr Med Chem,2011,18 (10):1415-1422.
[9] SIMPSON J L, SCOTT R, BOYLE M J, et al. Innammatory subtypes in asthma:Assessment and identification using induced sputum[J].Respirology,2006,11(1):54-61.
[10] WOOSILEE J H, KIM H. Exhaled nitric oxide nitricoxid (FeNO) measurements in diagnosing asthma [J]. Respir Med,2012,106(8):1103.
[11] HALLBERG J, THUNQVIST P, SCHULTZ E S, et al. Asthma phenotypes and lungfunction up to 16 years of age-the BAMSE cohort[J]. Allergy,2015(70):667-673.
[12] AMELINK M, de GROOT J C, de NIJS S B, et al. Severe adult-onset asthma:A distinct phenotype[J].J Allergy Clin Immunol,2013,132(2):336-341.
[13] BERRY M, MORGA N, SHAW D E, et al. Pathological features and inhaled eortieosteroid response of eosinophilic and non-eosinophilic asthma[J].Thorax,2007,62(12):1043-1049.
[14] HANANIA N A, WENZEL S, ROSRN K, et al. Exploring the effects of omalizumab in allergic asthma:an analysis of biomarkers in the EXTRA study[J].Am J Respir Crit Care Med,2013,187(8):804-811.
[15] SHAW D E, BERRY M A, HARGADON B, et al. Association between neutrophilic airway infl-ammation and airflow limitation in adults with asthma[J].Chest,2007,132(6):1871-1875.
[16] JUNG J W, KIM S H, KWON J W. Clinical characteristics and long-term outcomes related to sputum eosinophilia in Korean asthmatics[J].Asia Pac Allergy,2011,1(1):16-24.
[17] GRENN R H, BRIGHTLING C E, WOLTMANN G. Analysis of induced sputum in adults with asthma: identification of subgroup with isolated sputum neutrophilia and poor response to inhaled cortieosteroids[J].Thorax,2002,57(10):875-879.
[18] 刘禹, 李志伟, 杨旭,等. 哮喘气道中性粒细胞性炎症表型的临床意义[J]. 中华肺部疾病杂志电子版, 2015, 8(2):28-31.
[19] IORDANIDOU M, LOUKIDES S, PARASKAKIS E. Asthma phenotypes in children and stratified pharmacological treatment regimens [J].Expert Rev Clin Phar, 2017,10(3):293-303.
[20] PIJNENBURG M W, HOFHUIS W, HOP W C. Exhaled nitric oxide predicts asthma relapse in children with clinical asthma remission[J].Thorax,2005,60(3):215-218.
[21] ZACHARASIEWICZ A, WILSON N, LEX C. Clinical use of noninvasive measurements of airway inflammation in steroid reduction in children[J].Am J Respir Crit Care Med,2005,171(10):1077-1082.
[22] 白雪,胡红.支气管哮喘表型及内型研究进展[J].疑难病杂志,2016,15(7):763-767.

